光合-厌氧混合菌群生物共发酵产氢动力学研究
杜金宇 任学勇 青春耀 荆艳艳 李林泽 王 毅
(1.河南牧业经济学院能源与动力工程学院, 郑州 450011; 2.北京林业大学材料科学与技术学院, 北京 100083;3.河南农业大学农业农村部农村可再生能源新材料与装备重点实验室, 郑州 450002)
0 引言
氢能因其清洁、高效、可再生的特点,是一种理想的替代能源。生物制氢能将氢能生产与废弃物利用、太阳能转化和污染治理等相结合,具有广阔的应用前景[1-2]。目前,主要有两种研究较多的生物制氢方法,一是厌氧细菌暗发酵制氢,能够利用廉价而大量的有机废弃物为原料进行制氢,制氢成本低,产氢速率快,但是暗发酵产氢效率较低[3-5]。二是光合细菌光发酵制氢,可以利用暗发酵产氢的代谢产物进行产氢,产氢效率高,但其底物降解能力低,产氢速率慢[6]。为了克服厌氧细菌暗发酵制氢和光合细菌光发酵制氢各自的缺点,根据其代谢过程互补的性质,将暗发酵和光发酵联合起来进行联合制氢可以有效提高制氢效率[7-8]。
越来越多的研究者开始研究将光合细菌和厌氧细菌共同培养建立暗发酵和光发酵同时进行的共发酵产氢体系。FANG等[9]研究发现将厌氧细菌Clostridiumbutyricum和光合细菌Rhodobactersphaeroides共同培养利用葡萄糖为底物的产氢量比单独的暗发酵或光发酵的产氢量大。MIYAKE等[10]将厌氧细菌C.butyricum和光合细菌突变株共同培养产氢,发现两种细菌混合培养的产氢量从1.1 mol/mol上升到7.0 mol/mol(以葡萄糖为底物计)。 ASADA等[11]报道了将Lactobacillus和R.sphaeroidesRV固定化混合培养产氢时,产氢量可以达到7.1 mol/mol。发展两种或多种细菌共存的共发酵产氢体系对于提高生物制氢效率、实现生物制氢规模化应用具有重要意义。
生物制氢最重要的目标就是实现制氢过程优化和控制,以实现规模化绿色生物氢能生产,而制氢过程数学模型的建立则是实现制氢过程优化控制的重要手段[12]。生物制氢动力学的研究以及数学模型的建立和优化能够更好地认识产氢微生物制氢过程中菌体的生长和产物的形成机制,能够有效分析和预测生物制氢的产量和过程控制,从而显著提高生物制氢效率。LUIS等[13]建立了一个连续流生物制氢系统的数学模型,OBEID等[14]建立了一个沼泽红甲单胞菌批式光发酵生物制氢的动力学模型,ZHANG等[15]采用GMOPERZ模型分析了光合细菌混合菌群的光发酵制氢。但是这些研究都是集中于利用现有的模型对生物制氢进行分析和预测,而且只针对产氢量进行数学模型的分析和动力学参数的计算,没有将生物发酵制氢过程中菌体生长、底物消耗以及产氢量统一进行考虑,生物制氢过程的生长动力学、基质消耗动力学以及产氢动力学数学模型的研究还未展开[16]。
本文在研究光合、厌氧混合菌群共发酵产氢特性的基础上,建立混合菌群生物共发酵产氢过程的菌体生长动力学、底物降解动力学和产氢力学模型,分析数学模型中动力学参数变化对共发酵产氢的影响,对数学模型动力学参数的敏感性进行分析。目的在于建立光合、厌氧混合菌群生物共发酵产氢的动力学模型,为生物制氢反应器的运行和优化及生物氢能的实际应用提供参考和依据。
1 实验
1.1 实验材料
1.1.1混合菌群
实验使用的光合、厌氧混合产氢菌群由河南农业大学农业农村部农村可再生能源新材料与装备重点实验室提供,混合菌群筛选过程参见文献[12,17]。该菌群包含5种光合细菌、11种厌氧细菌。
1.1.2培养基
(1)生长培养基:NH4Cl质量浓度0.1 g/L、NaHCO3质量浓度0.2 g/L、K2HPO4质量浓度0.02 g/L、CH3COONa质量浓度0.3 g/L、MgSO4·7H2O质量浓度0.02 g/L、NaCl质量浓度0.2 g/L、酵母膏质量浓度0.1 g/L。培养基在0.1 MPa下灭菌20 min。
(2)产氢培养基:NH4Cl质量浓度0.4 g/L;MgCl2质量浓度0.2 g/L;酵母膏质量浓度0.1 g/L;K2HPO4质量浓度0.5 g/L;NaCl质量浓度2 g/L;谷氨酸钠质量浓度3.5 g/L,葡萄糖质量浓度30 g/L。
1.2 实验方法
1.2.1产氢实验
产氢反应器采用300 mL广口瓶,加入240 mL产氢培养基,在121℃条件下灭菌处理15 min,冷却后接种60 mL(接种量20%)菌种,顶部空间充入氩气,用胶塞密封,石蜡封口。培养温度30℃,利用60 W白炽灯光照,反应器外表面的光照强度为150 W/m2,发酵产生的气体用排水集气法收集,记录产气量[18]。
1.2.2测试方法
(1)氢气浓度
氢气浓度采用安捷伦6820GC-14B型气相色谱仪进行测定。色谱条件:进样口温度100℃,柱温80℃,TCD检测器150℃,进样量500 μL,保留时间2 min,填充有5A分子筛的1 m柱,载气为氩气[19]。
(2)菌体生物量
菌体细胞浓度采用光电比浊法测定,使用721型分光光度计测量菌体细胞在660 nm处的吸光度,对照吸光度与菌体浓度的标准曲线获得菌体浓度。
(3)底物浓度
产氢底物葡萄糖浓度测试采用DNS法测定,利用分光光度计在540 nm波长下测定其OD(吸光度)值,对照标准曲线获得葡萄糖浓度[20]。
2 数学模型
2.1 模型建立
在批式发酵产氢实验中,菌体生物量和产氢底物质量浓度与时间的关系表示[21-22]为

(1)
(2)
其中
式中X——菌体质量浓度
S——底物质量浓度
μ(S)——比生长速率
μmax——最大比生长速率
KS——饱和常数
YX/S——底物利用率系数
t——时间
产氢速率既与产氢菌体质量浓度直接相关,又与光照强度相关。依赖于光照强度的产氢动力学模型可以表示为
(3)
式中VH2——产氢量
YX/P——氢得率系数
β——非生长性产物得率系数
φ(I)——光照强度
当t=0时,令X(0)=X0,S(0)=S0,VH2(0)=VH20。
通过式(1)和式(2)可以得到
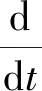
(4)
对式(4)求解可得
(5)

2.2 模型求解
近年来,非线性方程的求解已经有非常深入的研究,研究较多的有同伦摄动法(Homotopy perturbation method)、同伦分析法(Homotopy analysis method)、变分迭代法(Variational iteration method)等[24-25]。同伦摄动法(HPM)因其在零次迭代时能够获得简单的近似解,因此受到广泛应用,本文采用同伦摄动方法对式(1)~(3)非线性微分方程进行求解[26]。菌体质量浓度表示为
(6)
其中
XSS=X0+S0YX/S
将式(6)代入式(4),底物质量浓度表示为
(7)
(8)
式中VH2SS——稳定期产氢量
VH20——起始产氢量
产氢量VH2(t)代入式(1)、(3)、(6)得到
(9)
式(6)、(7)、(9)分别为生物量、底物质量浓度和产氢量的数学表达式,将式(6)、(7)代入式(9)中,可以得到产氢量与底物质量浓度的关系
(10)
3 结果与分析
3.1 动力学参数
动力学参数由实验数据获得。其中μmax=0.3 g/L,KS=10 g/L,YX/S=0.7 g/L,YX/P=0.7 g/L,β=12 g/L,φ(I)=3 000 lx,X0=0.2 g/L,S0=4.2 g/L,VH20=0 g/L。
式(6)~(9)方程的解析解通过同伦摄动法(HPM)进行求解,图1对实验数据获得的菌体质量浓度、底物质量浓度、产氢量和动力学模型进行了对比,模型和实验数据能够很好地保持一致,能够很好地反映产氢过程中菌体质量浓度、底物质量浓度及产氢量的变化情况。

图1 动力学模型和实验数据的对比Fig.1 Comparison of experimental results and kinetics models
3.2 敏感性分析
为了进一步优化动力学模型,有效预测产氢过程中参数的动态变化,对模型的敏感性进行了分析,菌体质量浓度X随μmax、KS和YX/S的变化量分别为79%、-2%和23%。底物浓度S随μmax、KS和YX/S的变化量分别为118%、-15%和-3%。产氢量VH2随μmax、φ(I)和YX/P的变化量分别为98.4%、2%和-0.6%。本研究中最大比生长速率μmax的变化最为重要,因为μmax在菌体质量浓度、底物质量浓度以及产氢量的模型中都直接相关。
图2a~2c分别给出了菌体质量浓度X(t)关于最大比生长速率μmax、底物利用率系数YX/S和饱和常数KS随时间t的变化趋势。从图2a可以看出,最大比生长速率μmax越大,菌体质量浓度X(t)到达稳定期的时间越短。当μmax非常小时,菌体质量浓度达到稳定期的时间会变得很大。图2b给出了底物利用率系数的变化对菌体质量浓度的影响,可以看出,菌体质量浓度X(t)随着底物利用率系数YX/S的增大而增大,这是因为菌体稳定期浓度XSS取决于底物利用率系数YX/S(XSS=X0+S0YX/S)。在各种YX/S情况下,菌体质量浓度在t=80 h时达到最大值。图2c表明,饱和常数KS的变化对菌体质量浓度X(t)的影响相对于μmax和YX/S并不显著。

图2 菌体质量浓度随不同动力学参数的变化曲线Fig.2 Changing curves of concentration of biomass with time under different kinetic parameters
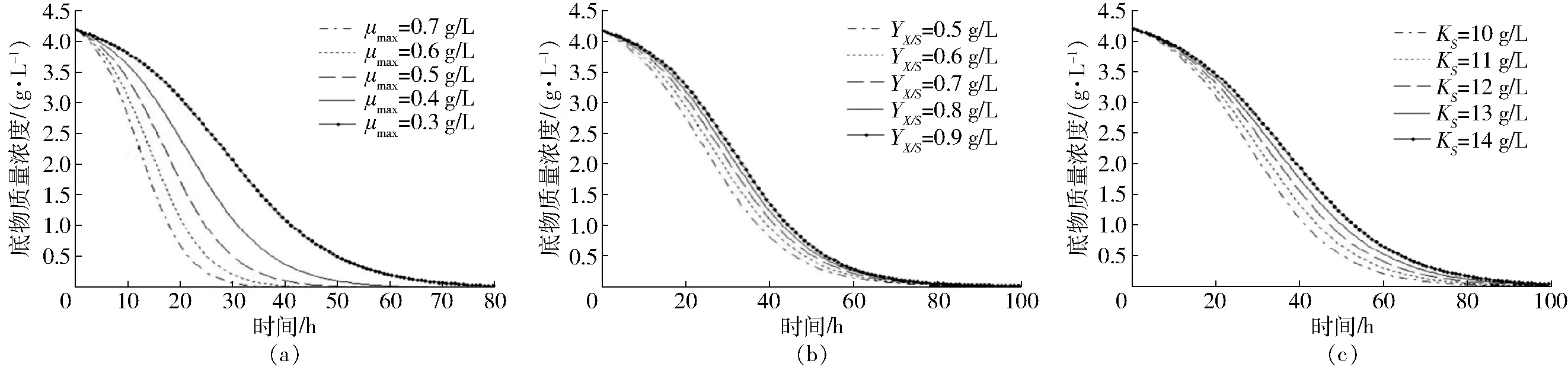
图3 底物质量浓度随不同动力学参数的变化曲线Fig.3 Changing curves of concentration of substrate with time under different kinetic parameters
图3给出了动力学参数的变化对底物质量浓度的影响,从图3a可以看出,底物质量浓度S(t)随着最大比生长速率μmax的增加而迅速降低,很快达到稳定期底物质量浓度SSS=0。从图3b和图3c可以看出,随着底物利用率系数YX/S和饱和常数KS的增大,底物质量浓度会增大。
图4给出了最大比生长率μmax、光照强度φ(I)和非生长性产物得率系数β的变化对产氢量VH2(t)的影响。从图4a可以看出,随着最大生长速率μmax的增高,产氢量VH2(t)也在提高,从图4b可以看出,产氢量VH2(t)和非生长性产物得率系数β也直接相关,VH2(t)随着β的增大而提高。图4c给出了光照强度φ(I)的变化对产氢量VH2(t)的影响,可以看出在其他动力学参数一定的情况下,改变光照强度φ(I)并不会引起产氢量VH2(t)的变化,这是因为光照强度对光合细菌的影响主要体现在光照强度较小的范围内,即使当光照强度超过8 000 lx(图中未列出)时,增加光照强度也不能提高产氢量,该结果与张全国等[27]的研究一致。在其他动力学参数一定的情况下,光照强度对产氢量的影响并不显著,混合菌群生物共发酵产氢过程中,产氢量主要取决于菌体的最大比生长速率,与菌体的生长直接相关,光照强度的影响并不大。
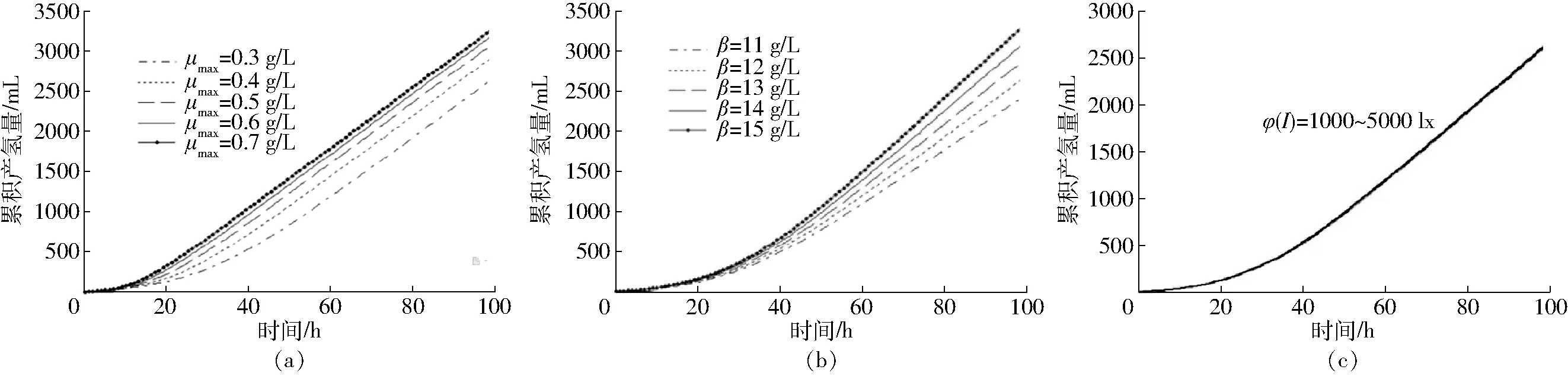
图4 产氢量随不同动力学参数的变化曲线Fig.4 Changing curves of hydrogen production of substrate with time under different kinetic parameters
4 结论
(1)采用同伦摄动法(HPM)对非线性动力学模型进行求解,得到了混合菌群共发酵产氢过程中菌体浓度、底物利用及产氢量的动力学模型,以及共发酵产氢过程中产氢量对于菌体质量浓度、底物质量浓度的动力学模型,建立了产氢量和菌体生长及底物消耗的关系。
(2)通过与实验数据对比,建立的动力学模型与实验数据基本一致,能够很好地反映出共发酵产氢过程中菌体质量浓度、底物质量浓度、产氢量等的变化趋势。
(3)动力学参数中最大比生长速率对模型结果的影响最大,最大比生长速率对菌体质量浓度影响的变化量达到79%,对底物质量浓度影响的变化量达到118%,对产氢量影响的变化量达到98.4%。

