结直肠癌组织中NF-κB、Notch-1和SOCS-1的表达及临床意义
尹志辉 付学源 成立祥
(南华大学附属第一医院肛肠科,衡阳 421001)
结直肠癌是最常见的胃肠道恶性肿瘤,其高发病率和高致死率对人们的生存、生活质量造成了严重威胁[1]。据美国癌症协会统计,结直肠癌在全球范围内每年新增病例约100万,大约有2/3患者接受手术进行根治性治疗,但在5年内仍有超过1/3患者出现肿瘤复发或转移,仅美国每年约50 000人因此肿瘤而致死[2]。在我国,随着人民生活方式和生产环境的变化,结直肠癌的发病率在明显上升[3]。尽管近几年结直肠癌的治疗手段取得了一些进展,但中晚期患者的生存率并没有得到提高,因此对结直肠癌的早期诊断及患者预后的研究,对该病的防治具有重要的现实意义。
核转录因子kappaB(Nuclear transcription factor kappaB,NF-κB)是Rel家族的核转录因子,NF-κB被激活后能控制目的基因,通过抑制NF-κB的活性则尽可能地抑制癌细胞的生长及促进癌细胞的凋亡[4];Notch信号通路是机体内最重要信号通路之一 ,在调节细胞增殖、分化和控制细胞命运方面起着重要作用。正常信号转导通路参与了细胞正常增殖和分化、器官和组织的再生,当异常信号发生时,细胞增殖增加,可以进一步转化为癌[5];细胞因子信号传导抑制蛋白-1(Suppressor of Cytokine Signaling,SOCS-1)是最先发现的负性调节因子,它可抑制多种细胞因子的信号传导,如促生长素(Growth hormone,GH)、白血病抑制因子(Leukemia inhibitory factor,LIF)、抑瘤素M(Oncostatin-M,OSM)、干扰素γ(Interferon-γ,INF-γ)和白介素-2(Interleukin-2,IL-2)等,其中还包括对NF-κB活性的抑制调节作用。SOCS蛋白具有调节细胞因子、控制细胞分化、阻断增强的细胞因子效应,与自身免疫、超敏反应和肿瘤发生密切相关[6]。本研究采用免疫组化法和Western blot法检测结直肠癌组织中NF-κB、Notch-1和SOCS-1的表达,以探讨其临床意义。
1 资料与方法
1.1资料
1.1.1临床资料 本实验收集2016年11月~2017年12月我院结直肠癌根治术后的标本55例(均具备完整临床资料且经病理证实),包括32例男性,23例女性,年龄24~83岁,其中结肠癌26例,直肠癌29例;淋巴结转移37例,无淋巴转移18例;高分化和中分化癌20例,低分化和未分化癌35例,术前均未进行放化疗。另取30例癌旁正常大肠黏膜组织做对照组。用于免疫组化(SP)检测的标本经福尔马林溶液(100 mmol/L)固定,常规石蜡包埋,转移至4℃冰箱。用于Western blot检测的标本在术中组织切除后立即液氮冻存,并转移至-80℃冰箱。
1.1.2Western blot实验试剂 小鼠抗人Notch1单克隆抗体(浓缩型)、兔抗人NF-κB多克隆抗体(浓缩型)、兔抗人SOCS-1 多克隆抗体(浓缩型)、兔抗β-actin多克隆抗体(北京博奥森生物技术有限公司),PVDF膜(美国Milipore公司),考马斯亮蓝试剂盒(南京建成生物试剂有限公司)。
1.2方法
1.2.1NF-κB、Notch-1和SOCS-1表达检测 免疫组化实验:采用SP两步法。小鼠抗人Notch1单克隆抗体(浓缩型)、兔抗人NF-κB多克隆抗体(浓缩型)、兔抗人SOCS-1 多克隆抗体(浓缩型)、SP免疫组化试剂盒及DAB显色剂均购自福州迈新公司。SP免疫组化染色操作严格按照说明书进行,每次染色均设阳性对照(阳性标本)及阴性对照(PBS代替一抗)。Western blot实验:取-80℃冰箱中新鲜结肠癌组织提取总蛋白,用BCA试剂盒检测总蛋白浓度。然后上样、电泳、转膜,放入含5%脱脂奶粉的TBST进行封闭,37℃保温箱90 min;在装有一抗封闭液的杂交袋中过夜,采用TBST液洗膜5次,每次8 min;加二抗封闭液封闭PVDF膜,37℃孵育2 h后曝光,观察结果。采用Lab Works 4.5分析系统软件(美国UVP公司)对Western blot条带进行定量分析,各组目的蛋白的相对表达水平=目的蛋白条带的A值/内参蛋白(β-actin)的A值。
1.2.2结果判定 每例切片选取5个具有代表性的高倍(×400倍)视野,计数1 000个肿瘤细胞中阳性细胞的百分比,并评估染色强度。染色强度高于背景的非特异性染色判定阳性细胞,均值表达率>20%的细胞数为阳性表达。
1.3统计学方法 采用SPSS19.0软件分析。计数资料采用χ2检验,组间比较采用t检验;相关性分析采用Spearman等级相关分析。P<0.05为差异有统计学意义。
2 结果
2.1免疫组化检测NF-κB、Notch-1和SOCS-1在结直肠癌组织中的表达 NF-κB蛋白和Notch-1蛋白在细胞膜和细胞质中均有表达,结直肠癌组织中阳性表达率分别为63.64%、65.45%,明显高于其在正常大肠黏膜组织中的表达率13.33%、10.00%,差异有统计学意义(P均<0.05);SOCS-1蛋白表达于细胞质,正常大肠黏膜组织中的阳性表达率73.3%,明显高于其在结直肠癌组织中的表达率23.64%,差异有统计学意义(P<0.05),见表1和图1。

表1 NF-κB、Notch-1和SOCS-1蛋白在结直肠癌组织及癌旁正常组织中的表达Tab.1 Expression of NF-κB,Notch-1 and SOCS-1 protein in colorectal cancer(CRC)tissues and normal tissues adjacent to cancer
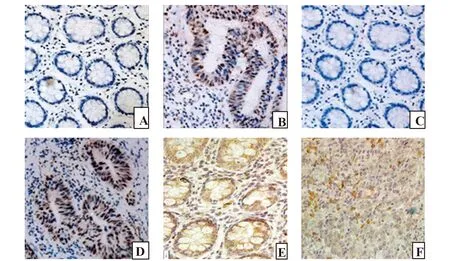
图1 结直肠癌组织和正常大肠黏膜组织中NF-κB、Notch-1和SOCS-1的表达Fig.1 Expression of NF-κB,Notch-1 and SOCS-1 in colorectal cancer tissues and normal colorectal mucosa tissuesNote: Figure A,C and E represent the expression of NF-κB,Notch-1 and SOCS-1 in normal colorectal mucosa,respectively(SP×400);Figure B,D and F represent the expression of NF-κB,Notch-1 and SOCS-1 in the CRC tissues,respectively(SP×400).
2.2NF-κB、Notch-1和SOCS-1的表达与结直肠癌临床病理特征之间的关系 由表2可知,NF-κB、Notch-1蛋白在结直肠癌中的表达与淋巴结转移、浸润深度及分化程度有关(P<0.05),与患者的性别、年龄、肿瘤所在部位无关(P>0.05):NF-κB在无淋巴结转移、未浸润浆膜及高中分化的结直肠癌组织中阳性表达率分别为27.78%、38.10%、35.0%,明显低于有淋巴结转移、浸润浆膜及低分化的结直肠癌组织中阳性表达率78.38%、85.29%、85.71%;Notch-1在无淋巴结转移、未浸润浆膜及高中分化的结直肠癌组织中阳性表达率分别为33.33%、38.10%、40.0%,明显低于有淋巴结转移、浸润浆膜及低分化的结直肠癌组织中阳性表达率81.08%、76.47%、88.57%。SOCS-1蛋白的表达与分化程度密切相关(P<0.05),与其他临床病理因素无关(P>0.05):SOCS-1在高中分化的结直肠癌组织中阳性表达率为55.0%,明显高于低分化的结直肠癌组织中阳性表达率为11.43%。

图2 NF-κB、Notch-1和SOCS-1Western blot检测结果Fig.2 Expression of NF-κB,Notch-1 and SOCS-1 detected by Western blot

表2 NF-κB、Notch-1和SOCS-1的表达与结直肠癌临床病理特征之间的关系Tab.2 Relationship between expression of NF-κB,Notch-1,SOCS-1 and clinicopathological factors in CRC

表3 在结直肠癌中NF-κB、Notch-1和SOCS-1表达的相关性分析Tab.3 Analysis of correlation about expression among NF-κB,Notch-1 and SOCS-1 in CRC
2.3NF-κB、Notch-1和SOCS-1在结直肠癌组织中Western blot检测结果 NF-κB、Notch-1蛋白在正常大肠黏膜组织中的相对表达强度分别为24.001 2±17.05和27.995 5±9.98,明显低于在结肠癌组织中的相对表达强度70.112 3±13.92和88.543 4±16.44,差异均具有统计学意义(t=-10.001,P<0.05;t=-13.012,P<0.05)。SOCS-1蛋白在正常大肠黏膜组织的相对表达强度为37.521 3±7.87,高于结肠癌组织中蛋白相对表达强度11.996 7±4.56,差异具有统计学意义(t=-12.005,P<0.05)。见图2。
2.4NF-κB、Notch-1和SOCS-1在结直肠癌表达中的相互关系 由表3可知,在55例结直肠癌中,NF-κB与Notch-1蛋白在结直肠癌组织中的表达呈正相关(r=0.789,P<0.01),NF-κB与SOCS-1蛋白在结直肠癌组织中的表达呈负相关(r=-0.367,P<0.01),Notch-1与SOCS-1蛋白在结直肠癌组织中呈负相关(r=-0.411,P<0.01)。
3 讨论
目前我国结直肠癌的发病率呈上升趋势,早期结直肠癌多无特异性临床表现,往往发现时已属于中晚期,患者最终多因肿瘤的侵袭、转移发生死亡。因此,及时发现并判断肿瘤病变程度对治疗方案具有相当重要的临床意义。近年来,随着分子生物学在肿瘤研究领域的进展,肿瘤的形成机制被进一步揭示,为肿瘤治疗提供了新的思路。
NF-κB存在于体内多种细胞中,发挥多种调节作用,在不依赖外界刺激的情况下,肿瘤细胞本身也存在炎性信号通路的异常激活。NF-κB信号通路的激活能促进炎症因子、趋化因子、黏附分子、生长因子等相关基因的转录,进而引起肿瘤的发生发展[7]。有研究表明在炎症存在的情况下,NF-κB持续表达会引起肠黏膜细胞过度增生[8]。本研究的免疫组化检测结果显示,NF-κB蛋白在细胞膜和细胞质中均有表达,结直肠癌组织中阳性表达率明显高于其在正常大肠黏膜组织中的表达;Western blot检测结果显示在正常大肠黏膜组织中NF-κB的表达低于其在结直肠癌组织中的表达(P<0.05);NF-κB在结直肠癌中的表达与淋巴结转移、浸润浆膜及分化程度有关(P<0.01),这提示高表达的NF-κB与结直肠癌的发生、发展有关。同时Notch-1和NF-κB的相关性分析可知,NF-κB与Notch-1呈显著正相关,可能机制为Notch-1基因中的NF-κB结合位点与活化的 NF-κB结合,从而激活NF-κB高表达。
Notch-1是Notch在人体4种受体中的一种,Notch-1在细胞分化中起着核心作用,不仅维持干细胞的数量,也决定着细胞的分化命运[9]。持续的Notch-1活化能够诱导内皮细胞的衰老,促使其表达趋化因子以及黏附因子,从而进一步促进嗜中性粒细胞的浸润及肿瘤细胞在内皮上的黏附、渗透、在肺部的聚集,以及术后转移等[10]。本研究免疫组化检测结果显示,在结直肠癌组织中Notch-1蛋白阳性表达率较正常大肠黏膜组织中的表达上升(P<0.05);Western blot检测结果显示,正常大肠黏膜组织中Notch-1在的表达明显低于其在结直肠癌组织中的表达(P<0.05);结直肠癌中Notch-1的表达与淋巴结转移、浸润浆膜及分化程度有关(P<0.01)。我们在研究Notch 信号通路中发现NF-κB是其下游信号的重要分子,Notch 信号通路与NF-κB之间的多重交互和相互作用对结直肠癌的发生发展起到重要作用。文献报道NF-κB与Notch-1表达呈正相关,二者在结肠癌中相互作用并参与其发病过程[11],这提示我们对结直肠癌的研究能以Notch或NF-κB为靶点进行基因治疗以及新药开发。
SOCS-1是SOCS家族中目前研究较深入的新型抑癌基因,研究提示SOCS-1能够介导体外和体内过敏性炎症,同时在调节过程中参与癌细胞、肥大细胞和巨噬细胞的细胞间的相互作用[12]。目前国内外的研究报道了SOCS-1蛋白在胰腺癌、食管癌、前列腺癌、宫颈癌、肝癌中的低表达[13],而其在大肠癌中的研究表达情况甚少。本研究免疫组化结果显示,正常大肠黏膜组织中SOCS-1的表达率明显高于其在结直肠癌组织中的表达(P<0.05);Western blot检测结果显示在正常大肠黏膜组织中的SOCS-1蛋白表达高于结直肠癌组织中蛋白表达(P<0.05);SOCS-1在结直肠癌中的表达仅与分化程度有关(P<0.01),这说明SOCS-1的低表达参与了结直肠癌的发生、发展,实验结果与目前观点一致[14]。此外,结直肠癌中 SOCS-1 的表达与 NF-κB、Notch-1的表达均呈负相关,有文献报道结直肠癌中SOCS-1 表达不足对IκB 的磷酸化起到上调作用[15],激活处于非活化状态的NF-κB多聚体,上调其表达而致癌,而NF-κB 和Notch-1表达呈正相关性,因此可能对Notch-1表达也会产生上调影响。
NF-κB、Notch-1和SOCS-1的异常表达与结直肠癌有密切联系,其表达参与肿瘤侵袭、转移、发生和发展的过程,因此NF-κB、Notch-1和SOCS-1的检测可以对判断结直肠癌的恶性程度、侵袭、转移起到参考作用。通过本研究可以预测多靶点基因分析可能成为判断结肠癌治疗效果、预后的新领域。

