黄淮海地区夏玉米弯孢叶斑病菌遗传多样性分析
常佳迎,刘树森,马红霞,石洁,郭宁,张海剑
黄淮海地区夏玉米弯孢叶斑病菌遗传多样性分析
常佳迎,刘树森,马红霞,石洁,郭宁,张海剑
(河北省农林科学院植物保护研究所/农业部华北北部作物有害生物综合治理重点实验室/河北省农业有害生物综合防治工程技术研究中心, 河北保定 071000)
【目的】针对黄淮海地区发生的玉米弯孢叶斑病,通过分子生物学技术,明确其致病菌新月弯孢()在不同地区和年份间的遗传差异及亲缘关系,为研究该病害的发生和流行提供数据资料。【方法】对2013、2016和2017年采集自黄淮海地区5省(河南、河北、山东、安徽、江苏)的病样进行分离,并采用形态学和分子生物学(ITS和EF-1序列分析)对分离到的菌株进行鉴定,共获得175个新月弯孢菌株。从哥伦比亚大学开发的通用引物中筛选出13条多态性高、重复性好的引物,利用筛选出的引物对175个新月弯孢菌株进行ISSR-PCR扩增,利用Popgen32软件计算多态性比率、Shannon’s信息指数、群体间的遗传距离和遗传相似性,使用NTsys2.10e软件进行UPGMA聚类分析和基于遗传相似系数的主坐标分析,构建聚类分析图和散点图。【结果】利用筛选出的引物对175个菌株进行PCR扩增,共获得105条多态性条带,多态性比率为100%。在群体平均水平上,基因多样性水平(H)为0.3867,Shannon’s的信息指数(I)为0.5682,表明玉米弯孢叶斑病菌具有丰富的遗传多样性;不同地理种群间的遗传多样性存在一定差异,河南和安徽种群遗传多样性最高,江苏种群较低;年度间相同地理来源的菌群亲缘关系较远,相同年份不同地理来源菌群亲缘关系较近。聚类分析显示所有菌株相似系数为0.51—0.93,在相似系数为0.59水平上,175个菌株被划分为2群5个亚群,亚群间表现出年度间的差异,不同地理种群病菌间存在基因交流,遗传相关性较高;主坐标分析结果与聚类分析结果一致,同一年份的菌株明显聚集在一起。【结论】引起黄淮海地区玉米弯孢叶斑病的病原菌群体存在较高的遗传变异,地域相邻的病菌遗传关系较近;同一地区的菌株在年度间表现出一定遗传距离,而同一年份不同地理来源的菌株遗传距离较近。引起该地区玉米弯孢叶斑病的新月弯孢菌株不是以本地菌源为主,其主要菌源可能来自南方水稻和草坪草或东南亚玉米生产区,但也存在少量存活于地表病残体上的菌株可作翌年的初侵染源。
新月弯孢;黄淮海地区;遗传多样性;ISSR
0 引言
【研究意义】玉米弯孢叶斑病(Curvularialeaf spot of maize)是主要由新月弯孢()引起的叶部病害,20世纪80年代以来,在辽宁、吉林、北京、天津、河北、山东、河南、安徽、江苏、云南等玉米种植区相继发生,已成为继大斑病、小斑病之后的又一重要叶部病害,对玉米生产造成严重影响[1-4]。2013年在安徽北部和河南东南部发生较严重,病级为3—7级,严重地块可达9级;2017年在河北省和山东中部发生普遍,但发病程度较轻,为1—3级;在安徽北部发生较重,病级普遍为3—7级,其他年份和地区仅见零星病斑。该病害的发生具有间歇性,其在我国的发生和流行规律目前尚不十分明确。研究玉米弯孢叶斑病不同年份和不同发生区域病原菌群体的遗传多样性,有助于了解各地病原菌的遗传结构,明确年度间不同地理种群间的遗传关系,可为研究病害的发生规律和流行趋势提供重要的基础信息,并为病害的田间防控和预测预报提供重要依据。【前人研究进展】物种DNA的多态性可通过多种分子标记技术快速、高效地检测出来,如RAPD、RFLP、AFLP、ISSR、SSR等[5-7]。其中ISSR分子标记技术可灵敏高效地检测基因组DNA的多态性,与RAPD分子标记技术相比,其具有很好的稳定性和多态性,成本低、操作简单,适合大样本的检测,现已在许多物种的遗传多样性与遗传结构、物种来源、物种形成和种质鉴定等领域广泛应用[8-12]。在弯孢叶斑病菌遗传多样性方面,范永山等[13]研究表明,河北省新月弯孢种内存在较大的遗传差异;张欣芳等[14]对东北地区的弯孢菌遗传多样性进行分析,发现病菌的遗传多样性与致病性有一定关系,与地理来源无密切关系;龚国淑等[15]对10个省(市)的新月弯孢菌株进行遗传多样性分析,明确了新月弯孢种内菌株的遗传多样性与致病性相关,且与地理来源无直接关系,推测可能与各地频繁调运种子所导致的病菌在各地扩散有关;王晓东等[16]使用12个ISSR引物和4个UP-PCR引物对采集自辽宁和安徽的玉米弯孢叶斑病菌进行扩增,发现ISSR技术更适合对弯孢病菌的遗传多样性进行分析,同时证明弯孢病菌存在丰富的遗传变异,且与地理来源无关。【本研究切入点】已有研究表明,新月弯孢的遗传多样性与地理来源无关,而这种现象是由何种因素所导致未见研究报道,且年度间不同地理来源的病菌遗传多样性和亲缘关系尚未明确。因此,本研究以黄淮海地区3年的弯孢病菌为研究对象,采用稳定性和多态性较好的ISSR分子标记技术,对弯孢病菌年度间不同地理种群进行遗传多样性分析,利用遗传多样性信息对病害发生的特征进行解析。【拟解决的关键问题】对采集于2013、2016和2017年黄淮海地区的玉米弯孢叶斑病菌,采用ISSR分子标记技术对不同省份和不同年份间的病菌进行遗传多样性分析,揭示黄淮海地区玉米弯孢叶斑病的流行规律,为病害防控及相关研究提供理论依据。
1 材料与方法
1.1 材料
于2013、2016和2017年9月中下旬,采集黄淮海地区(河南、河北、山东、安徽、江苏)夏玉米弯孢叶斑病病叶,记录采样地点、时间等基本信息,放于标本夹中吸除水分后,干燥条件下保存于信封袋中,采用常规病害组织分离法对样品进行病原菌分离及单孢纯化[17-18],分离获得的所有菌株进行形态学鉴定和分子鉴定(ITS和EF-1序列分析),得到175株新月弯孢病菌(表1)。室内试验于2018年3月在河北省农林科学院植物保护研究所完成。
1.2 模板DNA的制备
将分离到的175个菌株分别接种到PDA平板培养基上,28℃培养5 d,用打孔器(直径为1 cm)取3个菌饼放入PD培养基中,在28℃,180 r/min条件下培养5 d,过滤收集菌丝。收集的菌丝经冷冻干燥后,采用真菌基因组提取试剂盒(北京艾德莱生物科技有限公司)提取DNA。采用ND2000紫外分光光度(Thermo,USA)测定DNA的浓度,统一稀释至50 ng·μL-1,贮存于-20℃保存,备用。
1.3 ISSR分析
1.3.1 ISSR引物筛选 随机选取2013和2016年各1个菌株和2017年的2个菌株的DNA作为模板,对加拿大哥伦比亚大学(University of British Columbia,UBC)60条引物进行筛选,选取扩增条带清晰、多态性高、重复性好的13条引物用于本试验175个DNA样品的扩增。
1.3.2 ISSR-PCR体系及程序 PCR反应体系:2×Es TaqMasterMix 10 μL,引物(10 μmol·L-1)1.5 μL,DNA模板1 μL,加ddH2O补足至20 μL。采用的13条引物见表2。PCR反应程序:95℃预变性5 min,94℃变性30 s,退火(视不同引物而定)45 s,72℃延伸90 s,35个循环,最后72℃延伸10 min。
PCR扩增产物在1.8%琼脂糖凝胶上以电压100 V,电流100 mA,进行电泳50 min,随后使用GelDoc XR+凝胶成像系统进行拍照。
1.3.3 数据分析 对ISSR电泳谱带进行统计,分别用1和0表示条带的有无,缺失条带记为“9”或“.”。使用Popgen32生物软件进行数据运算,计算群体内和群体间的Shannon’s指数和Nei’s指数、等位基因数、有效等位基因数、群体间的遗传距离和遗传相似性[19-21];利用NTsys2.10e软件,采用clustering模块中的SAHN进行UPGMA聚类分析,构建供试菌株的系统聚类图,并进行基于遗传相似系数的主坐标分析(principal coordinates analysis,PCA)。
2 结果
2.1 ISSR-PCR扩增
从60个引物中筛选出13条扩增条带清晰、多态性高、重复性好的引物(表2),对175个采集自不同年度和不同地区的菌株进行ISSR-PCR扩增(图1)。这些引物都具有较好的扩增多态性,共获得105个条带,多分布在200—2 000 bp,其中多态性条带105个,占100%。不同引物扩增出的条带数目不同,多为6—11条,平均每个引物产生8个多态性条带。其中841号引物扩增出的条带数最多(11条),而引物823和847扩增出的条带数最少(6条),13条引物的多态性条带比例均为100%(表2)。
2.2 新月弯孢遗传多态性分析
将分离到的175株新月弯孢按省份分为不同地理来源的5个种群,其遗传多样性分析如表3所示。在群体平均水平上,多态位点为105个,多态性位点平均百分率为100%,观察等位基因数(Na)为2.0000,有效等位基因数(Ne)为1.6761,Nei’s基因多样性指数(H)为0.3867,Shannon’s信息指数(I)为0.5682,表明新月弯孢群体存在丰富的遗传变异。
不同地理来源的种群间,H值在0.2170—0.3665,I值在0.3171—0.5438,表明新月弯孢的遗传多样性在不同地理种群间存在一定差异。总体而言,河南(0.3662)和安徽(0.3665)种群遗传多样性最高,山东(0.3109)和河北(0.3415)种群次之,江苏(0.2170)种群较低。
2.3 新月弯孢遗传相似性分析
为进一步分析新月弯孢各地理种群间的遗传分化程度,将分离到的175株新月弯孢菌株按不同年度和省份分组,计算了Nei’s遗传相似性GS和遗传距离GD(表4),以及群体间的基因分化系数Gst值。不同年份各地理种群间的遗传相似系数为0.6316—0.9869,遗传距离为0.0132—0.4594,表明不同年份地理种群间的分化程度不同,遗传距离不一致。2013年河南与安徽的菌株群体遗传相似系数最高(GS=0.9869),遗传距离最近(GD=0.0132),2017年江苏与安徽的菌株群体,山东与河南、河北的菌株群体遗传相似系数较高,表明同一年份不同地理种群间相关性较高;江苏2017年菌株群体与安徽2016年菌株群体遗传相似系数最小(GS=0.6316),遗传距离最远(GD=0.4594),2016年安徽与2013年安徽、河南菌株群体遗传相似系数较小,表明相关性较低。

表1 供试菌株

表2 ISSR引物扩增

图1 4个引物对部分新月弯孢菌株基因组DNA的ISSR-PCR扩增结果
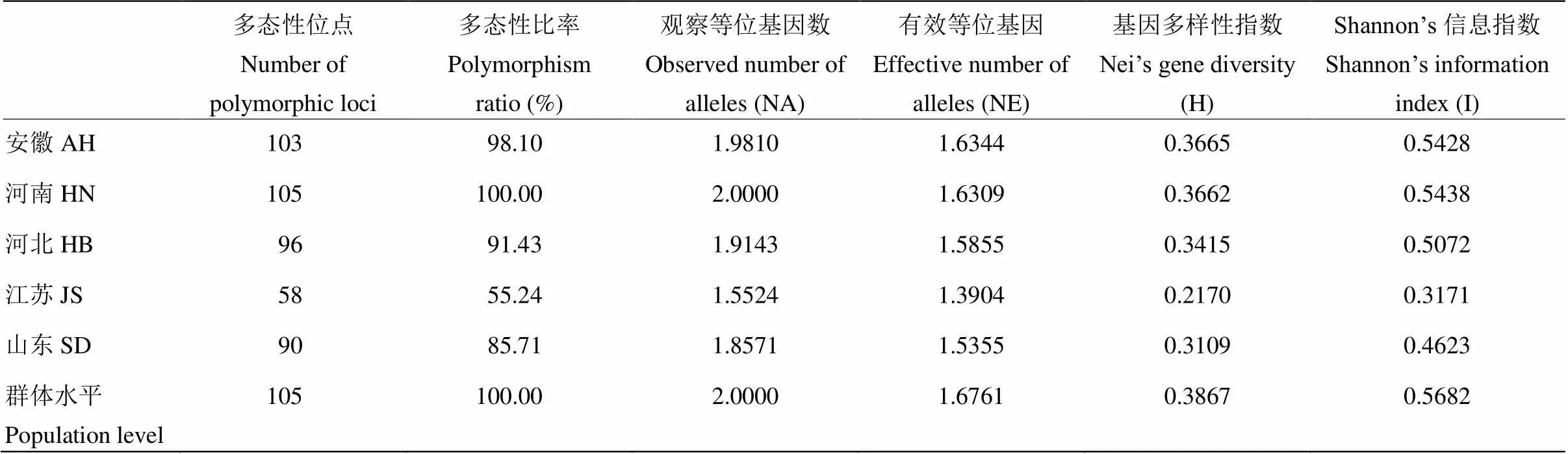
表3 新月弯孢不同地理种群的遗传多样性水平

表4 新月弯孢不同地理种群间的遗传相似性和遗传距离
对角线上方为遗传相似系数,下方为遗传距离Nei’s genetic identity (above diagonal) and genetic distance (below diagonal)
2013和2016年各省份之间的遗传相似系数分别为0.9869和0.7510,遗传距离分别为0.0132和0.2863;2017年各省份之间的遗传相似系数为0.8698—0.9491,遗传距离为0.0522—0.1395;表明相同年份不同地理来源的菌株具有较小的遗传差异。
安徽省2013与2016、2017年的菌群遗传相似系数分别为0.6550和0.7644,2016与2017年为0.6771;河南省2013与2016、2017年的菌群遗传相似系数分别为0.8559和0.8623,2016与2017年为0.7847,表明年度间菌群的亲缘关系相对较远。
2013、2016和2017年菌株群体间的Gst值为0.1569,表明不同年度间遗传变异占种群总遗传变异的15.69%,大部分遗传变异(84.31%)发生在种群内。菌株群体间的基因流Nm为2.6869(<4),表明不同年度间种群有一定的遗传差异;5个地理种群总基因多样性Ht为0.3857,各个种群内基因多样性Hs为0.2582,群体间的基因多样性Dst为0.1275,表明相同年份和省份来源的菌株具有较近的亲缘关系,各地区新月弯孢的基因流Nm为2.9420,表明不同地区间存在一定的基因交流。
2.4 新月弯孢ISSR聚类分析及主坐标分析
利用NTsys2.10e软件对175个菌株进行聚类分析,结果如图2所示,菌株间具有丰富的遗传多样性,相似系数在0.51—0.93。在相似系数0.59水平上,所有的菌株被分为2个大类群(Group 1和Group 2)5个亚群(subgroup)。Group 1包含173个菌株;Group 2包括河南(2013和2017年各1株)2个菌株。Group 1又分为5个亚群,subgroupⅠ为2013年采集自河南和安徽省的63个菌株和2016年采集自河南开封市的1个菌株;subgroupⅡ为2016年采集自河南和安徽的18个菌株;subgroupⅢ为2013年采集自河南许昌市的1个菌株;subgroupⅣ为2017年采集自河南、河北、山东、江苏和安徽的89个菌株;subgroupⅤ为2013年采集自河南周口市的1个菌株。地理种群之间新月弯孢表现出地域相邻,其遗传关系较近,遗传相似系数较高的特点,如河南与安徽,河北与山东,表明不同地域的菌株来源可能相近;同一地区的菌株在年度间表现出一定遗传距离,遗传相似系数较低,表明年度间的菌株初侵染来源可能存在不同。

利用NTSY2.10软件对175份新月弯孢菌株进行基于遗传距离的主坐标分析(PCA),前3个主坐标显示遗传变异分别为11.81%、6.79%、5.79%。三维散点图(图3)显示,175个菌株形成了3个较为独立的分布区,2013、2016、2017 3个年份分别聚合为一个独立的分布区,这与聚类分析结果基本一致。

1—175:新月弯孢菌株编号number of C. lunata strains;坐标轴1、2、3分别代表前3个主成分对遗传变异的贡献率Coordinate axis 1, 2, 3 represent the contribution rate of the first three principal components to genetic variation, respectively
3 讨论
3.1 新月弯孢的遗传多样性
基于PCR的分子标记技术广泛应用于植物、病原菌等物种遗传多样性和亲缘关系的研究,马红霞等[22]利用ISSR分子标记技术证明禾谷镰孢()复合种菌株群体内存在丰富的遗传变异,且遗传多样性与地理来源有关;郭云燕、鄢洪海等[23-24]利用ISSR分子标记技术分析了玉米南方锈病病原菌()的遗传多样性,并对其初侵染源进行了探讨。本研究通过对2013、2016和2017年分离自黄淮海地区5省的175个新月弯孢的ISSR片段多样性进行分析,得到105个多态性条带,多态性比率为100%,表明新月弯孢具有丰富的遗传变异,这一结果与王晓东等[16]的研究结果一致。
在群体平均水平上,Nei’s基因多样性指数(H)为0.3867,Shannon’s信息指数(I)为0.5682,表明新月弯孢群体存在丰富的遗传多样性。5个地理种群的H值和I值的结果趋势一致,河南和安徽省群体具有丰富的遗传多样性水平,江苏省群体遗传多样性较低,可能与江苏种群菌株数目较少有关。UPGMA聚类分析显示,在相似系数0.59水平上,所有的菌株被分为2个大群5个亚群,2013、2016和2017年的菌株明显聚为3支,分别分布于subgroupⅠ、subgroupⅡ、subgroupⅣ。但2013年有2个菌株分别分布于subgroupⅢ和subgroupⅤ,2016年有1个菌株分布于subgroupⅠ,基因流分析结果也表明,不同年度间种群存在一定的基因交流。遗传相似性分析表明,年度间相同地理来源的菌群亲缘关系较远,相同年份不同地理来源菌群亲缘关系较近。
3.2 玉米弯孢叶斑病的初侵染源分析
玉米弯孢叶斑病病菌主要通过气流进行远距离传播,以菌丝体或分生孢子随病残体越冬,有关越冬场所和越冬条件等也有很多相关研究报道。张定法[25]通过对病残体上病原菌越冬存活检测,表明在河南新乡地区病菌的菌丝体在土壤10 cm处越冬率较低;暴增海等[26]对冀东地区玉米弯孢叶斑病菌的初侵染源进行研究,发现该病原菌可随病残体在地表越冬,但存在于10—30 cm土层中的病残体不能越冬;戴法超等[27]研究指出,干燥是病残体中病菌存活和越冬的首要条件,在潮湿条件下病残体容易腐烂,因此埋于土层的病残体未分离到弯孢菌。近年来,由于黄淮海地区耕作制度的改变,多地均采取玉米秸秆深翻还田,而后进行冬小麦种植的耕作措施。弯孢病菌随含水量较高的病残体被深翻埋于土层之中,而冬小麦的种植需进行2—3次灌溉,因此,黄淮海地区的栽培模式未能提供病原菌越冬的适宜条件,本团队多年的田间调查表明该病的发生具有间歇性,且病斑从植株上部向中下部蔓延,具有病原菌的初侵染来源为外来菌源的特点,但并无相关研究证明。本研究结果表明,年度间相同地理来源的菌群亲缘关系较远,相同年份不同地理来源菌群亲缘关系较近,且不同年度间种群存在一定的基因交流。因此推测,黄淮海地区引起玉米弯孢叶斑病的新月弯孢菌株不是以本地菌源为主,同时存在少量存活于田间地表病残体上的菌株可作为本地菌源在翌年进行侵染。
徐辉[28]研究发现,新月弯孢可引起水稻弯孢叶斑病,且在安徽地区有蔓延的趋势;在长江以南地区的水稻田,新月弯孢菌株还可以引起水稻叶鞘黑斑病、穗腐病、穗枯病等[29-32];也可以引起几种禾草草坪草的叶部病害[33-37]。因此南方地区冬季未处理的水稻带菌稻秸和多年生草坪草等可能作为弯孢病菌的越冬场所,第二年病菌随东南气流进入黄淮海玉米生产区,为该地区玉米弯孢叶斑病的发生提供初侵染菌来源;另一种可能是病菌随台风来自东南亚玉米种植区。因此,下一步研究应采集来自南方不同地区不同作物上的新月弯孢菌株进行验证。
3.3 影响病菌变异及群体遗传多样性的因子
遗传多样性及聚类分析结果表明,年度间菌群遗传差异较大,但遗传多样性与地理种群无关。推测可能是由于不是以本地菌源为主所导致;其次病原菌可能随气流或台风从不同菌源地远距离传入黄淮海玉米种植区。同时病原菌变异较快的原因可能是由环境等外界因素所导致。
寄主品种和抗病性差异、栽培模式以及不同地域对病原菌的遗传基因型、毒力表型具有显著的影响[38-39]。刘二明对稻瘟病菌()遗传多样性研究发现,水稻种植品种越多的地区,该地区的群体遗传多样性越丰富[40];对于小麦锈菌()和麦类白粉菌()等专性寄生菌,由于周年循环过程需与寄主相互作用,因此寄主与病原菌之间也可产生互作、变异、适应性改变等[41-42]。黄淮海地区玉米种植品种繁多,且本研究采取田间随机采样模式,因此寄主遗传背景的差异可能会对弯孢病菌的基因型有一定影响。病原物、寄主与环境条件相互作用对病原菌的基因型也产生一定影响。病原菌菌丝体普遍为多核,且每个细胞核均能发育成为单个菌丝体[43-44],这种现象有利于病菌遗传差异的产生,且菌群结构易受环境等外界因素的影响[45],因此环境因素也是造成弯孢病菌年度间差异较大的原因之一。同时本研究中年度间菌群差异明显,可能是由于年度间菌群不是以本地菌源为主所致,以及随气流或台风在高空漂移过程中,来自空中的各种辐射也是导致遗传差异的一个重要因素[23,41]。
4 结论
黄淮海地区玉米弯孢叶斑病菌(新月弯孢)群体内具有丰富的遗传多样性,即存在种内遗传分化现象。聚类分析表明,地域相邻的新月弯孢遗传关系较近,遗传相似系数较高;同一地区的菌株在年度间表现出一定遗传距离,遗传相似系数较低。遗传多样性分析结果表明,引起玉米弯孢叶斑病的新月弯孢菌株不是以本地菌源为主,但也存在少量存活于地表病残体上的菌株可作为翌年的初侵染源。
[1] 戴法超, 高卫东, 吴仁杰, 金晓华. 一种值得注意的玉米病害——弯孢菌叶斑病. 植物病理学报, 1995, 25: 330.
DAI F C, GAO W D, WU R J, JIN X H. A noticeable corn disease: Curvularia leaf spot., 1995, 25: 330. (in Chinese)
[2] 戴法超, 高卫东, 王晓鸣, 吴仁杰, 金晓华. 玉米弯孢菌叶斑病的初步研究简报. 植物保护, 1996, 22(4): 36-37.
DAI F C, GAO W D, WANG X M, WU R J, JIN X H. A preliminary report on Curvularia leaf spot of maize., 1996, 22(4): 36-37. (in Chinese)
[3] 王晓鸣, 戴法超, 朱振东. 玉米弯孢菌叶斑病的发生与防治. 植保技术与推广, 2003, 23(4): 37-39.
WANG X M, DAI F C, ZHU Z D. Occurrence and control of Curvularia leaf spot in maize., 2003, 23(4): 37-39. (in Chinese)
[4] 李富华, 叶华智, 王玉涛, 熊绵平. 玉米弯孢叶斑病的研究进展. 玉米科学, 2004, 12(2): 97-101, 107.
LI F H, YE H Z, WANG Y T, XIONG M P. The research progress of maize Curvularia leaf spot disease., 2004, 12(2): 97-101, 107. (in Chinese)
[5] GAUTAM MURTY S, PATEL F, PUNWAR B S, PATEL M, SINGH A S, FOUGAT R S. Comparison of RAPD, ISSR, and DAMD markers for genetic diversity assessment between accessions ofL. and its related species., 2013, 15: 1007-1022.
[6] 文静. ISSR分子标记技术在植物病原菌研究中的应用. 安徽农业科学, 2010, 38(36): 20658-20660.
WEN J. Application of ISSR molecular marker technique in plant pathogens research., 2010, 38(36): 20658-20660. (in Chinese)
[7] HARITHA G, SUDHAKAR T, CHANDRA D, RAM T, DIVYA B, SARLA N. Informative ISSR markers help identify genetically distinct accessions ofin yield improvement., 2016, 23(5): 225-241.
[8] 李海生. ISSR分子标记技术及其在植物遗传多样性分析中的应用. 生物学通报, 2004, 39(2): 19-21.
LI H S. ISSR molecular marker technology and its application in plant genetic diversity analysis., 2004, 39(2): 19-21. (in Chinese)
[9] 李六英, 窦彦霞, 马冠华, 陈娅, 林凡力, 王秋月. 我国烟草赤星病菌遗传多样性的ISSR分析. 植物保护学报, 2018, 45(4): 846-855.
LI L Y, DOU Y X, MA G H, CHEN Y, LIN F L, WANG Q Y. Genetic diversity analysis of tobacco brown spot pathogens in China by ISSR., 2018, 45(4): 846-855. (in Chinese)
[10] 张小飞, 李晓, 崔丽娜, 邹成佳, 李菁, 龙永昌. 我国玉米灰斑病菌遗传多样性的ISSR分析. 植物保护学报, 2015, 42(6): 908-913.
ZHANG X F, LI X, CUI L N, ZOU C J, LI J, LONG Y C. Genetic diversity analysis ofspp. by ISSR in China., 2015, 42(6): 908-913. (in Chinese)
[11] SANKAR A A, MOORE G A. Evaluation of inter-simple sequence repeat analysis for mapping inand extension of the genetic linkage map., 2001, 102: 206-214.
[12] Badr A, El-Shazly H H, Sayed Ahmed H I, Hamouda M, El-Khateeb E, Sakr M. Genetic diversity ofin Egypt inferred from phenotypic variations and ISSR markers associated with traits of plant size and seed yield., 2017, 15(3): 239-247.
[13] 范永山, 石文伟, 刘永杰, 张建成, 董金皋. 玉米弯孢霉叶斑病菌的寄生适合度与 RAPD分析. 河北农业大学学报, 2008, 31(1): 37-41.
FAN Y S, SHI W W, LIU Y J, ZHANG J C, DONG J G. Parasitic fitness and RAPD analysis ofspecies on corn., 2008, 31(1): 37-41. (in Chinese)
[14] 张欣芳, 苏前富, 宋淑云, 杜俊岐, 刘影, 张伟, 李红, 晋齐鸣. 东北地区玉米弯孢菌的致病性分化与RAPD分析. 玉米科学, 2010, 18(6): 122-126.
ZHANG X F, SU Q F, SONG S Y, DU J Q, LIU Y, ZHANG W, LI H, JIN Q M. Pathogenicity differentiation and RAPD analysis ofin northeast China., 2010, 18(6): 122-126. (in Chinese)
[15] 龚国淑, 叶华智, 张敏, 刘萍, 陈希芹, 邵宝林, 余霞, 杨丹玲. 玉米新月弯孢菌()的RAPD分析. 植物病理学报, 2005, 35(6): 22-27.
GONG G S, YE H Z, ZHANG M, LIU P, CHEN X Q, SHAO B L, YU X, YANG D L. RAPD analysis among isolates ofcollected from corn in China., 2005, 35(6): 22-27. (in Chinese)
[16] 王晓东, 高增贵, 姚远, 刘限, 苏家, 李婉莹. 利用UP-PCR、ISSR标记分析玉米弯孢叶斑病菌遗传多样性. 华北农学报, 2014, 29(3): 227-233.
WANG X D, GAO Z G, YAO Y, LIU X, SU J, LI W Y. Genetic diversity ofby UP-PCR and ISSR analysis., 2014, 29(3): 227-233. (in Chinese)
[17] 张艳菊, 赵珊, 杨森, 周莹莹, 赵伟. 黑龙江省玉米弯孢霉叶斑病病原鉴定. 东北农业大学学报, 2017, 48(6): 17-23.
ZHANG Y J, ZHAO S, YANG S, ZHOU Y Y, ZHAO W. Pathogen identification of Curvularia leaf spot of maize in Heilongjiang Province., 2017, 48(6): 17-23. (in Chinese)
[18] LIU T, ZHAO F Z, WANG Y Y, HOU J M, LIU L Z, SHEN Y Q, LIU Z, ZHANG H T, ZUO Y H. Comparative analysis of phylogenetic relationships, morphologies, and pathogenicities amongisolates from maize in China., 2015, 14(4): 12537-12546.
[19] NEI M. Genetic distance between populations., 1972, 106(949): 283-292.
[20] NEI M. Analysis of gene diversity in subdivided populations., 1973, 70(12): 3321-3323.
[21] WACHIRA F N, WAUGH R, HACKETT C A, POWELL W. Detection of genetic diversity in tea () using RAPD markers., 1995, 38: 201-210.
[22] 马红霞, 孙华, 郭宁, 张海剑, 石洁, 常佳迎. 禾谷镰孢复合种毒素化学型及遗传多样性分析. 中国农业科学, 2018, 51(1): 82-95.
MA H X, SUN H, GUO N, ZHANG H J, SHI J, CHANG J Y. Analysis of toxigenic chemotype and genetic diversity of thespecies complex., 2018, 51(1): 82-95. (in Chinese)
[23] 郭云燕, 陈茂功, 孙素丽, 武小菲, 江凯, 朱振东, 李洪杰, 何月秋, 王晓鸣. 中国玉米南方锈病病原菌遗传多样性. 中国农业科学, 2013, 46(21): 4523-4533.
GUO Y Y, CHEN M G, SUN S L, WU X F, JIANG K, ZHU Z D, LI H J, HE Y Q, WANG X M. Genetic diversity ofUnderw. in China.a, 2013, 46(21): 4523-4533. (in Chinese)
[24] 鄢洪海, 王琰, 张茹琴, 夏淑春, 王志奎, 宋希云. 基于ISSR-PCR对山东玉米多堆柄锈菌遗传多样性的研究及其初侵染菌源的推测. 菌物学报, 2018, 37(2): 157-165.
YAN H H, WANG Y, ZHANG R Q, XIA S C, WANG Z K, SONG X Y. Genetic diversity and deduction of primary infection source ofin Shandong Province based on ISSR-PCR., 2018, 37(2): 157-165. (in Chinese)
[25] 张定法. 玉米弯孢霉叶斑病初侵染菌源的研究.河南农业科学, 1998(8): 24-25.
ZHANG D F. Research the initial infection of Curvularia leaf spot in maize., 1998(8): 24-25. (in Chinese)
[26] 暴增海, 马桂珍, 杨文兰, 吕国忠. 玉米弯孢霉叶斑病的初侵染来源及几种杀菌剂的室内毒力测定. 吉林农业大学学报, 2002, 24(4): 53-57.
BAO Z H, MA G Z, YANG W L, LÜ G Z. Primary source of infection ofand toxicity of some fungicide to the fungi., 2002, 24(4): 53-57. (in Chinese)
[27] 戴法超, 王晓鸣, 朱振东, 高卫东, 霍纳新, 金晓华. 玉米弯孢菌叶斑病研究. 植物病理学报, 1998, 28(2): 123-129.
DAI F C, WANG X M, ZHU Z D, GAO W D, HUO N J, JIN X H. Curvularia leaf spot of maize: Pathogens and varietal resistance., 1998, 28(2): 123-129. (in Chinese)
[28] 徐辉. 水稻弯孢叶斑病病原鉴定及流行学研究[D]. 合肥: 安徽农业大学, 2015.
XU H. Identification of the pathogen and study of epidemiology on rice Curvularia leaf spot[D]. Hefei: Anhui Agricultural University, 2015. (in Chinese)
[29] 金敏忠, 柴荣耀, 张庆生, 林文彩. 水稻黑粒米症状与病原研究初报. 植物保护, 1994(2): 7-8.
JIN M Z, CHAI R Y, ZHANG Q S, LIN W C. Preliminary report on symptoms and pathogens of black grain rice., 1994(2): 7-8. (in Chinese)
[30] 李路, 刘连盟, 王国荣, 汪爱娟, 王玲, 孙磊, 黎起秦, 黄世文. 水稻穗腐病和穗枯病的研究进展. 中国水稻科学, 2015, 29(2): 215-222.
LI L, LIU L M, WANG G R, WANG A J, WANG L, SUN L, LI Q Q, HUANG S W. Research progress of spikelet rot disease and bacterial panicle blight of rice., 2015, 29(2): 215-222. (in Chinese)
[31] 黄微, 夏花, 高必达. 水稻新病害叶鞘黑斑病的病原鉴定. 植物病理学报, 2014, 44(3): 225-231.
HUANG W, XIA H, GAO B D. Identification of the causal agent of a new rice disease sheath black spot., 2014, 44(3): 225-231. (in Chinese)
[32] 金敏忠. 弯孢菌引起的变色米初步研究. 植物病理学报, 1989, 19(1): 21-26.
JIN M Z. A preliminary study on discolored rice grains caused by., 1989, 19(1): 21-26. (in Chinese)
[33] 江明, 黄俊斌, Hsiang T, 郑莉. 杂交狗牙根叶枯病病原鉴定及其生物学特性. 植物保护学报, 2005, 32(3): 275-279.
JIANG M, HAUNG J B, HSIANG T, ZHENG L. Identification and biological characteristics ofcausing leaf blight on, 2005, 32(3): 275-279. (in Chinese)
[34] 刘金平, 张新全, 刘朝辉. 几种禾草对新月弯孢菌的抗病能力. 江苏农业学报, 2005, 21(3): 216-220.
LIU J P, ZHANG X Q, LIU Z H. Resistance of severalgrass species to., 2005, 21(3): 216-220. (in Chinese)
[35] 习平根, 李梅辉, 吴仕豪, 曹俐, 薛硕, 姜子德. 狗牙根草坪草真菌病害的病原菌鉴定. 华南农业大学学报, 2005, 26(2): 31-34.
XI P G, LI M H, WU S H, CAO L, XUE S, JIANG Z D. Identification of the pathogenic fungi on., 2005, 26(2): 31-34. (in Chinese)
[36] 李春杰, 南志标, 崔嵩, 胡玉骄, 李东明, 李强, 李悦, 李舟. 几种真菌对3种常见冷季型草坪草的致病性测定. 草业科学, 2003, 20(12): 75-77.
LI C J, NAN Z B, CUI S, HU Y J, LI D M, LI Q, LI Y, LI Z. Pathogenicity of ten fungi affecting three common cool-season turfgrasses of China., 2003, 20(12): 75-77. (in Chinese)
[37] 翁启勇, 王青松, 何玉仙, 林敏, 余德亿. 福建草坪草病害初报. 草业学报, 1997, 6(2): 70-73.
WENG Q Y, WANG Q S, HE Y X, LIN M, YU D Y. The occurrence of turf diseases in Fujian Province., 1997, 6(2): 70-73. (in Chinese)
[38] 张亚玲, 王宝玉, 台莲梅, 左豫虎, 郑雯, 邓本良, 靳学慧. 黑龙江省和吉林省稻瘟病菌种群多样性研究. 黑龙江八一农垦大学学报, 2014, 26(1): 1-4, 31.
ZHANG Y L, WANG B Y, TAI L M, ZUO Y H, ZHENG W, DENG B L, JIN X H. Study of population structure offrom rice in Heilongjiang and Jilin., 2014, 26(1): 1-4, 31. (in Chinese)
[39] DUAN X, TELLIER A, WAN A, LECONTE M, DE VALLAVIEILLE- OPE C, ENJALBERT J.f. sp.presents high diversity and recombination in the over-summering zone of Gansu, China., 2010, 102(1): 44-53.
[40] 刘二明. 水稻品种与稻瘟病菌的遗传多样性及稻瘟病持续控制研究[D]. 雅安: 四川农业大学, 2001.
LIU E M. Genetic diversity of both rice varieties and blast pathogen,and sustainable control of disease[D]. Yaan: Sichuan Agricultural University, 2001. (in Chinese)
[41] ORDOÑEZ M E, KOLMER J A. Simple sequence repeat diversity of a worldwide collection offrom durum wheat., 2007, 97(5): 574-583.
[42] TROCH V, AUDENAERT K, BEKAERT B, HÖFTE M, HAESAERT G. Phylogeography and virulence structure of the powdery mildew population on its ‘new’ host triticale., 2012, 12: 76.
[43] 郭建国, 杨凤珍, 杜蕙, 金社林, 张新瑞. 甘肃省玉米大斑病菌生理小种结构组成与交配型测定. 植物保护, 2018, 44(6): 85-90, 106.
GUO J G, YANG F Z, DU H, JIN S L, ZHANG X R. Structural composition of physiological races and mating types ofin Gansu., 2018, 44(6): 85-90, 106. (in Chinese)
[44] KNOX-DAVIES P S, DICKSON J G. Cytology ofand its ascigerous stage,., 1960, 47(5): 328-339.
[45] 安鑫龙, 郑晓莲, 董金皋. 玉米大斑病长蠕孢生理小种的遗传变异. 微生物学通报, 2002, 29(2): 53-56.
AN X L, ZHENG X L, DONG J G. Genetic variation of physiological races ofof maize leaf spot., 2002, 29(2): 53-56. (in Chinese)
Genetic Diversity Analysis ofin Summer Maize in Huang-Huai-Hai Region
CHANG JiaYing, LIU ShuSen, MA HongXia, SHI Jie, GUO Ning, ZHANG HaiJian
(Plant Protection Institute of Hebei Academy of Agricultural and Forestry Sciences/Key Laboratory of IPM on Crops in Northern Region of North China, Ministry of Agriculture/IPM Centre of Hebei Province, Baoding 071000, Hebei)
【Objective】The objective of this study is to identify the genetic diversity and relationship of, the causal agent of maize Curvularia leaf spot occurred in different regions and years in Huang-Huai-Hai region via molecular techniques, and to provide scientific data for studying the occurrence and prevalence of the disease. 【Method】The samples collected from five provinces (Henan, Hebei, Shandong, Anhui and Jiangsu) in Huang-Huai-Hai region in 2013, 2016 and 2017 were separated and identified by morphology and molecular biology (ITS and EF-1sequence analysis). A total of 175strains were obtained. Thirteen highly polymorphic and reproducible ISSR primers were screened out from universal primers developed by Columbia University and were used to amplify the 175strains. Popgen32 software was used to calculate the polymorphism ratio, Shannon’s information index, genetic distance and genetic similarity among populations. UPGMA cluster analysis and principal coordinate analysis based on genetic similarity coefficient were carried out by NTsys 2.10e software, and cluster analysis map and scatter plot were constructed. 【Result】A total of 105 polymorphic bands were obtained with a polymorphism ratio of 100%. At the group average level, the level of genetic diversity (H) was 0.3867, and Shannon’s information index (I) was 0.5682, indicating that thehad abundant genetic diversity. The genetic diversity among different geographical populations was different. The genetic diversity of Henan and Anhui populations was the highest, and that of Jiangsu population was low. The flora of the same geographical origin was far away from each other during the year, and the flora from different geographical origins in the same year was relatively close. Cluster analysis showed that the similarity coefficients of all strains were 0.51-0.93. At the similarity coefficient of 0.59 level, 175 strains were divided into 2 groups and 5 subgroups. There were annual differences among the subgroups, gene exchanges among the different geographical populations, and the genetic correlation was high. The results of principal component analysis were consistent with those of cluster analysis, and the strains in the same year were obviously clustered together.【Conclusion】There was a high genetic variation in the pathogen populations causing maize Curvularia leaf spot disease in Huang-Huai-Hai region, and the genetic relationship of the adjacent pathogens was close. the strains from the same area showed a certain genetic distance in different years, while the genetic distance of strains of different geographical origins in the same year was close. The results of the analysis indicated that the main pathogen causing the leaf spot disease ofwas not mainly from local source, they probably came from the southern rice and turf grass or maize production areas of Southeast Asia, but occasionally a few strains that survived on the ground surface could be the initial source of infection in the following year.
Huang-Huai-Hai region; genetic diversity; ISSR
10.3864/j.issn.0578-1752.2019.05.005
2018-10-27;
2018-12-23
国家现代农业产业技术体系(CARS-02)
常佳迎,E-mail:cjy198908@163.com。通信作者石洁,E-mail:shij99@163.com
(责任编辑 岳梅)

