豹纹鳃棘鲈类结节症病原的分离鉴定
徐晓丽,尤宏争,姚学良,李 灏,李 军,包海岩
( 天津市水产技术推广站,天津 300221 )

目前关于豹纹鳃棘鲈相关报道较少,主要集中在人工育苗技术,池塘及工厂化养殖模式,温度、盐度、饲料、光照等对其生理指标、生长、行为的影响等方面[1-3],病害相关的研究较少,仅见豹纹鳃棘鲈感染寄生虫病、弧菌病的报道[4-6]。本试验针对天津地区工厂化车间内养殖的患类结节症的豹纹鳃棘鲈开展病原分离、鉴定及病原耐药性分析等研究,为养殖生产中该病的有效防治提供参考。
1 材料与方法
1.1 试验材料
患病豹纹鳃棘鲈取自天津滨海新区某工厂化养殖车间,病鱼全长约15 cm,车间内养殖水温23 ℃。试验用健康豹纹鳃棘鲈取自莱州明波水产有限公司,全长(13±3) cm,暂养于60 L水族箱,7 d后分组开始进行感染试验。豹纹鳃棘鲈生性凶猛,耗氧量较大,暂养期间为保持氧气充足,增加循环水过滤装置,投饵2次/d,暂养水温24 ℃,盐度20。
1.2 病原分离
取濒死豹纹鳃棘鲈,观察体表,取体表黏液、鳃等制作水浸片,显微镜下排查寄生虫和真菌感染,解剖,检视内部脏器病变,确定疾病典型症状。细菌分离采用接种针刺法进行,分别从病鱼的肝脏、脾、肾刺入,在脑心浸液平板培养基(购自BD biosciences)上划线,过夜培养(28 ℃),第2 d挑取优势菌落进行纯化,直至获得纯培养菌株061101,将菌株061101转接到脑心浸液液体培养基(购自BD biosciences)中培养,并于-80 ℃冰箱中冻存。
1.3 人工感染试验
将菌株061101接种于添加了10%新生牛血清(杭州四季青生物工程材料有限公司)的脑心浸液液体培养基中,置于28 ℃振荡培养箱中培养20 h,用0.01 mol/L的灭菌磷酸盐缓冲液调整菌悬液密度为3×108cfu/mL,之后10倍比稀释至3×104cfu/mL,作为感染试验用菌液。
感染试验分为6组,每组10尾健康的豹纹鳃棘鲈,其中5组为试验组,1组为对照组,试验组分别进行腹腔注射不同倍比稀释密度的菌悬液,对照组注射无菌磷酸盐缓冲液,剂量均为100 μL/尾。
注射后每日观察并记录被感染鱼发病症状和死亡数,饲养方法同暂养期间,试验持续14 d,参照改良的寇氏法计算半数致死密度[7],另取感染症状典型的濒死鱼再次进行病原分离。
1.4 细菌鉴定
细菌鉴定采用传统的形态、生化特性鉴定方法结合16S rRNA基因序列分析进行。
1.4.1 形态及生化指标
取纯化培养的优势菌株061101接种于脑心浸液平板培养基培养,观察菌株061101的菌落特征,制备菌株061101的菌悬液滴片,革兰氏染色。菌株生化特性的测定参照文献[8-9]方法进行,生化鉴定管购自杭州滨和微生物试剂有限公司。
1.4.2 菌株061101的16S rRNA 基因序列分析
以菌株061101菌悬液为模板扩增16S rRNA基因序列[10],PCR产物送至生工生物工程(北京)股份有限公司进行测序,测序结果提交至GenBank数据库,BLAST分析后选取同源性较高的基因序列进行多序列匹配排列,之后以16S rRNA基因为遗传标记,采用邻接法构建系统发育树,所用软件为Mega 5.1,自检次数1000次。
1.5 敏感药物筛选
筛选敏感药物采用药敏纸片法[10],药敏纸片购自杭州滨和微生物试剂有限公司,试验结果判断按照药敏纸片抑菌解释标准进行。
2 结果与分析
2.1 典型症状
患病豹纹鳃棘鲈游泳异常,不摄食;眼球充血,眼泡肿胀,眼睑内充满透明液体鼓出或下垂;蛀鳍;解剖可见肝脏充血发红至黑,肝脏、脾脏、肠系膜上遍布大小不一的白色结节,形状不规则,肾脏坏死,呈黑色米粒状(图1)。显微镜下未发现真菌及寄生虫感染。

图1 病鱼典型症状
2.2 病原分离
自患病鱼内脏分离到优势菌061101,腹腔注射感染证实,菌株061101确能导致健康鱼内脏出现白色结节并死亡,结节大小约0.1 mm,为引起本次类结节症的病原菌。该菌在脑心浸液平板培养基上呈圆形、边缘光滑整齐且湿润的无色半透明菌落,菌落黏稠;染色结果显示,菌体为革兰氏阴性短杆状,长约0.8~2.6 μm,有荚膜,无芽孢,在血平板上呈现明显的β溶血(图2)。

图2 菌株061101菌体形态
2.3 感染试验
以纯培养的菌株061101感染健康豹纹鳃棘鲈,12 d后高密度菌悬液组试验鱼全部死亡,累积死亡曲线见图3。解剖发现,鱼体内脏肠系膜处出现多处白点,肝脏发红,肾脏坏死发黑,而对照组未表现出任何症状,无一死亡。取感染试验的濒死鱼,分离细菌,得到大量菌落形态高度一致的细菌,经鉴定所分离菌株的形态与菌株061101相同,16S rRNA基因序列100%一致,表明菌株061101感染成功,对豹纹鳃棘鲈具有致病性。按改良的寇氏法计算半数致死密度[7],菌株061101对体质量为33 g豹纹鳃棘鲈的半数致死密度为9.49×104cfu/mL(表1),属强毒力菌株[11]。
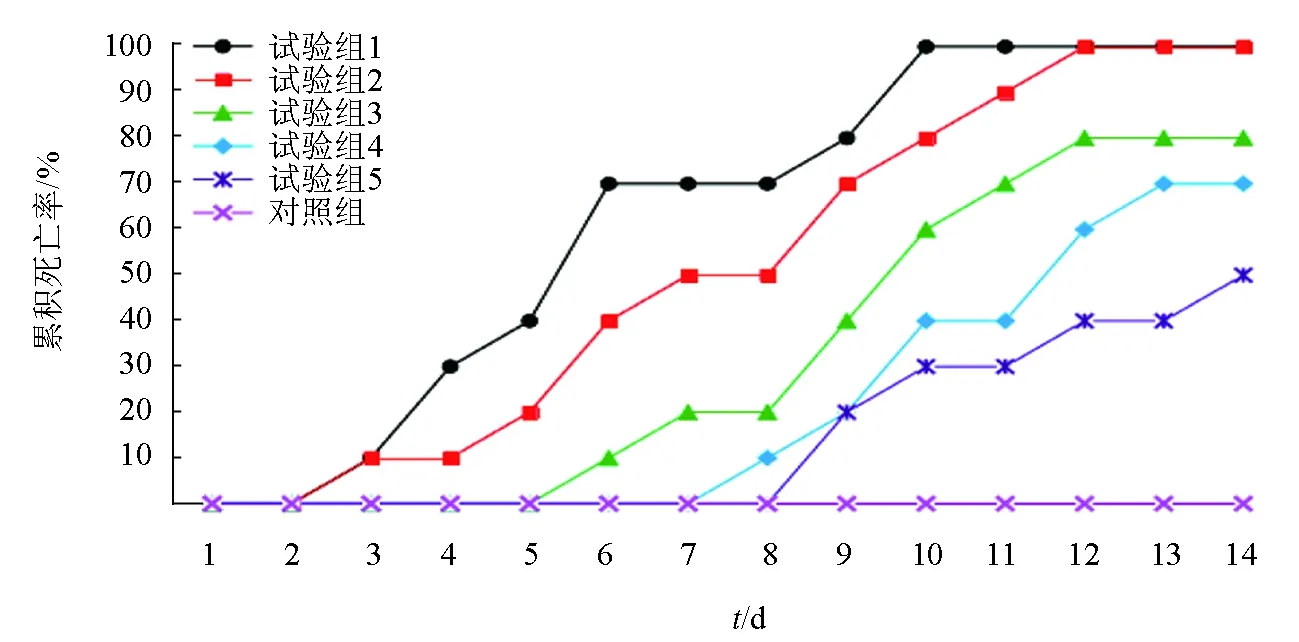
图3 感染试验累积死亡率曲线

组别菌液密度cfu/mL注射剂量mL试验鱼数尾日死亡数/尾1 d2 d3 d4 d5 d6 d7 d8 d9 d10 d11 d12 d13 d14 d累积死亡率%半致死密度cfu/mL试验组13×108试验组23×107试验组33×106试验组43×105试验组53×104对照组磷酸盐缓冲液0.10.110001213001200001001000101210211100100100000011022110080100000000112021070100000000021010150100000000000000009.49×104
2.4 生化特性
生化鉴定结果显示,菌株061101氧化酶、接触酶均为阳性,典型β溶血,不具运动性,无法水解七叶苷,不能产生淀粉酶;发酵型代谢,甲基红、尿酶阳性,可还原硝酸盐,无法利用柠檬酸盐、丙二酸盐,V-P 试验阴性,不能产生赖氨酸脱羧酶、鸟氨酸脱羧酶、β-半乳糖苷酶及吲哚,精氨酸双水解酶阳性,硫化氢试验阴性,糖利用方面仅能利用葡萄糖,不能利用蔗糖、木糖、肌醇、鼠李糖、阿拉伯糖、苦杏仁苷等(表2)。根据生化特性,将菌株061101判定为美人鱼发光杆菌杀鱼亚种(Photobacteriumdamselassp.piscicida)。

表2 菌株061101和美人鱼发光杆菌的生化特性比较
注:“+”,阳性反应;“-”,阴性反应;“d”,11%~89%菌株为阳性.
2.5 16S rRNA基因序列及系统发育分析
采用通用引物27F和1492R扩增菌株061101的16S rRNA基因,得到长度约1500 bp的基因片段。序列比对结果表明,菌株061101与美人鱼发光杆菌杀鱼亚种的16S rRNA基因序列高度一致,基于邻接法构建的系统发育树显示,菌株061101与美人鱼发光杆菌杀鱼亚种(X78105.1)聚为一支,置信度达100%(图4)。结合菌株061101的形态及生化特性,鉴定该病原菌株为美人鱼发光杆菌杀鱼亚种。
2.6 药物敏感性
药敏纸片法试验结果显示,美人鱼发光杆菌杀鱼亚种061101仅对高含量的链霉素(300 μg/片)和庆大霉素(120 μg/片)敏感,对水产常规抗生素类药物恩诺沙星、氟苯尼考均耐药,对多黏菌素B、环丙沙星、阿洛西林等中度敏感(表3)。

图4 以16S rRNA基因构建的系统发育树

抗生素药物含量μg/片敏感性判断标准/mmRIS抑菌圈直径mm敏感性呋喃唑酮300≤1415~16≥177.4R氟苯尼考75≤1213~17≥188.0R恩诺沙星5≤1213~16≥178.7R链霉素300≤67~9≥1014.5S链霉素10≤1112~14≥156.5R红霉素15≤1314~22≥236.5R利福平5≤1617~19≥209.3R多黏菌素B300≤89~11≥1210.3I强力霉素30≤1213~15≥168.9R阿洛西林75≤1718~20≥2118.2I左氟沙星5≤1314~16≥178.1R复方新诺明75≤1011~15≥166.1R环丙沙星15≤1516~20≥2117.4IO/129敏感性150--≥76.2R庆大霉素120≤67~9≥1011.2S克拉霉素15≤1314~17≥189.5R甲氧苄啶5≤1011~15≥167.7R丁胺卡那霉素30≤1415~16≥1715.8I
注:R,耐药;S,敏感;I,中度敏感.
3 讨 论
3.1 美人鱼发光杆菌的致病性
美人鱼发光杆菌杀鱼亚种是鱼类类结节症亦称巴斯德氏菌病的病原,又名杀鱼巴斯德氏菌(Pasteurellapiscicida)。类结节症于1969年首次在日本发现,主要危害日本鱼(Seriola)养殖业,后来发现该菌广泛分布于海洋环境中,宿主多样,致病性强,现已陆续在养殖的大黄鱼(Pseudosciaenacrocea)、龙胆石斑鱼(Epinepheluslanceolatus)、金头鲷(Sparusaurata)、鲆鲽类、鲻鱼(Mugilcephalus)、半滑舌鳎(Cynoglossussemilaevis)、卵形鲳鲹(Trachinotusovatus)、鱼(Miichthysmiiuy)、鲈鱼等鱼类中发现美人鱼发光杆菌杀鱼亚种感染,影响范围广泛[12-19]。自患病豹纹鳃棘鲈内脏中分离到该菌,感染试验也证明其致病性,这在国内外均属首次。美人鱼发光杆菌杀鱼亚种感染不同鱼类表现出的症状有较大差异,但肝脏充血、内脏出现大量大小不等、形状不规则的白色结节为其共有症状。该研究中,患病豹纹鳃棘鲈内脏感染严重,白色结节数量很多,肾脏已坏死呈黑色米粒状,自肝脏、肾脏中分离得到大量菌落形态一致的优势菌,证实了病原菌具有较强致病作用,菌株061101在血平板上呈典型的β溶血,说明该菌胞外产物中含溶血因子,能够使宿主血细胞溶解,这也是宿主造血器官受损失最严重的原因之一。本研究丰富了美人鱼发光杆菌及豹纹鳃棘鲈疾病的研究资料,也为养殖中疾病防治提供了参考。
3.2 细菌鉴定结果分析
本研究对菌株061101的菌种判定,是通过形态、生化特性等传统分类指标、结合16S rRNA 基因序列分析进行的。菌株061101在系统发育分析中与美人鱼发光杆菌杀鱼亚种聚为一类,但个别生化指标与分类手册上记载的存在一些差异,与不同宿主源分离的美人鱼发光杆菌也有差异,可能区域性的地方分离菌株间会存在个别生化指标差异,在对细菌鉴定时不能仅仅依赖于生化指标的完全一致性[16]。
3.3 药敏试验结果分析
生产上对于鱼类细菌病的治疗主要依靠抗生素。但本试验所分离的美人鱼发光杆菌杀鱼亚种表面有一特殊结构——荚膜,组成一般为糖和多肽,可保护细菌不被白细胞吞噬、抵御恶劣环境、抵抗杀菌抑菌物质损伤,即使脱离宿主,在富营养化的水体中也可长期存活,荚膜也可助细菌黏附于机体组织细胞,在细菌侵染宿主中起到重要作用[20-21]。药敏试验结果显示,美人鱼发光杆菌杀鱼亚种061101对多数供试药物不敏感,进一步说明了荚膜对细菌的保护作用。血清、葡萄糖、铁离子对细菌荚膜的形成有促进作用,在无血清等的培养基中连续培养数代,细菌荚膜会消失[22],因此刚从病鱼上分离出来的细菌有致病性,重复继代培养后,致病性迅速下降直至消失。因此本研究在培养美人鱼发光杆菌杀鱼亚种061101进行感染试验时,在培养基中加入血清,以促进细菌荚膜产生,保持其致病力,但由于感染试验时间较短,形成的结节数量较少,直径约在0.1 mm。生产上可从抑制细菌荚膜生成结合使用消毒剂来防止该病原传播。
——和田盘羊

