老年慢性硬膜下血肿及复发的相关因素研究
老年慢性硬膜下血肿(CSDH)起病多隐匿,主要致病因素为头部创伤。在该病的治疗上,钻孔引流术仍是首选方法,但该方法术后并发症较多,且复发率高[1]。老年病人由于存在一定的脑萎缩,钻孔引流术后脑组织膨起较困难,血肿包膜囊中可形成积液,当体位剧烈变动时,易因惯性作用产生负压,使新生血管破裂,导致复发。CSDH的发病机制尚未完全明确,多数学者认为该病是由于头部创伤、脑脊液及血液积聚在硬膜下腔从而诱发局部炎症反应所致,炎症刺激可造成纤维蛋白沉积机化,导致硬膜边缘假膜与新生血管生成,引起反复出血,加之受到血肿腔内凝血障碍的影响,最终引发CSDH[2]。为进一步探讨老年CSDH可能的发生机制及术后复发预测方法,本研究对我院近年来收治的老年CSDH病人的血清及血肿液中D-二聚体(D-D)、转化生长因子β1(TGF-β1)、神经元特异性烯醇化酶(NSE)及血管内皮生长因子(VEGF)水平进行了检测,现报道如下。
1 资料与方法
1.1 一般资料 研究对象为我院2016~2017年收治的60例老年CSDH病人,所有病人均经头颅CT或MRI检查等确诊。同时排除伴颅内其他疾病,如颅内出血、蛛网膜下腔出血、脑积水、脑梗死等病人;既往存在颅脑手术史病人;近2个月内有急慢性感染史病人;术前凝血功能障碍病人;术前使用过可对凝血及纤溶产生影响的药物病人。其中男39例,女21例,年龄60~87岁,平均(71.7±5.9)岁,病程1~6个月,平均(2.12±0.85)个月。无明确头部外伤史8例,占13.33%;有明确头部外伤史52例,占86.67%。同时选取30例健康对照组,其中男20例,女10例,年龄60~90岁,平均(72.8±6.2)岁。健康对照组入选标准为2个月内无急慢性感染史,既往无颅脑手术史。
1.2 复发诊断标准 参照Abouzari等[3]的定义,即与术后1~3 d相比,术后3个月内原手术部位硬膜下液体量有增多,病人可伴意识改变、局部神经功能障碍、再发性头痛等表现。
1.3 手术方法 指导病人取仰卧位,视病人情况选择全麻或局麻,常规消毒铺巾,于血肿最厚处确定钻孔位置,十字切开硬脑膜,随后将陈旧性积血缓慢放出,悬吊硬膜,清除血肿后以生理盐水反复冲洗血肿腔,至引出液澄清后停止冲洗,留置引流管。保持引流通畅,避免过度引流。术后定期复查CT。
1.4 标本采集 60例CSDH病人于术中采集病人的血肿液与末梢静脉血各5 mL。30例健康对照组取清晨空腹静脉血5 mL。将标本置于真空采血管(血凝管3.2%枸椽酸钠)内,以3000 r/min速度离心10 min,取上清液血清,并保存在-80 ℃冰箱内待测。
1.5 检测方法 采用酶联免疫吸附法(ELISA)检测血肿液及血清VEGF、TGF-β1、NSE水平;采用免疫比浊法检测D-D水平。
1.6 统计学分析 采用SPSS 20.0对数据进行分析,计量资料以均数±标准差表示,2组比较采用成组t检验或配对t检验,多组比较采用F检验;计数资料比较采用χ2检验。以P<0.05为差异有统计学意义。
2 结果
2.1 复发情况 60例老年CSDH病人中复发11例,复发率为18.33%。11例复发病人复发时间均为术后4周内。
2.2 各组生化指标比较 CSDH组血肿液中D-D、TGF-β1、NSE、VEGF水平均较CSDH组及对照组血清水平显著增高(P<0.05);CSDH组血清NSE水平较对照组血清浓度显著升高(P<0.05),CSDH组与对照组血清中D-D、TGF-β1、VEGF含量比较,差异均无统计学意义(P>0.05)。见表1。
2.3 CSDH复发组与未复发组血肿液生化指标比较 CSDH复发组血肿液中D-D、TGF-β1、NSE、VEGF水平均较未复发组显著升高(P<0.01)。见表2。
2.4 CSDH复发组与未复发组血清中生化指标比较 CSDH复发组血清NSE含量较未复发组血清水平显著升高(P<0.01),CSDH复发组与未复发组血清中D-D、TGF-β1、VEGF浓度比较差异均无统计学意义(P>0.05)。见表3。

表1 CSDH组与对照组各样本中D-D、TGF-β1、NSE、VEGF水平比较
注:与CSDH组血肿液比较,*P<0.05;与CSDH组血清比较,△P<0.05
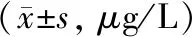
表2 CSDH复发组与未复发组血肿液生化指标比较
注:与CSDH未复发组比较,**P<0.01
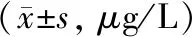
表3 CSDH复发组与未复发组血清生化指标比较
注:与CSDH未复发组比较,**P<0.01
3 讨论
CSDH的发生与血肿外膜新生血管的生成及出血密切相关。电镜下可观察到血肿外膜有大量新生毛细血管,红细胞与血浆成分经内皮细胞间隙渗出,新生血管基底膜不完整或缺如,使得血管壁通透性增加,血肿外膜因此易反复出血,造成血肿不断扩大[4]。VEGF可通过与血管内皮细胞上分布的两种特异性受体(flk-1、klt-1)结合,以及通过作用于血管生成素与其受体,刺激新生血管生成,使血管通透性增大。VEGF可增加内皮细胞纤溶酶原激活物(tPA)的表达,使纤溶系统激活,引起纤溶亢进,使出血加重,进而促使CSDH形成。TGF-β1是由单核细胞、T淋巴细胞、纤维母细胞、内皮细胞等分泌的多肽细胞因子,主要分布于人血小板与骨骼中。TGF-β1可促进新生血管的生成与成熟进程,对血管内皮细胞的迁移、增生、分化过程可起到调节作用,其水平的异常升高与人体组织纤维增生疾病存在密切的相关性[5-6]。
研究显示,TGF-β1可促使血管内皮细胞分泌出大量的VEGF,后者则可促进新生血管的生成[7-8]。本研究结果显示,老年CSDH病人血肿液内VEGF、TGF-β1水平均显著高于CSDH血清及健康对照组血清水平。该结果提示,VEGF、TGF-β1在CSDH血肿腔内呈高表达,其可能参与了血肿腔内局部生化反应以及CSDH的发生及发展。CSDH外膜组织内皮细胞与巨噬细胞分泌出大量VEGF,从而促进血肿外膜大量的新生毛细血管生成。又因新生血管基底膜不完整或缺如,通透性大,红细胞与血浆成分易渗入血肿腔内,进一步刺激了新生毛细血管生成,引起CSDH持续扩大。Hong等[8]发现,CSDH外膜VEGF浓度越高,其治疗后复发的风险越大。该发现与本研究中CSDH复发组血肿液内VEGF水平显著高于未复发组的结果具有较高的一致性,上述结果进一步提示了老年CSDH的发病以及复发与VEGF导致的新生血管活跃密切相关。
D-D是交联纤维蛋白在纤溶酶作用下生成的一种降解产物,也是纤维蛋白降解产物中最小片段,当体内出现血栓性病变与纤溶亢进时,其水平会显著升高。任东坡等[9]的研究显示,CSDH血肿液内D-D水平较外周静脉血有显著升高,提示CSDH血肿腔中存在纤溶亢进。本研究也得出相似结论。王晓东等[10]通过检测血肿液与外周静脉血中D-D含量得出,血肿液内D-D含量明显高于外周血含量,而通过应用氨甲苯酸冲洗血肿腔以抑制纤溶亢进后,病人术后复发率与未冲洗组病人相比显著降低。该结果间接反映了CSDH的复发与血肿腔内纤溶亢进密切相关。上述研究结果均证实了在CSDH的发病与复发中,局部纤溶亢进起着重要作用。
NSE是一种存在于脑组织中的酸性可溶性蛋白,并特异性存在于成熟神经元与神经内分泌细胞中,在脑脊液、血清中其含量极低,但当脑神经元受到损伤、血脑屏障被破坏后,NSE可大量释放至血液以及硬膜下积液中[11]。老年CSDH病程相对较长,脑组织由于长时间受到压迫,可致神经元细胞与神经内分泌细胞长期处于缺血缺氧状态,从而造成神经元与神经内分泌细胞的凋亡、崩解,NSE即可从细胞中释放至血肿液及外周血中。本研究中,老年CSDH病人血清及血肿液内NSE水平均较健康对照组血清水平显著升高,CSDH血肿液内NSE水平则显著高于CSDH血清水平,而CSDH复发组血清及血肿液内NSE水平均较未复发组有明显升高。该结果提示,老年CSDH血清及血肿液内NSE水平均可较好地评估病人的病情以及预后情况。该结果与吴瑞岳[12]的研究基本一致。
综上所述,老年CSDH病人血肿液内D-D、TGF-β1、NSE及VEGF水平均有异常升高,通过检测血肿液及血清中D-D、TGF-β1、NSE及VEGF水平有助于评估其病情及预后情况,可作为复发预测的有效指标。

