帕金森病患者外周血中免疫相关细胞的分析
徐泽恒,乔 蕊,蒋 森,孟新玲,杨新玲*
(1新疆医科大学第二附属医院神经内科,乌鲁木齐 830063;2新疆医科大学附属中医院脑病一科;*通讯作者,E-mail:poplar862@sohu.com)
帕金森病(Parkinson’s disease,PD)是一种常见的中老年人神经系统退行性病变,我国65岁以上人群中的患病率为1.7%[1],其特征性的临床主征是静止性震颤、肌张力增高、运动迟缓及姿势平衡障碍,明显影响老年人群的生活质量。其病因学研究显示帕金森病发病与年龄、遗传、氧化应激、环境等因素有关,近年来,研究者又从动物实验中发现,中枢神经系统的免疫反应与神经系统退行性病变之间有相关性。既往研究显示,血脑屏障的存在,机械性地阻止多种物质由血液进入脑组织[2],因此外周免疫在机体非感染状态下较少影响中枢神经系统。但目前已有相关动物实验提示,帕金森病模型小鼠的黑质处有T淋巴细胞浸润[3],提示帕金森病的发病及病程进展可能与免疫反应有关。因此,外周血中的体液免疫反应及细胞免疫反应是不是加速中枢神经系统神经元变性退化引起了研究者的重视,本研究通过比较帕金森病患者外周血中免疫相关细胞与健康对照组的差异性及探讨是否与疾病严重程度有关,以期为帕金森病的诊治及延缓病情进展提供新的诊疗方法。
1 对象和方法
1.1 研究对象
1.1.1 病例组 选择2017-12~2018-08就诊于新疆医科大学第一附属医院神经内科,并经副主任及以上医师明确诊断为PD的患者,共105例,其中男性57例,女性48例。汉族58例,维吾尔族32例,哈萨克族15例,其年龄在50-72岁,平均(59.90± 5.36)岁,病程2-15年。符合英国脑库帕金森病诊断标准[4]。入选病例组按照统一帕金森氏病评分量表第三部分(UPDRS Ⅲ)进行评分。
1.1.2 对照组 共103名,其中男性53名,女性50名。汉族55名,维吾尔族31名,哈萨克族17名,年龄在51-72岁,平均(59.91± 5.00)岁,为同期健康体检者,无明显疾病史。
入选和排除标准:病例组为有典型帕金森病病史,对照组为同期健康体检者。病例组及对照组均排除自身免疫性疾病、正在使用对免疫系统有影响的药物及患有影响免疫系统的疾病,并排除肿瘤性疾病、血液病,且外周血未见炎性指标异常。
1.2 研究方法
采用微量全血直接免疫荧光染色法,检测外周血中T细胞、B细胞及NK细胞亚群的百分比。每位受试者均采集清晨空腹静脉血于抗凝管中,实验时每份血样中取等量微量全血,每份微量全血针对所测淋巴细胞亚群的不同而加入对应的细胞表面特异性分子的荧光抗体进行标记。所用荧光标记的抗体为:APC标记的抗人CD4抗体,PE标记的抗人CD3抗体,FITC标记的抗人CD8抗体,PE标记的抗人CD25抗体,FITC标记的抗人CD56抗体,FITC标记的抗人CD19抗体。以上抗体购自美国BD公司。每份微量全血经充分标记后,经过红细胞裂解及离心分离后,再对其进行重悬,上流式细胞仪检测淋巴细胞亚群百分比。考虑标本保存时间及温度对淋巴细胞数量的影响,每份新鲜血标本从收集至上流式细胞仪不超过3 d时间[5]。
1.3 统计学处理
采用SPSS23.0统计软件进行数据分析,计数资料采用构成比表示,组间差异性分析采用卡方检验,计量资料采用均数±标准差表示,如资料符合正态分布,两组间差异性分析采用两独立样本t检验,三组及以上采用方差分析,如不符合正态分布,采用秩和检验来进行分析。采用Pearson相关分析各个指标间的相关性,以P<0.05为差异有统计学意义。
2 结果
2.1 临床资料比较
病例组及对照组在性别、年龄、民族分布上差异无统计学意义(P>0.05),具有可比性(见表1)。
2.2 病例组及对照组T、B淋巴细胞亚群及NK细胞百分比结果分析
2.2.1 病例组与对照组比较 病例组CD3+、CD4+、CD25+T淋巴细胞亚群较对照组百分比值降低(P<0.01),CD8+T淋巴细胞亚群、CD19+B淋巴细胞亚群及CD56+NK细胞与对照组相比,差异无统计学意义(见表2)。
表1病例组及对照组基本信息比较
Table1Comparisonofbasicinformationbetweencasegroupandcontrolgroup
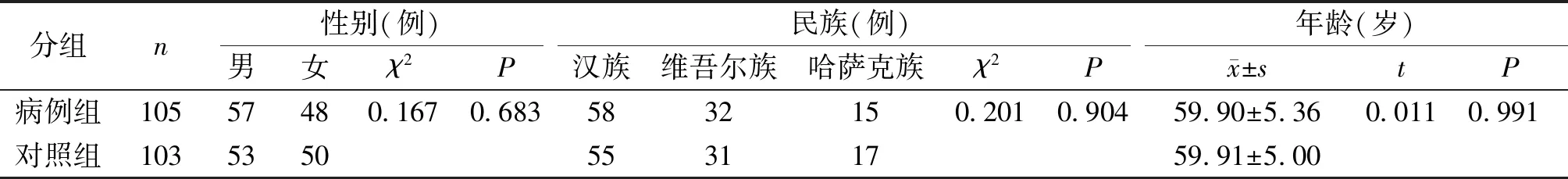
分组n性别(例)民族(例)年龄(岁)男女χ2P汉族维吾尔族哈萨克族χ2Px±stP病例组10557480.1670.6835832150.2010.90459.90±5.360.0110.991对照组103535055311759.91±5.00
表2T淋巴细胞亚群在病例组及对照组结果比较(%)
Table2ComparisonofTlymphocytesubsetsbetweencasegroupandcontrolgroup(%)
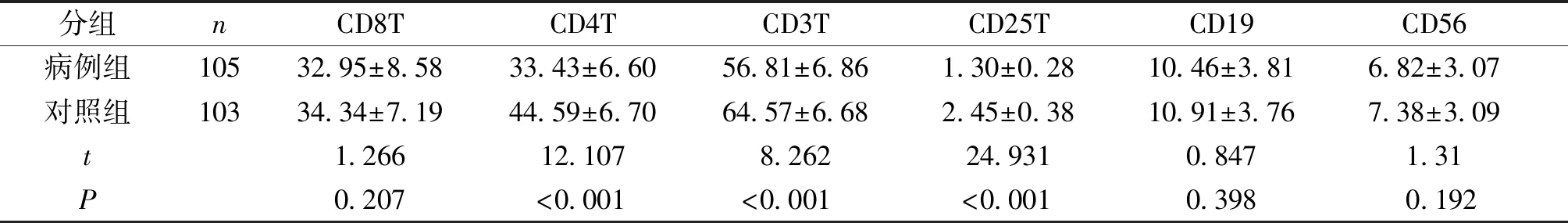
分组nCD8TCD4TCD3TCD25TCD19CD56病例组10532.95±8.5833.43±6.6056.81±6.861.30±0.2810.46±3.816.82±3.07对照组10334.34±7.1944.59±6.7064.57±6.682.45±0.3810.91±3.767.38±3.09t1.26612.1078.26224.9310.8471.31P0.207<0.001<0.001<0.0010.3980.192
2.2.2 相关性分析 进一步对病例组的CD3+、CD4+、CD25+T淋巴细胞亚群百分比与UPDRS评分第Ⅲ部分分值进行相关性分析,经Pearson相关性分析显示,UPDRS评分结果与CD4+T、CD3+T、CD25+T细胞指标间均具有相关性,且为负相关,差异有统计学意义(见表3)。
3 讨论
PD是位居第二位的神经系统退行性病变,临床上以椎体外系为症状,主要表现少动、僵直及震颤等症状,病情进行性加重,严重影响患者的身心健康及生活质量,病程晚期多因严重的运动障碍导致卧床,并引发坠积性肺炎、褥疮等并发症,预后差。PD病理表现为中脑黑质处多巴胺能神经元的变性、凋亡,导致多巴胺能神经递质减少,引起纹状体内乙酰胆碱-多巴胺两种递质失去平衡而发病,往往患者就诊时,黑质处的多巴胺能神经元损失大于50%以上,引起纹状体处多巴胺能神经递质明显较少。目前研究结果提示引起多巴胺能神经元凋亡的原因与年龄、基因易感性、环境因素等有关[6]。多巴胺能神经元减少的具体机制可能与氧化应激、兴奋性毒性所致的胞内钙超载、线粒体功能障碍、蛋白水解应激等有关。PD患者脑部尸检提示黑质内残存多巴胺能神经元胞体内有路易小体形成,其主要成分为α-Synuclein。脑中其他部位的多巴胺能神经元亦有损害,但其程度较黑质-纹状体系统轻。基于PD患者胞内异常蛋白质的产生,及针对性的多巴胺能神经元损伤,提示嗜酸性包涵体内的异常蛋白质可能作为一种自身抗原,引发了免疫反应,引起多巴胺能神经元的损伤及减少。故近年来从免疫角度研究其发病起因及病情进展的动物实验及临床研究逐渐增多。以期能尽早干预脑内发生的慢性炎症反应,减缓神经元的损伤,延缓病情的进展。
表3病例组淋巴细胞亚群百分比与UPDRS评分第Ⅲ部分相关性分析结果
Table3CorrelationbetweenthepercentageoflymphocytesubsetsandpartⅢofUPDRSscoreincasegroup

指标rPCD3T-0.82<0.001CD4T-0.614<0.001CD25T-0.571<0.001
随着基础医学的发展,在分子细胞水平上对PD的病理生理反应有了突破性的发现,对黑质处细胞成分的观察分析发现其小胶质细胞较脑内其他部位更为密集[7],而小胶质细胞承担起中枢神经系统的免疫反应。激活的小胶质细胞释放神经毒性因子,导致其周围多巴胺能神经元的损伤及死亡[8]。国内徐评议教授课题组对一例PD患者进行尸检,发现其黑质部有CD4+、CD8+T淋巴细胞浸润及表达HLA-DR阳性的小胶质细胞。同时也有实验提示PD模型鼠黑质处有CD+T淋巴细胞聚集[9],且异常聚集的α-Synuclein可以激活小胶质细胞引起炎症反应[10],提示脑内的免疫紊乱可能与原位的小胶质细胞激活及周围淋巴细胞的募集两者均有关。而已有的研究在分子水平及解剖结构上均有证据可支持免疫反应参与其病情进展[11-13]。从分子水平上,有研究提示在PD患者的胃肠道及颈深部淋巴结检测到α-Synuclein[11,12]。不同于以往认为的血脑屏障可高度阻断外周免疫与中枢神经系统的作用,已有研究显示血脑屏障的基底膜增厚和空泡形成[13],且有解剖学上发现脑膜内有淋巴导管样结构,可以引流脑脊液至颈深淋巴导管,故中枢神经系统的免疫豁免地位受到质疑,也引发了科研工作者的猜想,即脑内的异常蛋白可以引起抗原呈递细胞及淋巴细胞发生免疫反应,中枢的异常蛋白质可能作为一种抗原,刺激外周免疫系统,引起免疫反应作用于原发病变部位[14]。因此,本实验基于对上述免疫角度的研究方向,对PD患者外周血中免疫相关细胞进行分析,以期发现在PD病程中是否有一定的变化规律,从而为其诊疗带来新的方法。
在机体的免疫系统中,细胞免疫主要依靠T淋巴细胞介导,根据T淋巴细胞表面特异性表达分子的不同,将其分为:CD8+T淋巴细胞亚群,参与直接细胞杀伤作用;CD4+T淋巴细胞亚群,介导免疫提呈反应,联合B淋巴细胞辅助体液免疫反应。近年来在CD4+T淋巴细胞亚群中发现了CD4+CD25+Foxp3+T淋巴细胞亚群,及调节性T淋巴细胞亚群(regulatory T cells,Treg),该T淋巴细胞亚群可以分泌TGF-β及IL-10等细胞因子,参与免疫抑制,有研究表明其可以通过抑制小胶质细胞对异常蛋白即硝基化的α-syn的免疫反应而起到保护神经元的作用[15]。本研究提示PD患者外周血中CD3+T淋巴细胞、CD4+T淋巴细胞及CD25+T淋巴细胞外周血百分比水平低于健康对照组,差异具有统计学意义。且与UPDRS Ⅲ评分成负相关,与既往赵旭[16]及冯雪仪等[17]临床研究结果相一致。也有研究提示CD3+T淋巴细胞水平显著高于健康对照组[18]。结合病理学提示黑质处存在HLA-DR阳性小胶质细胞,考虑PD患者黑质处引起多巴胺能神经元损伤的免疫反应性质以细胞免疫反应为主。进一步考虑黑质处的异常免疫反应可能与T淋巴细胞浸润、归巢等反应有关。
体液免疫反应主要为B淋巴细胞通过抗原刺激,产生针对性的抗体,起到适应性免疫反应作用。且PD患者基底节处的α-Synuclein作为一种异常蛋白质,是否可以触发B淋巴细胞及抗原提呈细胞引起体液免疫反应。而既往有病例对照研究提示PD患者血清中IgG水平较高,且差异具有统计学意义[19]。国内也有实验提示PD患者血清IgG可以依赖补体系统杀伤多巴胺能神经元[20]。而笔者的资料显示,PD组B淋巴细胞水平较健康对照组无明显差异,可以认为PD患者体液免疫反应未见明显异常,考虑与B淋巴细胞较T淋巴细胞浸润及穿过血脑屏障程度受限更明显有关。
而NK细胞为机体固有免疫的主要组成部分,其细胞表面特异性表达CD56抗原,该类细胞可以分泌大量的细胞因子调控免疫反应及杀伤病原体,有相关动物实验提示在选择性阻止NK细胞向中枢神经系统归巢反应的小鼠模型中,可以引起中枢神经系统炎症反应及自身免疫反应[21],进一步考虑NK细胞是否可以影响中枢神经系统内的慢性炎症反应。有基于上述观点的病例对照研究提示PD患者外周血中NK细胞较对照组水平上升,结论具有统计学意义[22],而本实验未见NK细胞在两组中有明显差异性。笔者考虑与其向PD中枢神经系统的归巢较T淋巴细胞弱有关。
PD患者黑质处聚集的HLA-DR阳性小胶质细胞、T淋巴细胞及浸润的炎症因子,提示其病理生理反应过程很可能与细胞免疫有关,进一步说明了黑质处多巴胺能神经元的减少与免疫反应有关,且该种免疫反应可能涉及外周免疫细胞的参与。但其使动因素仍未有相对明确的定论,是外周的免疫紊乱激活了胶质细胞,亦或是中枢异常蛋白质的形成,刺激了外周免疫系统,仍需进一步研究以明确。由于实验时间的限制,本实验未进行更进一步的追踪随访,如追踪同一患者病程中动态随访其淋巴细胞及炎症因子水平波动情况及免疫细胞成分及比例的变化情况,且进行同一患者同时期外周血及脑脊液中炎症因子水平的变化情况,可进一步明确PD患者免疫紊乱发生的详细情况,以期为诊疗带来新的发现。

