大黄素对高脂饮食小鼠肾皮质氧化应激的影响
张 丽,孙 耀,2*,刘宝华,李 江,刘鲁汉,于亚丽
(1南京泰康仙林鼓楼医院药剂科,南京 210000;2锦州医科大学药学院;3葫芦岛市第二人民医院内分泌科;4浙江省中医院药剂科;5锦州医科大学附属第一医院内分泌科;*通讯作者,E-mail:15261794028@163.com)
近年来,肥胖的发病率逐年升高[1,2]。肥胖的人体和小鼠存在肾脏损伤,甚至可发展为终末期肾病,其发病机制目前还不十分清楚[3]。在无症状肥胖患者或动物身上,可以观察到肾小球肿大,肾小球硬化,足突细胞肥大,足突消失[3]和Ⅳ型胶原沉积[4]。氧化应激损伤是糖尿病肾病病理生理过程中的一种形式。肥胖可以导致糖尿病,但是肥胖过程中,肾脏皮质是否受到氧化应激损伤,目前尚未见报道。
活性氧簇(reactive oxygen species,ROS)是诱导氧化应激的主要物质之一,可以攻击生物膜而生成超氧化物,如丙二醛(malondialdehyde,MDA)等。总超氧化物歧化酶(superoxide dismutase,SOD)可清除超氧化物,对机体的氧化与抗氧化平衡起着至关重要的作用[5]。因此,检测各组小鼠肾皮质中、MDA和SOD可以反映组织中氧化应激状态。
大黄素是从大黄等中草药根和茎中提取的一种具有生物活性的蒽醌,其具有抗菌、抗炎、抗溃疡、抗肿瘤、调节免疫力和抗糖尿病作用[6,7]。经研究,大黄素对糖尿病肾病具有一定的治疗作用[8]。本课题组之前的研究结果证明,大黄素对高脂饮食诱导的肥胖小鼠肾损伤具有一定的保护作用[9],但是大黄素是否可以改善肥胖小鼠肾皮质氧化应激损伤还不十分清楚。
PPAR-γ是糖尿病和肥胖中针对胰岛素抵抗治疗的靶点之一[10],吡格列酮是PPAR-γ的一种特异性激动剂,可以改善小鼠的胰岛素抵抗[11]。在之前的研究中,我们发现,大黄素可能通过改善肥胖小鼠肾脏局部的胰岛素抵抗对肥胖相关性肾病具有一定的保护作用[9]。有学者研究也认为大黄素可以通过PPAR-γ改善糖尿病小鼠的糖代谢[12-14]。本研究利用吡格列酮作为阳性对照,拟探究大黄酸是否也可上调PPAR-γ,并改善高脂饮食小鼠肾皮质的氧化应激。
1 材料和方法
1.1 主要试剂
大黄素(北京清源保生物科技有限公司),BCA定量试剂盒(万类生物科技有限公司),兔抗鼠PPAR-γ多克隆抗体(万类生物科技有限公司),β-actin多克隆抗体(Absci,美国),辣根过氧化物酶(HRP)标记的山羊抗兔二抗(Absci,美国)和ECL发光试剂盒(万类生物科技有限公司)。ROS检测试剂盒(万类生物科技有限公司),MDA测定试剂盒(万类生物科技有限公司),SOD测试盒(万类生物科技有限公司)。
1.2 实验动物及分组处理
7周龄雄性C57BL/6J小鼠56只,购买自北京华阜康生物可以有限公司,适应性喂养1周,随机分为5组:普通饮食组(NC,n=8)、高脂饮食组(HFD,n=12)、低剂量大黄素处理组(L-EM,n=12)、高剂量大黄素处理组(H-EM,n=12)和吡格列酮对照组(PI,n=12)。NC组给予普通饮食和生理盐水灌胃,HFD组给予高脂饮食(含60%脂肪,20%碳水化合物,20%蛋白质)和生理盐水灌胃,L-EM组和H-EM组给予高脂饮食和大黄素灌胃[30 mg/(kg·d)]和50 mg/(kg·d),PI组给予普通饮食和吡格列酮[(1.95 mg/(kg·d)]灌胃。适应性喂养后,各组小鼠特定饮食贯穿整个实验,灌胃在实验结束前6周开始实施至实验结束。灌胃期间每周检测血糖1次。空腹血糖大于11.1 mmol/L者剔除。不同饮食喂养12周后(20周龄)及灌胃6周后(26周龄)分别称小鼠体质量,实验结束后,从HFD组、L-EM、H-EM组和PI组随机选取8只用于实验。
1.3 生化指标测定
实验结束后断头取血,新鲜血离心(3 600 r/min,4 ℃)后,检测各组小鼠空腹血糖、空腹胰岛素,血肌酐、血尿素氮,并计算胰岛素抵抗指数。提尾法搜集小鼠24 h尿液,估算24 h尿蛋白排泄率。血清标本生化指标为样本经生理盐水稀释3倍,尿标本稀释经生理盐水稀释4倍,经检验科中心试验室由全自动生化分析仪检测,然后根据稀释倍数换算。
1.4 Western blotting检测肾皮质PPAR-γ
肾皮质组织蛋白利用RIPA提取,经据BCA蛋白定量试剂盒定量后,调整各组蛋白浓度至3 mg/ml。聚丙烯酰胺凝胶电泳将蛋白分离后至PVDF膜,PPAR-γ多克隆一抗(1 ∶800)4 ℃孵育过夜,过氧化物酶标记的二抗孵育2 h(常温),ECL试剂盒显影后,Image J软件分析条带灰度值,量化后进行统计分析。
1.5 氧化应激指标测定
肾皮质以磷酸盐缓冲液介质匀浆后离心取上清,根据ROS检测试剂盒、MDA测定试剂盒和SOD检测试盒说明书指示,测定各组小鼠肾皮质ROS、MDA和SOD含量。
1.6 统计学分析
计量资料以均数±标准差表示,单因素方差分析进行多组间比较,若存在组间差异,采用LSD法作两两比较,P<0.05认为差异具有统计学意义。
2 结果
2.1 大黄素对各组小鼠体质量的影响
经适应性喂养1周后(8周龄),各组小鼠体质量之间差异无统计学意义。经普通饮食或高脂饮食喂养12周后(20周龄),与NC组小鼠相比,HFD组、L-EM组、H-EM组和PI组小鼠体质量明显增加,差异有统计学意义(P<0.05),且HFD组、L-EM组、H-EM组和PI组小鼠体质量差异无统计学意义。经生理盐水、大黄素或吡格列酮灌胃6周后(26周龄),与NC组相比,HFD组小鼠体质量明显增加,与HFD组相比,L-EM组、H-EM组和PI组小鼠体质量降低,且与L-EM组相比,H-EM小鼠体质量更低,差异有统计学意义(P<0.05,见表1)。
表1不同时期各组小鼠体质量的比较(g)
Table1Comparisonofbodyweightsofmiceatdifferenttimepointsbetweenfivegroups(g)
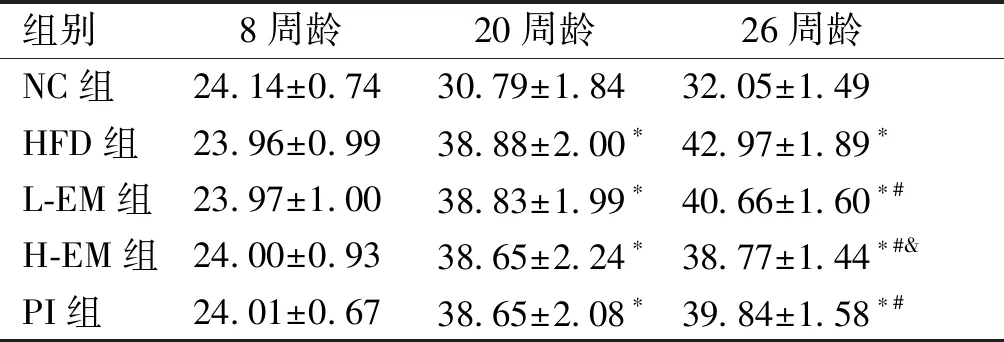
组别8周龄 20周龄 26周龄 NC组24.14±0.7430.79±1.8432.05±1.49HFD组23.96±0.9938.88±2.00∗42.97±1.89∗L-EM组23.97±1.0038.83±1.99∗40.66±1.60∗#H-EM组24.00±0.9338.65±2.24∗38.77±1.44∗#&PI组24.01±0.6738.65±2.08∗39.84±1.58∗#
与NC组相比,*P<0.05;与HFD组相比,#P<0.05;与L-EM组相比,&P<0.05
2.2 大黄素对小鼠空腹血糖、空腹胰岛素、胰岛素敏感指数的影响
与NC组相比,HFD组小鼠空腹血糖、空腹胰岛素水平增加,胰岛素敏感指数降低;与HFD组相比,L-EM组、H-EM组和PI组小鼠空腹血糖、空腹胰岛素水平降低,胰岛素敏感指数增加,差异有统计学意义(P<0.05)。但L-EM组与HFD组相比,小鼠空腹血糖和胰岛素敏感指数差异无统计学意义。与L-EM组相比,H-EM组空腹胰岛素水平降低,差异有统计学意义(P<0.05,见图1)。
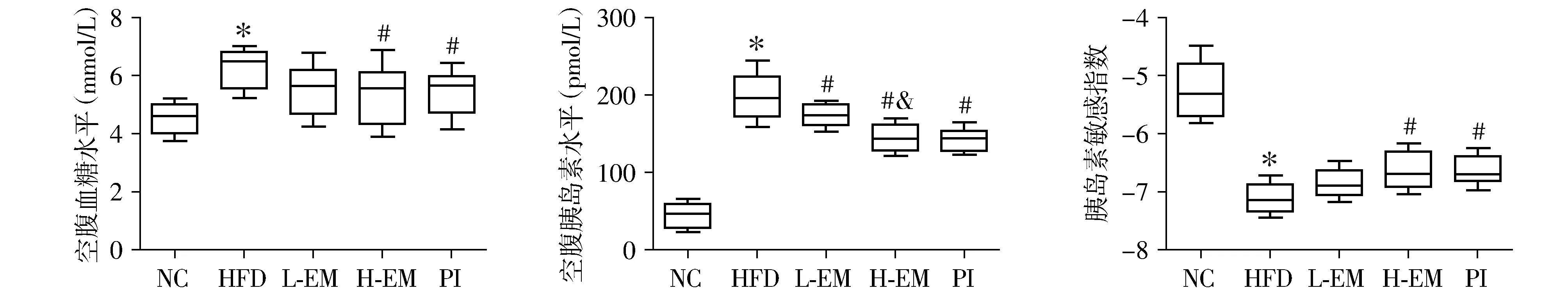
与NC组相比,*P<0.05;与HFD组相比,#P<0.05;与L-EM组相比,&P<0.05图1 各组小鼠空腹血糖,空腹胰岛素和胰岛素敏感指数的比较Figure 1 Comparison of fasting plasma, fasting serum insulin and insulin sensitivity index between five groups
2.3 大黄素对小鼠血肌酐、血尿素氮、24 h尿蛋白排泄率的影响
各组小鼠血肌酐水平差异无统计学意义。与NC组小鼠相比,HFD组小鼠24 h尿蛋白排泄率明显增加;与HFD组相比,L-EM组和H-EM组小鼠血尿素氮水平降低,差异均具有统计学意义(P<0.05)。与HFD组相比,L-EM组、H-EM组和PI组小鼠24 h尿蛋白排泄率明显减少,差异均具有统计学意义(P<0.05)。与L-EM组,H-EM组小鼠24 h尿蛋白排泄率减少,但差异无统计学意义(见图2)。
2.4 大黄素对小鼠肾皮质氧化应激指标的影响
与NC组相比,HFD组小鼠肾皮质ROS和MDA含量增加,SOD活力下降,差异均具有统计学意义(P<0.05);与HFD组相比,L-EM组、H-EM组和PI组小鼠肾皮质ROS和MDA含量减少,SOD活力增加。但HFD组和L-EM组ROS含量和SOD活力间差异无统计学意义,HFD组和PI组SOD活力间差异无统计学意义。与L-EM组相比,H-EM组小鼠肾皮质ROS和MDA含量减少,SOD活力增加,但差异无统计学意义(见图3)。
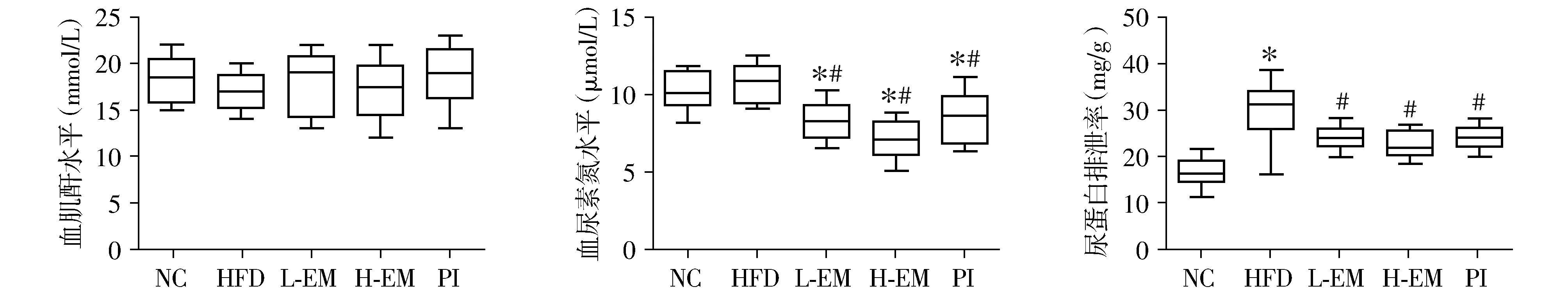
与NC组相比,*P<0.05;与HFD组相比,#P<0.05图2 各组小鼠血肌酐、血尿素氮、尿蛋白排泄率的比较Figure 2 Comparison of serum creatinine, blood urea nitrogen, and urine creatinine between five groups

与NC组相比,*P<0.05;与HFD组相比,#P<0.05图3 各组小鼠ROS、MDA含量和SOD活力的比较Figure 3 Comparison of ROS, MDA levels and SOD activity between five groups
2.5 大黄素对小鼠肾皮质PPAR-γ的影响
与NC组相比,HFD组小鼠肾皮质PPAR-γ表达量减少(P<0.05);与HFD组相比,L-EM组、H-EM组和PI组小鼠肾皮质PPAR-γ表达量增加,但与HFD组相比,L-EM组小鼠肾皮质PPAR-γ表达量差异无统计学意义。与L-EM组相比,H-EM组小鼠肾皮质具有更高的PPAR-γ表达量,差异具有统计学意义(P<0.05,见图4)。
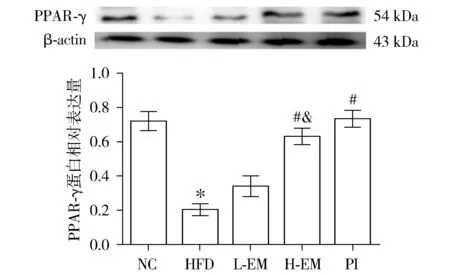
与NC组相比,*P<0.05;与HFD组相比,#P<0.05;与L-EM组相比,&P<0.05图4 各组小鼠肾皮质PPAR-γ表达量的比较Figure 4 Comparison of PPAR-γ levels in kidney of mice between five groups
3 讨论
肥胖相关性肾病在近年来引起了越来越多研究者的关注[3],但是其发病机制尚不十分明确。为了探究肥胖相关性肾病早期存在的变化,本研究利用高脂饮食诱导了肥胖小鼠,结果与正常小鼠相比,肥胖小鼠血肌酐和尿素氮水平无明显变化,但是24 h尿蛋白排泄率略有增加。为了进一步探究大黄素对肥胖相关性肾病的保护作用,本研究利用不同浓度的大黄素治疗高脂饮食诱导的肥胖小鼠,结果显示,大黄素可以降低高脂饮食诱导小鼠的血尿素氮和24 h尿蛋白排泄率。
氧化应激损伤是糖尿病肾病发生发展过程中的重要机制之一[6]。肥胖可以导致糖尿病,肾皮质是肾小球主要分布的区域,但是在肥胖相关性肾病中,肥胖小鼠的肾皮质是否存在氧化应激损伤还不十分清楚。如前言所述,ROS、MDA和SOD可反映组织的氧化应激状态[6]。为了探究肥胖相关性肾病小鼠肾皮质是否存在氧化应激损伤,本研究检测了各组小鼠肾皮质的ROS和MDA含量和SOD活力,结果显示,大黄素可以降低高脂饮食小鼠肾皮质的氧化应激损伤水平。
在之前的研究中[9],大黄素可以通过改善肾皮质的胰岛素抵抗而对肥胖相关性肾病具有一定的保护作用。吡格列酮是一种经典的PPAR-γ激动剂,可以改善胰岛素抵抗。为了进一步探究大黄素改善肥胖小鼠肾皮质氧化应激的机制,本研究设置了吡格列酮对照组,发现吡格列酮和大黄素都可以降低肥胖小鼠24 h尿蛋白排泄率血尿素氮。
为了进一步探究大黄素是否通过PPAR-γ改善各组小鼠肾皮质的氧化应激损伤,本研究检测了各组小鼠肾皮质的PPAR-γ表达量,结果发现,肥胖小鼠肾皮质PPAR-γ表达减少,大黄素和吡格列酮处理后,PPAR-γ表达量增加。也就是说,大黄素可能通过PPAR-γ改善了肥胖小鼠肾皮质的氧化应激水平,但是其结论的准确性仍需要通过利用基因修饰的小鼠和(或)PPAR-γ特异性激动剂和(或)特异性阻断剂作进一步研究。
致谢:
辽宁省自然科学基金(201602308)提供了部分的科研资金,锦州医科大学药学院实验室为本实验提供了实验设备。

