肝苏片中槲皮素提取条件研究
罗 倩,孙雁霞,赵 彪,邬晓勇
(1.成都大学药学与生物工程学院,四川成都 610106;2.民办四川天一学院,四川德阳 618200;3.成都国嘉联合制药有限公司,四川成都 610036)
肝苏片为单味中药赶黄草提取再加入淀粉、糊精、滑石粉等原辅料而制成的中药成方制剂,中医认为其具有清热利湿的功效,临床上常用于急性病毒性肝炎、慢性活动性肝炎的治疗[1-3]。赶黄草中主要化学成分为黄酮类化合物,而槲皮素作为黄酮类化合物中最具代表性的生理活性物质之一,具有多种生物学功能,包括抗炎、扩张冠状动脉、清除自由基、下调由活性氧介导的下游信号通路,抑制多种恶性肿瘤细胞增殖等[4-6]。由于目前肝苏片的含量在测定过程中存在含量小、波动大、不直观等缺点,虽然很多的研究已经对色谱条件进行了最适宜的筛选,但是都忽视了对提取条件的考察,因此笔者对肝苏片主药赶黄草的主要成分槲皮素的提取条件进行了考察,采用HPLC对一定范围的供试品提取溶剂酸度以及回流水浴温度进行了考察,以期为肝苏类制剂的质量标准提供参考[7-9]。
1 材料与方法
1.1材料
1.1.1原材料。肝苏片由古蔺肝苏药业有限公司提供。
1.1.2主要试剂。槲皮素对照品(批号100081-200406,中国药品生物制品鉴定所);甲醇(色谱纯,成都思为科学仪器有限公司);磷酸(分析纯,成都市金山化学试剂有限公司);盐酸(分析纯,四川西陇化工有限公司);去离子水(成都国嘉联合制药有限公司)。
1.1.3主要仪器。LC-10AT液相色谱仪(岛津分析仪器有限公司);BK-360B超声波清洗机(济南业兴通工程机械有限公司);DZTW电子恒温水浴锅(北京永光明医疗仪器厂);SHB-III循环水式多用真空泵(上海比朗仪器有限公司);sartorius BS224S(电子天平广州普测仪器有限公司);JY1800 RO反渗透纯净水系统(广东净源纯水设备有限公司)。
1.2方法
1.2.1色谱条件。色谱柱为Kromasile C18柱;检测波长370 nm;进样量20 μL;流速1.0 mL/min;柱温30 ℃;流动相:将配好的0.2%磷酸溶液和甲醇按45∶55混匀,然后用0.45 μm的滤纸过滤,经超声除气,即得。本液每次临用配制;色谱系统适用性试验:理论板数按槲皮素峰计算应大于或等于1 800,槲皮素与相邻峰之间分离度小于或等于1.5[10]。
1.2.2标准曲线的绘制。线性范围参照文献[11],即以峰面积(Y)对进样量(X)回归,得回归方程Y=5.195×105X+1.236×103(R2=0.999 5),其中Y为峰面积,X为槲皮素浓度。由此方程得到槲皮素在0.01~0.15 g/L线性关系良好。根据其线性范围,再参照现行肝苏片试用标准中含量测定项下对照品的浓度,笔者选择以每1 mL甲醇含20 μg的槲皮素作为对照品溶液。
1.2.3对照品溶液的制备。先称取适量槲皮素对照品到称量瓶中,在120 ℃下干燥4 h,取出放入干燥器中冷却后,再用电子天平精密取约2.000 mg已干燥至恒重的槲皮素至100 mL容量瓶中,并记录称样量,加甲醇稀释至刻度,制成每1 mL甲醇中含20 μg的槲皮素溶液,即是对照品溶液。
1.2.4供试品溶液的制备。取肝苏片10片,除去包衣,研细后用电子天平精密称取约0.15 g,并记录。将称取的粉末放入锥形瓶中,分别加入0.3%、0.5%、1.3%、1.5%、2.3%、2.5%盐酸甲醇溶液40 mL,分别又以55、60、65、70、75、85 ℃为水浴温度加热回流1 h后,冷却至室温后转移至50 mL容量瓶中,并清洗回流烧瓶几次,加甲醇稀释至刻度,充分摇匀,用有机系滤头过滤,取续滤液作为供试品溶液。
1.2.5槲皮素含量的计算。在“1.2.1”色谱条件下首先将准备好的对照品溶液吸取20 μg注入液相色谱仪检测后记录峰面积,计算连续5次进样后得到峰面积的RSD值,若大于2%则系统不稳定,需重新再进5次,直至连续5次进样RSD小于2%,则系统稳定,计算5次峰面积的平均值作为对照品的峰面积,再将准备好的供试品溶液各吸取20 μg注入液相色谱仪,检测并记录供试品槲皮素峰面积,并以下列公式计算。
每片的含量=(A样×C对×50×平均片重×10-3)/(A对×称样量)
式中,A样为供试品溶液主峰峰面积;A对为对照品溶液主峰峰面积;C对为对照品浓度(μg/mL);平均片重为随机取肝苏片20片,用电子天平称取总重量为5.996 1 g,则平均片重为0.299 8 g。
1.2.6方法学考察。
1.2.6.1精密度试验。取同批肝苏片在水浴温度为60 ℃、盐酸甲醇浓度为1.5%的条件下,按照“1.2.4”供试品制备方法进行提取,在“1.2.1”色谱条件下重复进样6次,检测、记录并计算槲皮素的峰面积和RSD。
1.2.6.2稳定性试验。取在精密度试验项下的肝苏片供试品,在相同色谱条件下每隔2 h进样一次,即于0、2、4、6、8、10 h分别精密取20 μL供试品溶液注入液相色谱仪,记录并计算槲皮素的峰面积和RSD。
1.2.6.3重复性试验。取同批肝苏片在水浴温度为60 ℃、盐酸甲醇浓度为1.5%的条件下,按照“1.2.4”供试品制备方法进行提取,分别吸取20 μL注入高效液相色谱仪,在“1.2.1”色谱条件下检测、记录并计算槲皮素的峰面积和RSD。
1.2.6.4加样回收率试验。取同批肝苏片,已知每片含量3.669 mg/g,除去其包衣,研细,用电子天平量取6份,每份约0.075 g并记录称样量,置150 mL锥形瓶中,再加入1.5 mL 0.226 0 mg/mL槲皮素对照品贮备液(制备方法与“1.2.3”对照品的制备相同),相当于槲皮素0.339 mg,再以40 mL 1.5%的盐酸甲醇溶液为提取溶剂,在60 ℃水浴温度下,回流1 h后,转移至50 mL容量瓶中,用甲醇洗涤几次并定容。用有机系滤头过滤后,再按“1.2.1”色谱条件注入高相液相仪,记录槲皮素峰面积。
1.2.7样品的含量测定。取3批不同批号的肝苏片在最佳提取条件下,按照“1.2.4”供试品制备方法进行提取,分别吸取20 μL注入高效液相色谱仪,在“1.2.1”色谱条件下测定槲皮素含量。
2 结果与分析
2.1不同提取温度及提取溶剂的酸度对槲皮素含量的影响由表1可知,在相对标准偏差(RSD)的结果中可以看到,肝苏片在一定酸度条件下水解温度为60 ℃时水浴比较完全,当温度高于这个温度,水解开始呈现不稳定,导致含量结果偏低,特别是在现行的标准条件85 ℃下,而且85 ℃时改变提取溶剂的酸度波动较大,当水浴温度为55 ℃,酸度较低时含量较高,但是此时的槲皮素峰与相邻峰分离不完全,分离度低于1.5,所以虽然含量高却不符合色谱系统适用性。对于酸度条件的选择,在一定温度下随着酸度的改变槲皮素含量呈现波浪形变化,且幅度较高,根据RSD的计算结果显示,盐酸甲醇的浓度在1.5%时变化较为平缓。综上试验结果,当水浴温度为60 ℃、提取溶剂酸度为1.5%的条件下得到的肝苏片含量较高,而且波动较小。
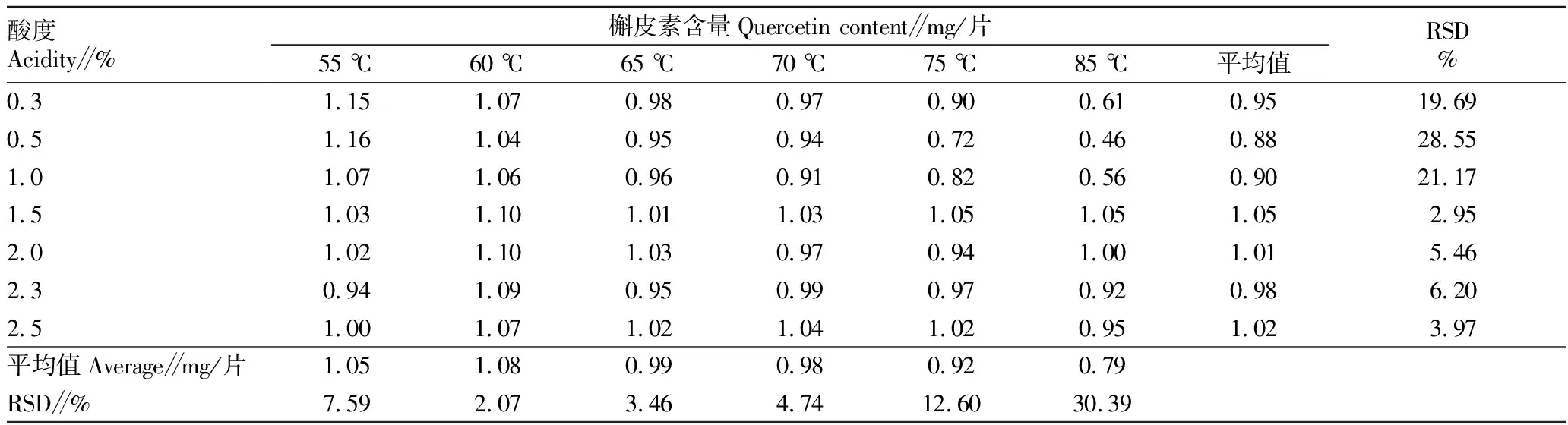
表1 不同提取温度及提取溶剂的酸度对槲皮素含量的影响
2.2方法学考察
2.2.1精密度试验。按照“1.2.6.1”操作,在选定条件下测定肝苏片含量的精密度RSD值为0.82%,结果符合规定,精密度良好。
2.2.2稳定性试验。按照“1.2.6.2”操作,计算得出6次测定的RSD为1.87%,表明肝苏片含量测定供试品溶液在10 h内稳定性良好。
2.2.3重复性试验。由表2可知,肝苏片在选定条件下进行含量测定的重复性RSD为0.90%,结果符合规定,重复性良好。
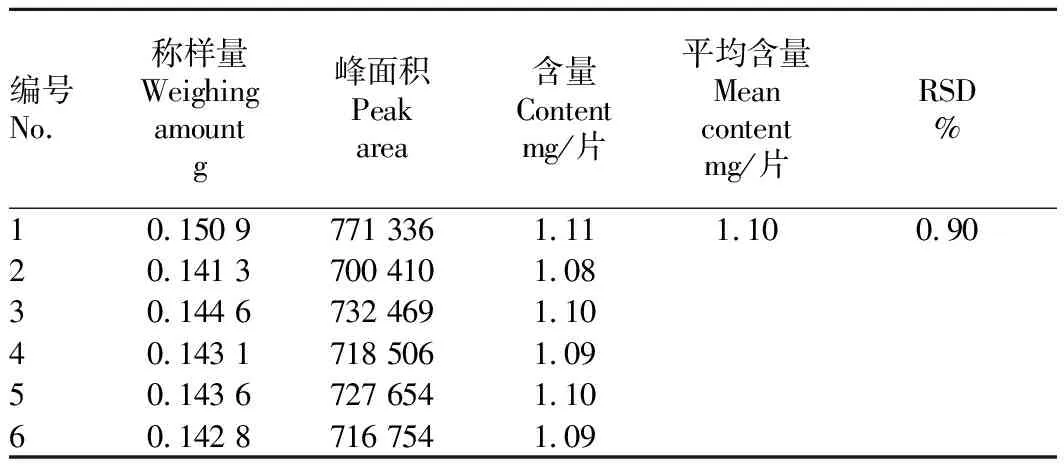
表2 肝苏片选定条件下重复性验证
2.2.4回收率试验结果。由表3可知,在选定条件下,槲皮素的平均回收率为99.41%,RSD值为0.62%,结果符合规定,表明该方法准确可靠,可用于测定肝苏片中槲皮素含量。
2.3样品的含量测定由表4可知,3批样品槲皮素含量分别为1.10、1.09、1.10 mg/片,测定结果相对稳定。
3 结论与讨论
该研究根据肝苏片制剂工艺中对温度的要求,考察了一定温度范围及提取溶剂酸度的含量测定。当温度在55 ℃、酸度较低时,提取的含量较高,但是此时的波动较大,且与选定条件下的平均值相差无几,最重要的是在55 ℃时,经过高相液相仪检测出来的槲皮素的峰与相邻峰的分离度小于1.5,也就是不符合色谱系统适用性试验。再看当前标准中的条件,尤其在85 ℃时各酸度条件下的含量较低且波动差异相当大,当以1.5%的盐酸甲醇作为溶剂,以60 ℃作为水浴回流的温度时得到含量更高、准确。所以该研究确定以此条件作为最优工艺。
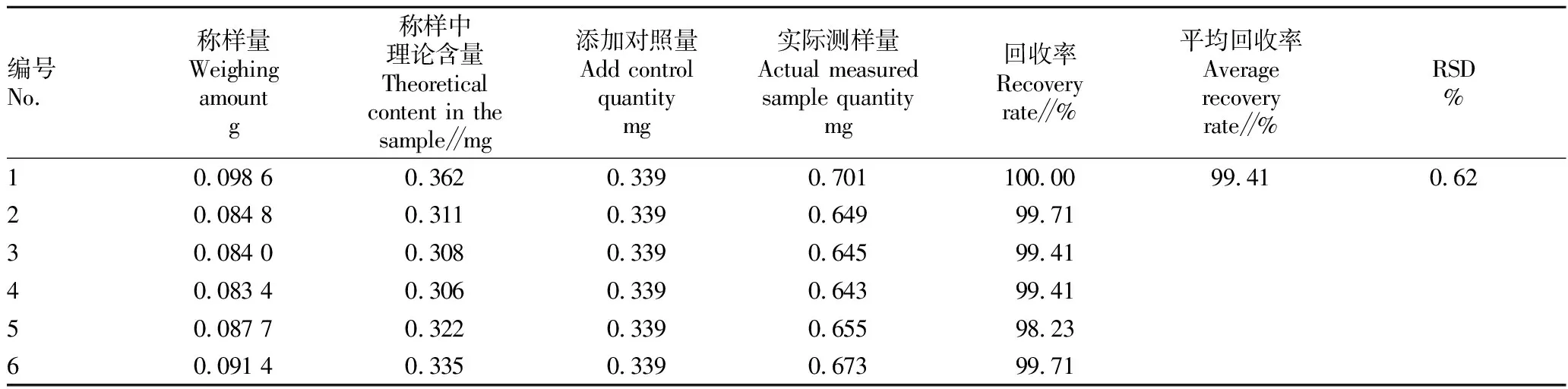
表3 槲皮素加样回收率结果
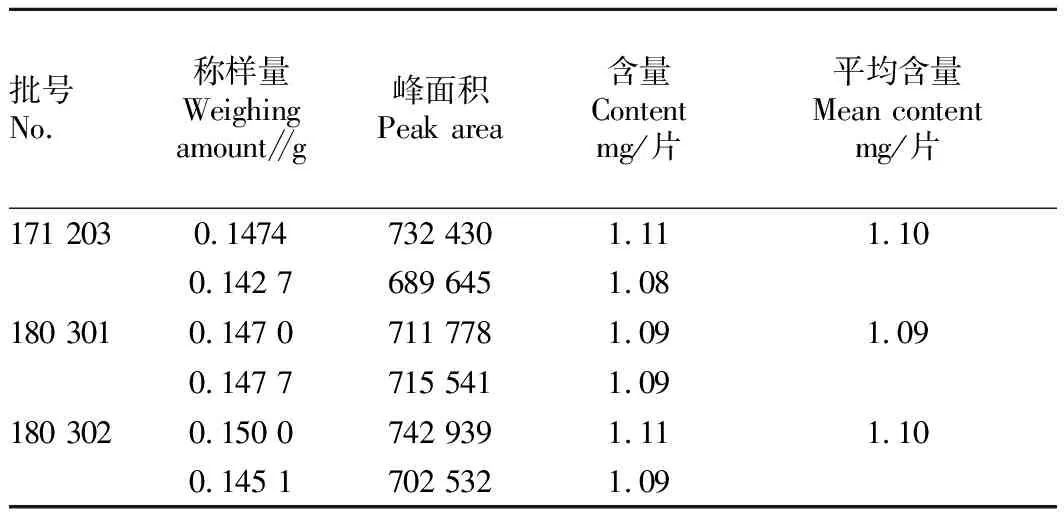
表4 3批样品含量
该研究在色谱柱耐受性和样品含量限度的确定上存在局限,但在选定的条件下,阴性对照试验、精密度试验(n=6)、稳定性试验、回收率度验(n=6)、重复性试验(n=6)以及多批样品检测试验(n=3),RSD值都小于2.0%,符合规定,所以此法不仅含量高、准确直观,而且波动较小,可以作为试行标准的进一步推广应用。

