沉默M-CSF基因与成骨基因动态关系的研究
李俊杰 宋艳艳 赵小奇 丁刘闯 韩祥祯 周琦琪 何惠宇
间充质干细胞广泛存在于多种组织中,是一种多能干细胞,具有向多种细胞分化的潜能,可向神经元分化[1],成骨细胞分化[2]等,这种多能性使间充质干细胞成为组织工程领域的研究热点,尤其是在骨和软骨修复领域,是骨组织工程应用的细胞来源[3]。并且是一种很有吸引力的再生医学资源[4]。
RNAi(RNA interference,RNAi)是科学发展中具有里程碑意义的发现,一个典型的应用是将小干扰RNA(SiRNA)传递到细胞中,触发互补mRNA 的降解,从而降低内源性基因的表达[5]。RNAi 也被应用于提高免疫系统[6]。动物基因研究[7]。具有高精度治疗,将成为用于精密医学的新的潜在模式[8]。
骨稳态是由破骨细胞骨吸收和成骨细胞骨形成之间的平衡维持的,骨细胞活性失调可导致骨质疏松症,其特点是破骨细胞活跃,导致骨量降低,骨脆性和骨折风险增加[9]。M-CSF 是破骨细胞形成的关键因子之一[10],破骨细胞与成骨细胞能够相互作用,相互影响。本实验利用RNAi 探究M-CSF与成骨相关因子的关系,可为组织工程因子的利用提供理论及实验依据。
资料和方法
一、材料
成年SD 大鼠,雌雄不限,体重100g,由新疆医科大学医学动物实验中心提供。
二、方法
1.小鼠骨髓巨噬细胞的培养:取4 周龄SD 大鼠,脱颈椎处死,取股骨及胫骨,去两端,高糖型DMEM(100U/ml 青霉素、100U/ml 链霉素、10%胎牛血清)溶液,冲洗骨髓,离心(1000rpm×5min)1 次。加入5ml DMEM 培养基,37.0℃、5% CO2培养箱中培养,72h 后去上清液,余下贴壁细胞即为骨髓干细胞(bone marrow-derived macrophages,BMSCs)。隔两天换液,长至80%以上传代。取第三代骨髓干细胞行流式鉴定。

shRNA(M-CSF-RNAi),阴性对照质粒及甘油菌液质粒提取盒,DNA 产物纯化试剂盒感受态DH5α、脂质体LipofectamineTM 3000、Trizol逆转录、PCR 试剂盒激光共聚焦显微镜,倒置显微镜流式细胞仪二氧化碳培养箱、核酸蛋白测定仪、超净工作台(SW-CJ-2F)PBS、0.25%胰蛋白酶、α-MEM、青-链霉素胎牛血清紫外分光光度计、凝胶成像仪、荧光定量PCR 仪SOC 液体及固体细菌培养基引物吉凯公司,中国天根公司,中国Invitrogen 公司,美国TAKARA,日本莱卡,德国FACSAriaⅡ,美国Thermon,美国安泰公司,中国Hyclone,美国四季青,中国Bio-RAD 公司,美国生工公司,中国
2.M-CSF shRNA 序列设计和重组质粒的鉴定:根据GenBank 中的M-CSF基因序列,参照shRNA设计原则,在线分析设计,确定3 个靶序列,设计3个针对M-CSF 的短发夹RNA(small hair RNA,shRNA)及一对阴性对照序列。最终筛选一个转染效率及沉默效果最好的靶序列。序列经上海吉凯有限公司合成。序列:
正义链:GATCCCCACCGAGAGGCTACAGGAACT CTCGAGAGTTCCTGTAGCCTCTCGGTGTTTTTGGAT
反义链:AGCTATCCAAAAACACCGAGAGGCTACA GAACTCTCGAGAGTTCCTGTAGCCTCTCGGTGGG
将合成的DNA与GV-102 质粒连接。转化感受态DH-5α 菌种,筛选阳性克隆。挑取单菌落置液体培养基过夜;用质粒微量抽提试剂盒小量制备质粒,分光光度仪测定浓度及纯度,凝胶电泳并送至上海吉凯公司测序。
3.转染骨髓干细胞
实验分组:转染空质粒为质粒对照组,转染M-CSF 重组质粒为实验组。
重组质粒转染骨髓干细胞:将细胞按1×105个/孔接种于六孔培养板,第二天待细胞融合至90%时,用无血清培养基稀释重组质粒,将重组质粒和LipofectamineTM3000 混合,孵育20min,逐滴加入,混匀,培养6h 后终止转染,加入完全培养基继续培养,48h 后观察。
Trizol 法提取RNA:依次加入trizol、氯仿、异丙醇、75%酒精,DEPC 水,紫外分光光度计检测RNA浓度及纯度。两步法反转录为cDNA:①去除基因组DNA 反 应:5×gDNA Eraser Buffer(2μL),gDNA Eraser(1μL),Total RNA(小于1μg),RNase Free dH2O(up to 10 μl)。室温反应5~30min②反转录反 应:步 骤①反 应 液(10μl),PrimeScript RT Enzyme Mix I(1μL),RT Primer Mix(1μL),5×PrimeScript Buffer 2(for Real Time)(4μL),RNase Free dH2O(4μL),上PCR 仪器,37℃15min,85℃5s,1 个循环。
两步法实时荧光定量PCR: 引物由上海生工生物工程公司合成,M-CSF 上游引物CTGCTGGTCTGTCTCCTCGT,下游引物GTCTCCATTTGGCTGTCGAT,OSX 上游引物AAGGCAGTTGGCAATAGTGG,下游引物TGAATGGGCTTCTTCCTCAG;OCN 上游引物GGTGCAGACCTAGCAGACACCA,下游引物AGGTAGCGCCGGAGTCTATTCA。
荧光定量PCR 反应体系为20μL,Premix Ex Taq 10μL,cDNA 2μL,上游引物1μL,下游引物1μL,ddH2O6 μL;反应参数设置如下:95℃2min,95℃5s,60℃10s,40 个循环。重复3 次。
主要观察指标及数据分析:转染后实验组和对照组相关成骨基因mRNA 水平表达的差异。采用统计学软件SPSS16.0 分析,实验组及对照组均数比较采用t检验分析,P<0.05 为有统计学意义。
结 果
1.骨髓间充质干细胞的鉴定培养的第3 代大鼠BMSCs 均一表达CD29,CD44,阳性率分别为50.2%,70.3%;而CD45,呈阴性,阳性率分别为4.9%。

图1 流式细胞术细胞鉴定
2.选取ALB 平板上的可疑菌落摇菌后提取质粒,用琼脂凝胶电泳分析可见1 条约6400bp 的条带。大小与预期结果相吻合。测序结果表明,与所设计的干扰序列完全一致。结果靶向沉默小鼠M-CSF基因的载体构建成功。

图2 重组质粒1%凝胶电泳
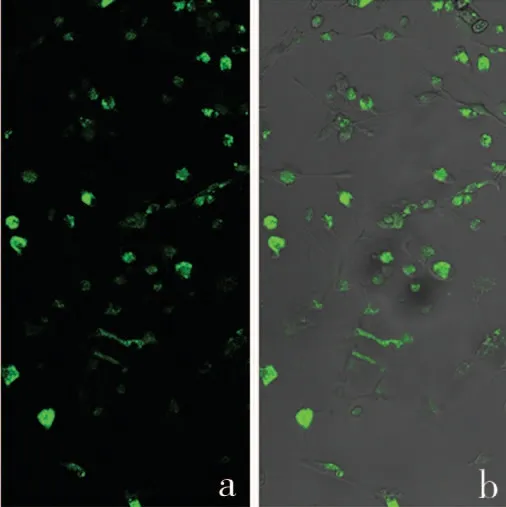
图3 M-CSF重组质粒转染48h后
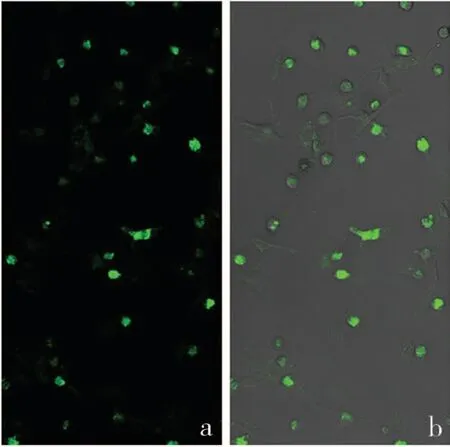
图4 阴性对照重组质粒转染48h后
3.M-CSF质粒转染BMSCs 细胞:转染48h 后,转染成功的细胞,激光共聚焦显示绿色荧光。
RT-PCR:48后,RT-PCR 检测结果显示,M-CSFmRNA下调,相关破骨基因中OSX、OCN表达上降(P<0.05)BMP-2基本不变(P>0.05)。
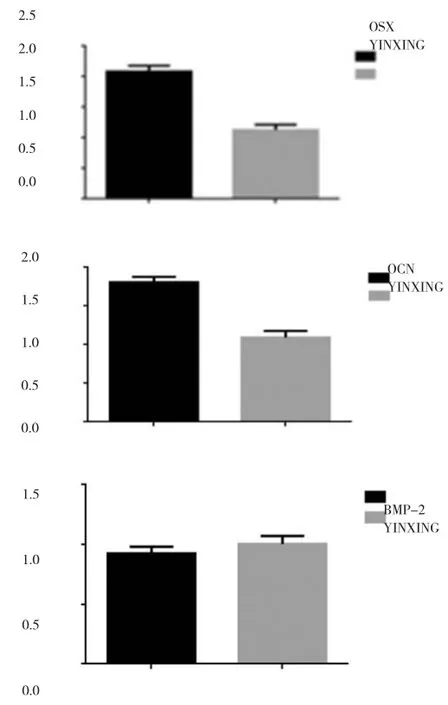
图5 OSX、OCN、BMP-2相对阴性对照组表达差异图
讨 论
破骨细胞和成骨细胞联系紧密,能够相互作用,相互影响,有学者发现破骨细胞在骨吸收过程中的上清液可能通过抑制增殖、脂肪形成和促进分化而提高BMSCs 的成骨活性[11]。
M-CSF 是形成破骨细胞的关键因子[12],抑制M-CSF 的作用能够减少Oc(Osteoclast)的形成[13]。进而降低骨吸收。M-CSF 高表达,能够导致骨疏松[14]。M-CSF 表达的变化,可能会影响破骨或成骨细胞相关基因的表达,本实验利用RNAi 转染骨髓干细胞,降低M-CSF 的表达,观察成骨相关基因OSX、OCN的表达变化。探索M-CSF与其他成骨基因间的动态变化。为组织工程中细胞因子的利用及骨吸收机制的研究提供理论基础。
MAPK 信号通路是在骨质疏松发生过程中发挥重要作用,而MAPK 通路中主要有以下3 条通路组成:ERK1/2 通路,通路和JNK 通路。p38MAPK 能够影响成骨细胞的活化[15]。同时,TGFΒ 能够通过介导Smad 途径激活P38MAPK[16]。
成骨细胞和软骨细胞来源于共同的前体细胞,OSX 诱导干细胞先经历一个双向潜能或多向潜能的分化阶段再分化为成骨细胞[17]。OSX在所有发育中的骨骼中都有特异性表达。国外有学者发现,OSX 过表达的BMSCs 植入小鼠体内后,参与移植后创面的愈合,骨-种植界面骨密度增加,促进了骨整合[17]。剔除OSX 后,小鼠无骨形成。骨膜和膜骨元素间质中的细胞不能分化为成骨细胞。然而,这些细胞确实表达 Runx2 (runt-related transcription factor-2,Runx2),相反,OSX在Runx 2 空小鼠中不表达,因此,OSX 作用于Runx 2 的下游[18]。已有研究证实Runx 2 可能控制了肥大软骨细胞的分化[19]。
在膜和软骨内骨骼中,OSX 被剔除的预成骨细胞被阻止分化为成骨细胞,但表达多种软骨细胞标记物。包括sox 9、sox 5 等在内的基因。Runx 2 表达的前成骨细胞在一个或多个步骤中分化成成熟的成骨细胞,并表达特征性的成骨标记基因。其他转录因子与OSX 协同作用,激活体内成骨细胞内基因,产生特异性骨基质。有学者推测,在成骨细胞中,OSX 可能是Sox 9 和Sox 5 表达的负调节因子[20]。
本实验显示:M-CSF 下调后,OSX 表达上调,推测M-CSF与TGFΒ 通过介导Smad 激活p38MAPK信号通路有关联,同时由于Sox 9 和sox 5与M-CSF 负相关,推测Sox 9 和sox 5 表达下降,干细胞形成成骨细胞的能力上升但形成软骨细胞的能力下降。
肿瘤坏死因子能激活NF-κB,通过随后上调TAZ 的表达诱导成骨[21]。TAZ 可与OCN 协同激活成骨[22]。ATF 4 通过与骨钙素特异性元件(OSE1)的结合,积极调节OCN 的表达[17]。在基质矿化阶段,ATF 4在很大程度上受到c-Jun N-末端激酶(JNK)的正调控,进而影响OCN 和BSP 的表达[23]。本研究显示M-CSF 下调后,OCN 表达上调,推测TAZ 及ATF4 表达上调,M-CSF 可能与NF-κB 及JNK在通路上有联系。
具体环节需要进一步验证。接下来需要提高M-CSF基因表达,检测相关成骨基因的表达,进一步探索基因间相互关系。
但本研究仍然存在一定的局限性,在 M-CSF发挥作用机制的具体环节,仍未探讨清楚,需要进一步深入的研究。

