采用还原剂-甲酸法溶解制备羊毛角蛋白质溶液
李 博, 姚金波, 牛家嵘, 王 乐, 冯 懋, 孙艳丽
(1. 天津工业大学 纺织科学与工程学院, 天津 300387; 2. 武汉纺织大学 化学与化工学院, 湖北 武汉 430073;3. 武汉纺织大学 湖北省生物质纤维与生态染整重点实验室, 湖北 武汉 430073)
羊毛是一种性能优良的天然蛋白质纤维材料,其制品被越来越广泛地应用于生活和生产中;但羊毛的产量十分有限,尤其是优质羊毛,同时废弃的羊毛制品无法被有效地再次利用,造成宝贵资源的浪费。为此,对羊毛纤维进行回收再生利用显得至关重要。羊毛的主要组成物为角蛋白质,通过溶解后再生的方法可获得较纯净的蛋白质材料,其具有优良的生物活性、生物相容性以及可降解性能,可应用于医学、生物和纺织等众多领域[1]。
溶解羊毛纤维制备角蛋白质溶液是研究蛋白质再生应用的前提条件,角蛋白质质溶液性能的优劣决定了再生材料的利用价值。目前研究应用较多的制备角蛋白质溶液的方法包括氧化法、还原法以及离子液体法等。孙艳丽等[2]采用巯基乙醇与离子液体1-烯丙基-3-甲基咪唑氯盐([AMIM]Cl)在120 ℃条件下共同溶解羊毛纤维获得角蛋白质溶液,溶液中蛋白质的分子质量主要分布在14.4、31、43、66.2 ku处。张恒等[3]分别采用还原C法和离子液体法对羊毛纤维进行溶解。其中:还原C法是采用亚硫酸氢钠、尿素、硫脲和十二烷基磺酸钠对羊毛进行溶解,在95 ℃条件下溶解6 h,溶解率可达到87%;而离子液体法采用[AMIM]Cl试剂对羊毛进行溶解,溶解率仅有10%。Shavandi等[4]将羊毛纤维溶解于质量分数为24%的过氧乙酸溶液中,在常温条件下溶解2 d后可分别提取获得水溶性角蛋白质(提取率为57%)和不溶性角蛋白质(提取率为40%),其中不溶性角蛋白质含有更多的化学基团。
如何在获得较高溶解率的基础上不过度破坏蛋白质大分子链的完整性,是制备性能优良的角蛋白质溶液的关键。目前大部分研究者在制备蛋白质再生材料时需先将蛋白质从溶解体系中提取出来,再溶解于甲酸[5]或者碳酸钠缓冲溶液[6]等适于再生工艺的试剂中。这不但使得再生材料制备工序更加复杂,也使角蛋白质在二次溶解中被进一步破坏,影响再生材料的性能。为解决以上溶解方法存在的问题,首先使用弱还原剂三羟基有机磷化合物(LKS-610)破坏羊毛纤维中大分子间的二硫键,再利用甲酸试剂的强酸性和其能够有效溶解细胞间质使纤维剧烈溶胀的特性[7-8],达到对羊毛纤维的溶解效果。本文采用单因素分析方法研究了羊毛纤维的溶解工艺,根据溶液的纤维溶解率、黏度和蛋白质分子质量分布变化确定最优的角蛋白质溶液制备方法。
1 实验部分
1.1 材料与设备
原料:羊毛纤维(直径为23~25 μm,澳洲羊毛,浙江新澳纺织股份有限公司);透析袋(截留分子质量为8~14 ku,北京市柠檬专业实验器材有限责任公司)。
试剂:三羟基有机磷还原剂(LKS-610,质量分数为40%),分析纯,天津市绿源天美科技有限公司;甲酸(质量分数为88%)、三羟甲基氨基甲烷(Tris)、十二烷基硫酸钠(SDS)、β-巯基乙醇(质量分数为99%)、盐酸(质量分数为37%)、冰醋酸、无水乙醇,分析纯,天津市科密欧化学试剂有限公司;蛋白质标准样(分子质量为14.4~94.0 ku),北京天根生化科技有限公司;甘氨酸,分析纯,天津市鼎盛鑫化工有限公司;考马斯亮蓝R250,分析纯,南京奥多福尼生物试剂有限公司。
设备:HZS-H型恒温振荡水浴锅,哈尔滨市东联电子技术开发有限公司;BA2000型光学显微镜,天津市二十八中仪器厂;DYY-6C型电泳仪,北京市六一仪器厂;CVOD100型马尔文旋转流变仪,英国马尔文仪器有限公司;L8900型氨基酸分析仪,日本日立有限公司。
1.2 羊毛溶解工艺
1.2.1还原剂预处理羊毛纤维
将1 g洗净的羊毛浸泡于体积为10 mL的LKS-610试剂中,于80 ℃水浴锅中处理30~60 min,处理结束后滤去纤维体系中多余的整理剂,烘干待用。通过LKS-610试剂对羊毛中二硫键高效的破坏作用,获得在还原体系中富含自由巯基的待溶解羊毛试样。
1.2.2甲酸溶解羊毛纤维
采用单因素实验方法对甲酸制备角蛋白质溶液的工艺方法进行研究,将一定质量的经LKS-610预处理后的羊毛纤维加入到质量分数为88%的甲酸溶液中,分别以纤维质量、溶解温度和溶解时间作为单因素变量,以羊毛纤维的溶解率、黏度和角蛋白质溶液中蛋白质分子质量为分析依据,考察不同条件下的溶解效果。
1.3 测试方法
1.3.1羊毛纤维氨基酸含量测试
准确称取一定量的羊毛纤维试样(200 mg)置于水解管中,加入10 mL盐酸(浓度为6 mol/L),用酒精喷灯封闭水解管后置于110 ℃烘箱中水解24 h,待试样完全水解后取出冷却并打开水解管。将水解样品过滤后定容,吸取2 mL定容后的样品,置于真空脱酸仪上脱酸(温度为60 ℃)至干燥,底部留有少许固体或痕渍为止。向脱酸后的样品中加入2 mL缓冲液(质量分数分别为2%的无水柠檬酸钠,1%的盐酸,0.5%的硫代二乙醇,0.1%的苯甲酸溶液),置于振荡混合器上混合均匀,然后利用针管吸取少量,通过孔径为0.22 μm的过滤器过滤后,采用氨基酸分析仪进行测试。
长。但事实是: Boysen-Jensen(1913)的真实实验得出的结论是: 当云母片从背光侧插入时,胚芽鞘丧失向光性,幼苗依然会直立生长;而当云母片从向光侧插入时,胚芽鞘才向光弯曲[2]。分析可能的原因是: 虽然背光侧的生长素含量要高于向光侧,却因云母片阻碍而无法向下运输,同时向光侧的生长抑制物质的含量多于背光一侧[3],所以两侧的生长速度相同,幼苗直立生长。
1.3.2纤维在甲酸溶液中的溶解状态观察
为比较LKS-610预处理对甲酸溶解羊毛纤维效果的影响,以及研究羊毛纤维在甲酸溶液中的溶解状态,分别取未处理和LKS-610预处理后的羊毛纤维各1 g,浸没于20 mL的甲酸溶液中,在60 ℃水浴锅中进行搅拌溶解。溶解过程中,每间隔60 min取少量纤维试样置于载玻片上,用光学显微镜进行观察。
1.3.3纤维溶解率测试
羊毛纤维在甲酸溶液体系中溶解完成后,对溶液体系进行抽滤,分别称量过滤前后干燥滤纸的质量,记为m1、m2。溶解前羊毛的质量为m,则溶解率K的计算公式为
1.3.4凝胶电泳测试
由于本文制备的角蛋白质溶液中含有甲酸,其强酸性会对电泳胶体产生破坏,影响凝胶电泳的测试结果,因此,测试前需先通过透析得到纯角蛋白质粉末,再对其进行十二烷基硫酸钠-聚丙烯酰胺(SDS-PAGE)凝胶电泳测试。其中:分离胶质量分数为12%;浓缩胶质量分数为5%;加样10 μL,测试电压为80 V。电泳完成后,对试样进行染色、脱色、水洗等处理后拍照记录。
1.3.5角蛋白质溶液黏度测试
采用马尔文旋转流变仪对离心过滤后的澄清角蛋白质溶液进行黏度测试,并且在测试前保证待测溶液的质量分数一致。设置测试温度为25 ℃,剪切应力恒定为60 Pa,实验夹具采用锥角为4°、直径为40 mm的锥板。
2 结果与讨论
2.1 预处理后纤维的氨基酸含量变化分析
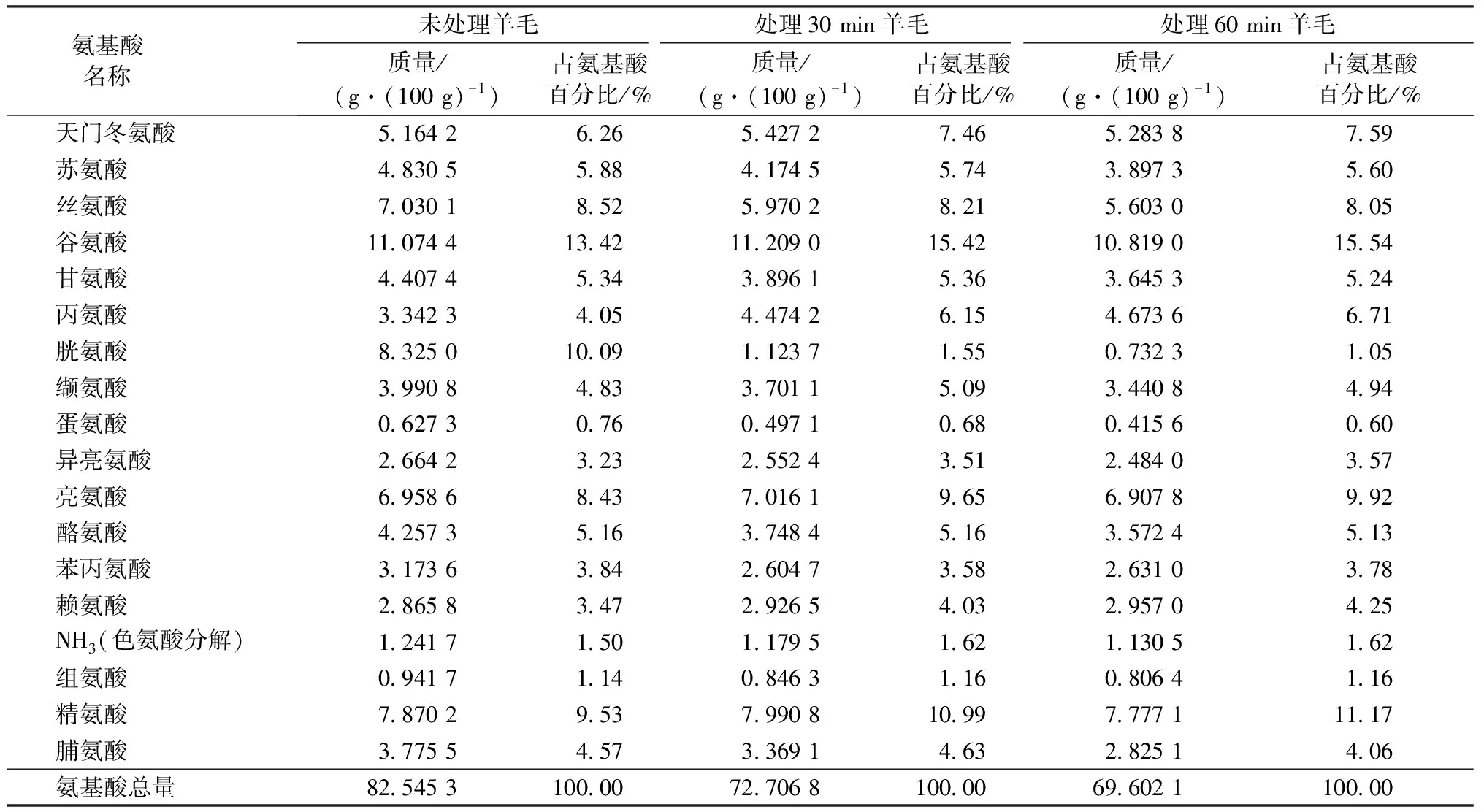
表1 LKS-610处理羊毛纤维试样的氨基酸含量测试结果Tab.1 Amino acid content test results of wool fiber samples
由表1可看出:羊毛纤维经过还原剂LKS-610处理30 min后,胱氨酸的质量分数由10.09%骤降至1.55%;继续延长处理时间,质量分数的减小变缓。由此说明预处理过程中纤维内大部分的二硫键被还原断开并以其他形式存在[9],与文献[10-11]报道相比,还原剂LKS-610在相对一致的条件下对二硫键的破坏作用更加有效。同时,从表1中可发现,其他种类的氨基酸含量并没有明显减少,证明LKS-610对二硫键的作用效果具有一定的专一性。选择在80 ℃条件下处理60 min作为还原剂LKS-610预处理羊毛纤维的最优工艺,进一步研究预处理后纤维在甲酸溶液中的溶解状态。
2.2 预处理纤维在甲酸溶液中的溶解状态
图1、2示出LKS-610预处理前后羊毛纤维在甲酸溶液中溶解不同时间后的光学显微镜照片。

图1 未处理羊毛纤维在不同甲酸溶解时间下的溶解状态Fig.1 Dissolving state of untreated wool fibers in formic acid solution under different dissolution time
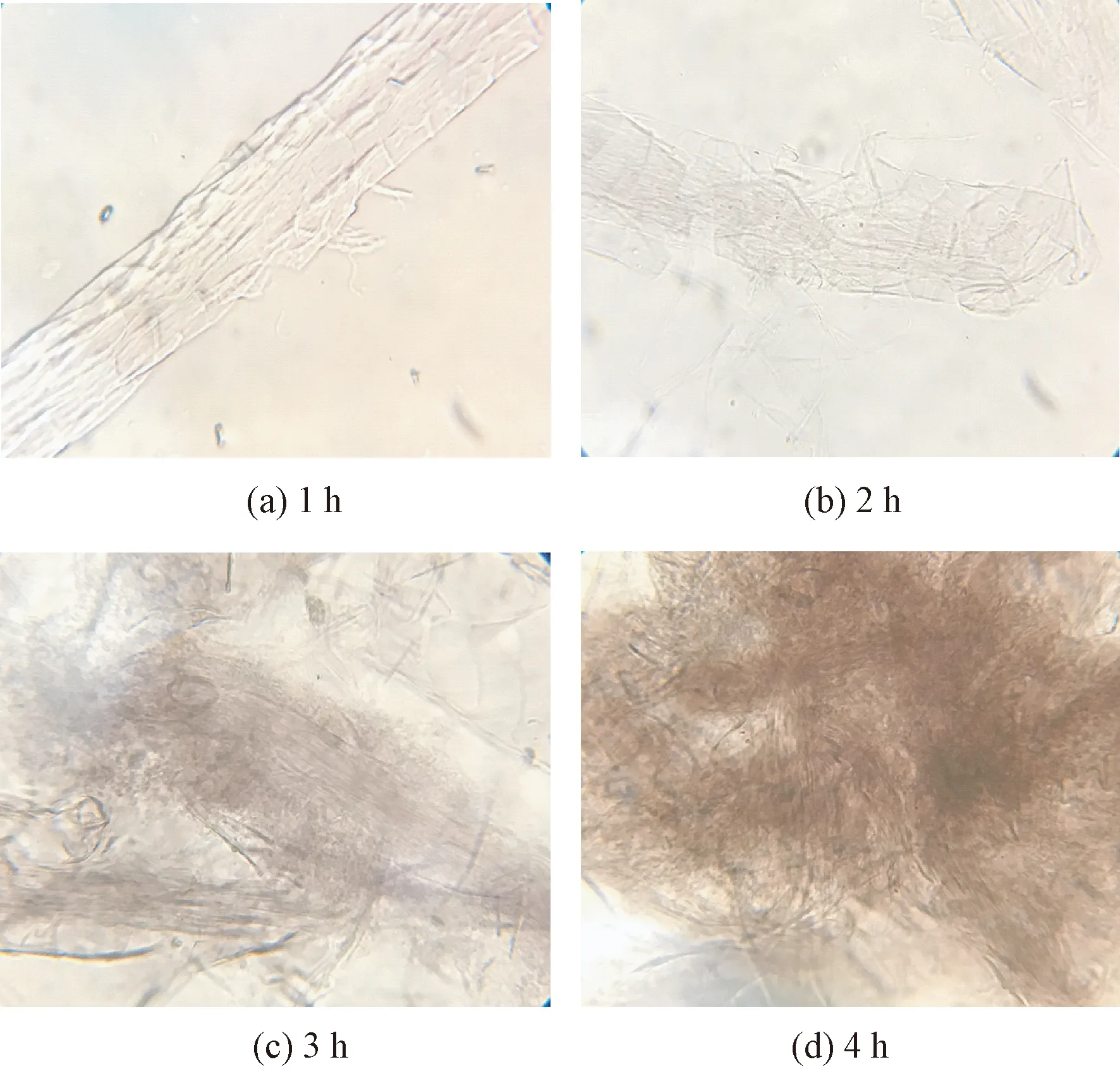
图2 LKS-610处理后羊毛纤维在不同甲酸溶解时间下的溶解状态Fig.2 Dissolving state of LKS-610 treated wool fibers in formic acid solution under different dissolution time
从图1可以看出:溶解1 h后羊毛纤维的外观和形态并未发生明显的变化;溶解时间达到2 h时,纤维的鳞片层发生了部分的翘起和脱落,纤维的主体也有一定程度的溶胀;继续延长处理时间,纤维结构在甲酸作用下发生破坏并逐渐分解为纤维残片和细胞、巨原纤结构单元[8](见图1(c)、(d))。从图2可以发现:预处理过的羊毛纤维在甲酸溶液中溶解1 h后发生了明显的溶胀,同时有部分原纤结构从纤维主体脱离出来;溶解2 h后,纤维的主体结构在甲酸作用下被显著破坏;当溶解时间达到3 h后,已有部分纤维被溶解,图中深色的团聚部分便是被溶解的羊毛纤维;继续溶解更长时间后,大部分的纤维均已被破坏溶解,仅有部分纤维残渣存在于溶液体系中。
由以上分析可以发现,羊毛纤维在甲酸溶液中虽然发生了结构的分解和破坏,但仍保持一定的细胞结构体,由此证明甲酸溶液无法达到单独溶解羊毛纤维的效果,它对羊毛纤维的作用主要体现在溶解细胞间质从而溶胀纤维和分解纤维结构。而经LKS-610处理后纤维便可较好地溶解于甲酸溶液中,这是由于前期研究证明LKS-610能够有效破坏羊毛中的二硫键,减小了蛋白质大分子间的作用力,再通过甲酸溶液的强酸性和溶解细胞间质的能力使得羊毛纤维被有效溶解,因此,LKS-610预处理过程对于甲酸溶解羊毛纤维显得尤为重要,通过LKS-610试剂和甲酸的共同作用可达到有效溶解羊毛纤维的效果。
2.3 甲酸溶解羊毛纤维的优化工艺
2.3.1甲酸试剂对不同质量羊毛纤维的溶解效果
分别取不同质量的羊毛纤维(3、4、5、6 g)溶解于体积为100 mL的甲酸溶液(质量分数为88%)中,研究甲酸试剂对不同质量羊毛纤维的溶解效果。溶解温度为60 ℃,溶解时间为5 h。表2示出不同质量纤维的溶解率和角蛋白质溶液剪切黏度变化。
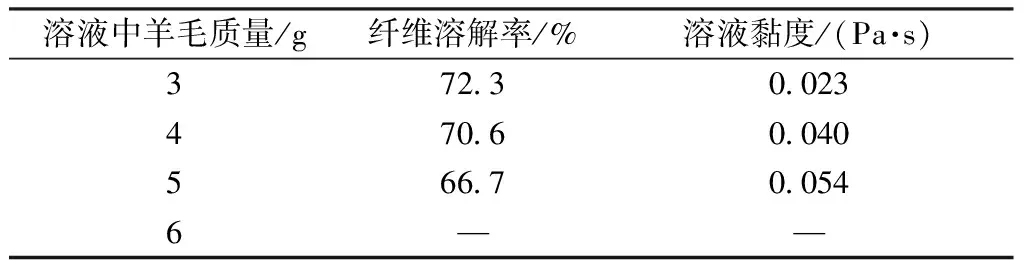
表2 不同质量羊毛纤维在甲酸中的溶解率和溶液黏度变化Tab.2 Dissolution rate and viscosity changes of wool with different mass dissolved in formic acid
从表2可以看出:随着溶解羊毛纤维质量的增加,角蛋白质溶液的溶解率逐渐降低。当羊毛质量为6 g时,溶解率下降明显,溶解体系呈凝胶状态,已无法测试溶液的溶解率和黏度。溶解率的降低主要是由于一定质量的甲酸溶液对羊毛纤维的溶解能力有限,而未溶解的物质为羊毛纤维内的高硫部分,这部分中含有大量二硫键,极难溶解而易于呈现凝胶状态[12]。当置于甲酸溶液中的羊毛过多时,甲酸将难以使纤维充分溶胀进而溶解,因此,当羊毛质量达到6 g时,羊毛的溶解率大幅降低。角蛋白质溶液的黏度变化则是由于溶解于甲酸溶液中的角蛋白质含量有所增加,在假设蛋白质大分子舒展状态相同的情况下,则体系的黏度随角蛋白质含量的增加而增大。由于本文实验中不同溶液的溶解浴比无法一致,因此,黏度测试结果不能作为分子质量大小的判断依据。
图3示出SDS-PAGE凝胶电泳的测试结果。可以看出:4组试样的蛋白质分子质量分布大致相同,主要分布在45~66 ku、20~33 ku、14.4~20 ku这3个范围内。羊毛纤维质量为6 g时,试样是取凝胶状物质进行制样和测试,其中含有部分未完全溶解的纤维,因此,实际参与电泳测试过程的蛋白质较少,其对应的电泳条带染色后颜色较浅。对比文献[13-14]报道中角蛋白质溶液的分子质量分布结果可以证实,采用本文方法溶解羊毛能够获得具有较高分子质量的角蛋白质溶液,同时也说明羊毛纤维溶解于甲酸溶液中的质量百分比对溶解后蛋白质分子质量分布影响不大。综上所述,羊毛纤维在100 mL甲酸中溶解效果最佳时的质量为5 g。

a为标准蛋白质谱带;b~e分别为纤维质量等于3、4、5、6 g的试样的电泳谱带。图3 不同溶解纤维质量下试样的SDS-PAGE凝胶电泳测试结果Fig.3 SDS-PAGE gel electrophoretogram of samples with different disolved mass fraction
2.3.2温度对溶解效果的影响
在确定羊毛质量为5 g,甲酸溶液质量分数为88%、体积为100 mL,溶解时间为5 h的条件下,分析不同溶解温度对溶解效果的影响规律,结果如表3所示。

表3 不同溶解温度下纤维的溶解率和溶液黏度变化Tab.3 Dissolution rate and viscosity change of samples at different dissolved temperatures
由表3看出:纤维在甲酸中的溶解率随着溶解温度的升高而逐渐提升;溶解温度在20~40 ℃时,纤维溶解率较低且变化不大;当溶解温度达到50 ℃以后,溶解率由56.3%升高到63.5%;而溶解温度为80 ℃时,纤维的溶解率高达80.6%。说明当温度达到一定程度后,羊毛纤维在甲酸溶液中会更容易和快速地发生溶胀分解,同时伴随着蛋白质大分子结构的降解和破坏,纤维溶解率得到显著提升。从表3还可看出:蛋白质溶液的黏度变化则是随着溶解温度的升高呈现出先增大后减小的规律;当溶解温度为50 ℃时,溶液体系的黏度达到最大值。这是因为当温度由20 ℃升高为50 ℃的过程中,溶液中溶解的羊毛纤维含量越来越多,蛋白质含量的增加使溶液的黏度逐渐增大;当溶解温度超过60 ℃以后,角蛋白质溶液的黏度下降明显,这显然与高温导致大分子酸性降解有关。
图4示出不同试样的凝胶电泳测试结果。可以看出:溶解温度为20、30、40 ℃时,试样的分子质量主要分布于较高的位置,在45.0~66.2 ku范围内有较为明显的条带,而在低分子质量位置除了14.4 ku及以下处有分布外,其他位置几乎没有分布;溶解温度为50、60 ℃时,蛋白质大分子主要分布于45、33、26 ku,说明随着温度升高,蛋白质大分子出现一定程度的降解;当温度提升至80 ℃时,蛋白质分子几乎都聚集于电泳谱带的底端,进一步说明温度过高会导致蛋白质分子在甲酸溶液中剧烈降解。综上所述,50 ℃是羊毛纤维比较适宜的溶解温度。

a1为标准蛋白质谱带;b1~h1分别为溶解温度为20、30、40、50、60、70、80 ℃时试样的电泳谱带。图4 不同溶解温度下试样的SDS-PAGE凝胶电泳测试结果Fig.4 SDS-PAGE gel electrophoretogram of samples at different dissolved temperatures
2.3.3溶解时间对溶解效果的影响
在确定羊毛质量为5 g,溶解温度为50 ℃的条件下,考察溶解时间对溶解效果的影响。选取处理时间分别为3、4、5、6 h进行测试分析,结果如表4和图5所示。

表4 不同溶解时间下纤维的溶解率和溶液黏度变化Tab.4 Dissolution rate and viscosity change of samples under different dissolving time

a2为标准蛋白质谱带;b2~e2分别为纤维溶解时间为3、4、5、6 h后试样的电泳谱带。图5 不同溶解时间下试样的SDS-PAGE凝胶电泳测试结果Fig.5 SDS-PAGE gel electrophoretogram of samples under different dissolved time
由表4看出,随着溶解时间的延长,羊毛纤维的溶解率显著提高,而溶液体系的黏度则有所降低,显然过长的溶解时间会使蛋白质大分子降解严重。由图5可以看出:随着溶解时间的延长,角蛋白质的分子质量分布逐渐减小;纤维溶解时间为3~6 h的4组测试样谱带在分子质量为66.2、20、14.4 ku 3处都有明显的分布;溶解时间为3 h试样的分子质量较多地分布在66.2 ku附近,甚至分子质量更大;溶解时间为4 ~5 h的试样分子质量分布比较相近,66.2 ku范围的分子质量分布较溶解3 h试样较少,在20~26 ku范围内的分子质量分布则有所增多,证明随着溶解时间的延长,蛋白质大分子在甲酸溶液中有所降解;当溶解时间达到6 h后,在20 ku范围附近出现多条条带,且小于14.4 ku处的条带颜色也较深,由此说明溶解时间达到6 h后角蛋白质大分子链降解严重,这与黏度的测试分析一致。综合溶解率、黏度以及凝胶电泳的测试结果,确定5 h是较为理想的溶解时间。
通过对以上单因素实验结果的分析,获得甲酸溶液溶解预处理后羊毛纤维的最佳工艺:羊毛纤维质量为5 g,甲酸质量分数为88%、体积为100 mL,溶解温度50 ℃,溶解时间为5 h。溶解后获得的角蛋白质溶液具有较高的溶解率,同时也保证其具有较高的分子质量分布。
2.4 角蛋白质溶液的稳定性
由于质量分数为88%的甲酸具有强酸性,需要进一步验证溶解制备的角蛋白质溶液中蛋白质多肽大分子是否会在放置过程中发生严重的降解,因此,本文研究中采用上述优化工艺溶解制得羊毛角蛋白质溶液并静置于常温环境中,每隔一定时间取部分溶液透析获得再生蛋白质,测试分子质量的变化以表征溶液的稳定性,结果如图6所示。

a3为标准蛋白质谱带;b3~f3分别为角蛋白质溶液静置0、1、3、7、14 d后试样的电泳谱带。图6 羊毛角蛋白质溶液室温下静置不同时间后的分子质量分布Fig.6 Molecular weight distribution of keratin solution after standing at room temperature for different time periods
由图6看出,5条不同试样的电泳谱带中蛋白质的分子质量分布大致相同,分别在45.0、26.0、14.4 ku处出现较明显的分布条带,与溶解工艺优化实验的分子质量分布结果基本一致。试样b3~e3电泳谱带无明显区别,而静置14 d的试样f3中在33.0 ku处以下位置的颜色加深且条带模糊变粗,说明溶液中小分子质量的蛋白质含量有所增加,角蛋白质在甲酸溶液中发生了一定程度的降解,但分子质量整体分布变化不大。通过以上实验证明,本文研究中采用甲酸溶解制备的羊毛角蛋白质溶液具有较好的稳定性,在常温环境下不会由于强酸性导致溶液中的蛋白质大分子快速降解,具有一定的实际应用价值。
3 结 论
1)甲酸可溶解羊毛纤维内的细胞间质使其结构被破坏而分解,但无法达到溶解纤维的效果,而经还原剂LKS-610预处理后羊毛纤维可快速有效地溶解于甲酸溶液中。
2)质量分数为88%的甲酸溶液对预处理后的羊毛纤维溶解的最优工艺为:羊毛纤维质量5 g,甲酸溶液体积100 mL,溶解温度50 ℃,溶解时间5 h。在此条件下,可获得溶解率为65%左右,分子质量主要集中在40~60 ku、26 ku和14.4 ku,具有较高分子质量的羊毛角蛋白质溶液。
3)制备的羊毛角蛋白质溶液在常温环境中具有一定的稳定性,溶液内的蛋白质多肽不会发生快速的降解,具有一定的应用价值。
FZXB

