乌榄叶黄酮类化合物体内外抗氧化活性的研究
袁燕,崔雪惠,张立夏,董艳芬,梁燕玲,班俊峰,谢青春,申楼,吕竹芬,陈燕忠,*
(1.广东药科大学药学院,广东广州510006;2.广东省药物新剂型重点实验室,广东广州510006;3.广东省药物缓控释制剂工程技术研究中心,广东广州510006;4.广东省局部精准药物递药制剂工程技术研究中心,新药研发中心,广东广州510006)
根据2018年的《中国家庭健康大数据报告》显示,我国慢性病患者近3亿,占总死亡人数的86.6%,氧化应激是各种慢性疾病的共同发病基础。在诸多诱发慢性疾病的因素中,氧化应激参与多个生理[1]、病理过程[2],进而引发多种疾病,如血管疾病、糖尿病、癌症等[3],所以临床上将控制氧化应激作为治疗慢性病的关键。近期研究表明,天然的抗氧化剂具有良好的抗氧化效果,如姜黄素可降低炎症因子的分泌[4],葛根素可抑制过量氧自由基[5]等,所以从植物中提取天然抗氧化剂是研究的新趋势。
乌榄叶,系橄榄科橄榄属,其在中国华南地区有着丰富的产量,在传统中药中常被用于治疗感冒[6]、上呼吸道炎、肺炎[7]等,具有潜在的抗氧化应激作用。近年对乌榄叶的生理活性进行研究,发现乌榄叶水提取物对血管平滑肌具有明显的舒张作用[8],可产生快速持久的降压及减慢心率的作用[9];乌榄叶乙醇水提取物可产生较强的抗氧化活性[10-11],起到清除氧自由基[12]、抗衰老的作用[13],但是对药效和机制未进行深入研究。
在体外实验中,羟自由基是最活泼的自由基也被认为是衰老的主要诱因,而且1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基和2′-联氨-双-3-乙基苯并噻唑啉-6-磺酸 [2,2′-azinobis(3-ethylbenzothiazoline-6-sulfonic acid),ABTS+]自由基清除法已被广泛应用于天然中药材抗氧化能力的测定[14-15];在氧化自由基吸收能力(oxygen radical absorbance capacity,ORAC)法中抗氧化剂可抑制由自由基引起荧光变化,是经典考察氧化情况的方法[16]。在体内试验中,机体氧化应激与防御系统的总抗氧化能力(total antioxidant capacity assay kit,T-AOC) 密切相关,而且它是评估抗氧化能力的重要指标[17]。活性氧自由基的产生会形成脂质过氧化产物丙二醛(malondialdehyde,MDA),所以其含量增加是衰老的标志[18]。而且超氧化物歧化酶(superoxide dismutase,SOD)可将超氧自由基转化为过氧化氢,而谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)将过氧化氢分解成其他化合物,均是体内酶防御系统中较重要的酶[19]。
本研究采用体内外的抗氧化研究,推测其参与的途径,为开发其药用价值和其在抗氧化应激方面的深入研究提供前期依据。
1 材料与方法
1.1 材料与试剂
1.1.1 乌榄叶
乌榄(Canarium pimela K.D.Koenig)的叶子于2015年8月中旬在中国广东省中山市的草药园收集,该植物由刘基柱教授分类鉴定为锦葵科植物百合科,并在广东药科大学中药标本馆保藏了凭证标本(编号20150825)。
1.1.2 试剂与仪器
芦丁(批号100080-201409):中国食品药品检定研究院;维生素 C(Vitamin C,VC,批号 SLBN3833V)、偶氮二异丁脒盐酸盐[2,2′-azobis(2-methylpropionamidine)dihydrochloride,AAPH,批号WXBC383TV]、荧光素(fluorescein,FL,批号 BCBT0195)、水溶性维生素 E(6-hydroxy-2,5,7,8-tetramethylchroman-2-carboxylic acid,Trolox,批号 BSBC9713V)和 D-半乳糖:Sigma 试剂有限公司;2,6-二叔丁基-4-甲基苯酚(butylated hydroxytoluene,BHT,批号 34515)、2′-联氨-双-3-乙基苯并噻唑啉-6-磺酸(ABTS,批号 F1719012):阿拉丁生化科技股份有限公司;1,1-二苯基-2-三硝基苯肼(DPPH,批号C10088334):上海麦克林生化有限公司;总抗氧化能力(T-AOC)、谷胱甘肽过氧化物酶(GSH-Px)、超氧化物歧化酶(SOD)、丙二醛(MDA)试剂盒:南京建成生物工程研究所;其它试剂均为分析纯。
UV-2700型紫外-可见分光光度计:日本岛津公司;LB940多功能酶标仪:美国BioTek公司。
1.1.3 实验动物
SPF级ICR小鼠60只,雄性,购于南京大学-南京生物医药研究院,生产许可证号:SCK(苏)2015-0001。饲养环境12 h黑暗的光照周期,温度在18℃~21℃和湿度在45%~65%,给予喂食认证的饮食和纯净水。
1.2 方法
1.2.1 乌榄叶黄酮的提取与纯化
称取乌榄叶粉末加入体积分数50%的乙醇溶液,料液比 1∶50(g/mL),提取 60 min,旋转蒸发得到乌榄叶提取液后用大孔吸附树脂(AB-8,1BV=500mL)处理,加入提取液后依次用水(2 BV)、30%乙醇(2 BV)、50%乙醇(3 BV)、95%乙醇(2 BV)洗脱,流速为1滴每秒,合并不同洗脱部位后减压浓缩,冷冻干燥,待用。
1.2.2 乌榄叶中黄酮化合物含量的测定
精密称取芦丁标准品40 mg加入一定量的50%乙醇,配置成浓度为0.2 mg/mL的标准溶液备用。准确移取 0.0、0.8、0.32、1.6、2.0、2.4、3.2 mL 芦丁标准溶液于10 mL容量瓶中,先分别加入5%的NaNO2溶液0.4 mL,摇匀后静置6 min,加入10%的Al(NO3)3溶液0.4 mL,混匀后静置6 min,最后加入1 mol/L NaOH溶液4.0 mL,用50%乙醇稀释至刻度,摇匀,静置15 min,以50%乙醇溶液为空白参比溶液。按照紫外-可见分光光度法,在500 nm处测定吸光度,以芦丁标准曲线浓度C为横坐标(X),吸光度A为纵坐标(Y),绘制标准曲线,并得到回归方程。取2 mL乌榄叶黄酮溶液置于10 mL容量瓶中,按照绘制标准工作曲线的过程,测定吸光度,按照回归方程计算出乌榄叶黄酮溶液中总黄酮(total flavonoids from Canarium pimela leave,TFCPL)的含量,结果以每克样品所含芦丁当量的毫克数来表示[mg rutin equivalent(RE)/g]。
1.2.3 乌榄叶黄酮清除自由基能力测定
1.2.3.1 对DPPH自由基清除能力
参考Bumbudsanpharoke N等[14]报道的方法来评价乌榄叶黄酮对DPPH自由基的清除活性。分别取乌榄叶黄酮(5 μg/mL~50 μg/mL)溶液与 DPPH 溶液(0.1 mmol/L)各 2 mL混合,VC和 BHT溶液(5 μg/mL~50 μg/mL)为阳性对照,避光静置 30 min,在 517 nm 测定,计算公式如下:

式中:A1为空白组吸光度值;A2为待测样品吸光度值;A3为待测样品本身吸光度值。
1.2.3.2 对ABTS+自由基清除率
精密量取乌榄叶黄酮溶液(0.05 mg/mL~0.7 mg/mL)40 μL 后加入 ABTS+·溶液 4 mL,涡旋 30 s,避光 10 min后在734 nm处测定吸光度A1。ABTS+·溶液作空白,吸光度为 A2[15];ABTS+·的稀释:取 ABTS+·工作液,用磷酸盐缓冲液溶液稀释,要求在常温下734 nm处吸光值为0.7±0.02,对 ABTS+·的清除率按照下式计算:
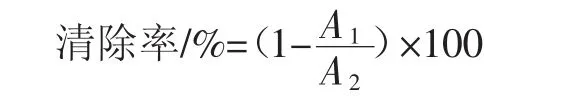
式中:A2为空白吸光度值;A1为待测样品吸光度值。
1.2.3.3 对羟自由基清除率
基于脱氧核糖降解测定法[20],吸取乌榄叶黄酮溶液(0.05 mg/mL~0.5 mg/mL)200 μL,依次加入磷酸盐缓冲液(0.2mol/L,pH7.4)600μL,脱氧核糖(50 mmol/L)100 μL、Na2EDTA(1 mmol/L)100 μL、FeCl3(3.2 mmol/L)100 μL、H2O2(50 mmol/L)100 μL、VC(1.8 mmol/L)100 μL,定容至1600μL,50℃温育20min,加入三氯乙酸(10%,质量分数)500 μL,5%的硫代巴比妥酸(thiobarbituric acid,TBA)300 μL,在105℃加热15 min显色。冷却后,在530 nm处测定。

式中:A0为空白吸光度值;A1为待测样品吸光度值。
1.2.4 还原能力测定
精密量取乌榄叶黄酮溶液(0.025mg/mL~0.16mg/mL)0.5 mL与磷酸盐缓冲液(pH=6.6,0.2 mol/L)2.5 mL,铁氰化钾(1%)2.5 mL,混合,50℃保温 20 min后,加入三氯乙酸(10%)2.5 mL,3 000 r/min离心 10 min,取上清液2.5 mL加入蒸馏水2.5 mL和氯化铁溶液(0.1%)0.5 mL,放置10 min,于700 nm测定吸光度。吸光度越大还原能力越强[21]。
1.2.5 抗脂质氧化能力测定
参照文献[22],精密量取肝匀浆(1%)2 mL,分别加入乌榄叶黄酮溶液(0.05 mg/mL~1.0 mg/mL)0.4 mL,依次加入FeSO4(6mmol/L)和H2O2(60mmol/L)各200μL,于37℃孵育1 h后,加入三氯乙酸(15%,g/mL)2 mL,以3 000 r/min离心10 min,取上清液,加入0.67%的硫代巴比妥酸2 mL,沸水浴显色15 min,冷却,在532 nm测定。由以下公式计算抑制率:

式中:A0为空白对照的吸光度值;A1为待测样品的吸光度值。
1.2.6 乌榄叶黄酮总抗氧化能力测定
在 96孔板中加入 Trolox溶液 25 μL,FL(8.16×10-5mmol/L) 溶液 150 μL,振摇 2 min,37 ℃下孵育10 min后加入 AAPH(153 mmol/L)溶液 25 μL 启动反应,以激发波长485 nm,发射波长538 nm测定,2 min测定一次,共循环45次[16]。以时间为横坐标,净面积为纵坐标,绘制Trolox系列标准溶液标准曲线。精密量取乌榄叶黄酮溶液25 μL,按照绘制标准工作曲线的方法,测定荧光强度,按照回归方程计算出样品的浓度,通过乌榄叶黄酮与Trolox的netAUC的比值与二者克分子浓度的比值做比,得到样品的ORAC值,即Trolox当量(TE),ORAC值以μmol TE/g表示。

式中:fn为第n个测定点的相对荧光强度;AUC为待测样品的AUC;AUCAAPH+为仅有AAPH作用下的AUC。
1.2.7 乌榄叶黄酮对D-半乳糖诱导氧化损伤小鼠影响
1.2.7.1 分组及给药
将ICR小鼠适应喂养3 d后按体质量随机分为6组(每组10只):空白组、D-半乳糖氧化损伤模型组、乌榄叶黄酮高剂量组(9.2 g/kg)、中剂量组(6.2 g/kg)、低剂量组(3.2 g/kg)、阳性组(VC,100 mg/kg)。 灌胃给药,1次/d,给药容积0.1 mL/10 g;空白组和模型组给予等量的生理盐水;除空白组外其他组每天均腹腔注射半乳糖1 000 mg/kg,空白组用生理盐水代替。根据体重变化调整小鼠腹腔注射和灌胃剂量,连续45 d[23]。每天称重并记录,观察小鼠的体征、外观等。
1.2.7.2 对脏器指数的影响
末次灌胃后禁食不禁水24 h,摘取眼球取血后立即颈椎脱臼处死,迅速取肾脏、肝脏和胰腺并称重,计算脏器指数,计算公式为:

1.2.7.3 血液中抗氧化指标测定
按试剂盒要求制备血清,并测定T-AOC、GSHPx、SOD活性和MDA含量,每个样品一式3份。各项指标的具体测定原理、试剂的配制方法,和蛋白含量的测定方法以及计算方法均严格按照试剂盒说明书进行。
1.2.7.4 组织病理学
将肝脏和肾脏组织放在4%多聚甲醛(pH=7.4)中固定24 h,在不同浓度蔗糖的100 mmol/L磷酸钠缓冲液(pH 7.4)中于4℃温育过夜使组织脱水后包埋在石蜡中,连续切片(7 mm)安装在硅烷包被的载玻片上并用苏木精-伊红(hematoxylin-eosin,HE)染色。使用LEICA DMI8倒置显微镜下观察肝脏的组织病理学变化并拍照。
1.3 数据处理与分析
2 结果与分析
2.1 芦丁标准曲线
根据芦丁的浓度和吸光度绘制标准曲线(如图1),得到回归方程为:Y=12.892 7X-1.443 8-4,(R2=0.999);测定乌榄叶黄酮溶液中的吸光度值,根据回归方程得到乌榄叶黄酮中所含芦丁当量为(336.4±2.56)mg RE/g。芦丁标准曲线见图1。

图1 芦丁标准曲线Fig.1 Standrad curve of rutin
2.2 自由基清除试验
2.2.1 DPPH自由基清除力
乌榄叶黄酮清除DPPH自由基能力图见图2。

由图2可知,乌榄叶黄酮对DPPH·清除能力呈明显的浓度依赖性,当浓度大于12 μg/mL时,清除率增长缓慢且逐渐接近于BHT的清除能力。当浓度达到50 μg/mL时,乌榄叶黄酮[(74.59±0.25)%]和BHT[(73.65±0.43)%]清除率相当,均低于VC[(92.51±0.54)%]。结果表明乌榄叶可以通过与DPPH·单电子的配对能力和供氢能力产生抗氧化作用。Wu J等[12]研究表明乌榄叶具有良好的DPPH·清除能力与本试验结果一致。

图2 乌榄叶黄酮清除DPPH自由基能力Fig.2 DPPH free radical scavenging activity of TFCPL
2.2.2 ABTS+自由基清除能力
乌榄叶黄酮化合物清除ABTS+自由基能力图见图3。

图3 乌榄叶黄酮化合物清除ABTS+自由基能力Fig.3 ABTS+free radical scavenging activity of TFCPL
如图3,在0.3 mg/mL之前随着乌榄叶黄酮浓度的升高,对ABTS+·的清除能力逐渐增强,之后增长缓慢。乌榄叶黄酮的半数抑制浓度(half maximal inhibitory concentration,IC50=0.158mg/mL)与 BHT(IC50=0.148mg/mL)相当而且小于VC(IC50=0.186 mg/mL),具有较强的清除能力。其中ABTS+·是过氧化物酶的底物,乌榄叶中可能含有与VC和BHT等量的阴离子可以与ABTS+·中阳离子结合,表明乌榄叶黄酮可能是通过有效成分中阴离子结合方式产生抗氧化作用。
2.2.3 羟自由基清除能力
乌榄叶黄酮化合物羟自由基清除能力见图4。

图4 乌榄叶黄酮化合物羟自由基清除能力Fig.4 The scavenging capacities for OH free radicals of TFCPL
由图4可知,乌榄叶黄酮浓度与羟自由基的清除力呈浓度依赖性,在0.5 mg/mL时已达到较高清除率,VC对于OH·清除率的IC50为0.168 mg/mL,乌榄叶黄酮为0.054 mg/mL,表明其对OH·清除率高于VC。乌榄叶黄酮清除活性主要由于Fe2+和Cu2+等抑制羟自由基的产生[24],结果表明其可能通过产生螯合离子来产生抗衰老的作用。乌榄叶黄酮清除能力强于VC可能由于含有多种有效成分,之间发生相互作用后产生加强抗羟自由基的作用。
2.3 还原能力
乌榄叶黄酮的总还原能力图见图5。

图5 乌榄叶黄酮的总还原能力Fig.5 The reducing power of TFCPL
由图5可知,当乌榄叶黄酮溶液浓度为0.025mg/mL~0.15 mg/mL 时,还原能力依次为:VC>TFCPL>BHT。该反应是基于乌榄叶黄酮在三吡啶基三嗪(tripyridyltriazine,TPTZ)存在情况下将Fe3+还原为Fe2+的能力,形成强蓝色Fe2+-TPTZ络合物,抗氧化防御系统增强;结果表明乌榄叶的还原电位可能与它们破坏自由基链反应的电子供体能力有关。
2.4 抗脂质过氧化能力
乌榄叶黄酮抗脂质过氧化能力图见图6。

图6 乌榄叶黄酮抗脂质过氧化能力Fig.6 The activity of anti-lipid peroxidation of TFCPL
脂质过氧化是细胞膜中多不饱和脂肪酸的氧化的过程,已报道抗氧化剂的抑制作用可能是由于在反应体系中对FeCl2-H2O2产生的清除能力,从而影响自由基反应链。由图6可知,在浓度为1.0 mg/mL时TFCPL抑制率达到(91.31±0.11)%,而且其脂质过氧化清除能力(IC50=0.065mg/mL)与维生素C(IC50=0.058 mg/mL)相当,表明乌榄叶黄酮具有较强的抗脂质氧化能力,可能是通过对金属离子的螯合活性产生抗氧化作用,对其金属离子螯合方面提供初步依据。
2.5 总抗氧化能力
VC和TFCPL荧光衰减图见图7。

图7 VC和TFCPL的荧光衰减图Fig.7 Fluorescence attenuation map of a VCand TFCPL
通过Trolox标准曲线计算获得其ORAC值后逐一比较,观察其抗氧化能力,结果见图7A和图7B所示,VC和乌榄叶黄酮能够明显抑制活性氧自由基对荧光物质的淬灭速率。其中VC在反应初期抑制活性比较强但是后期对荧光物质的淬灭速度急剧下降,但是乌榄叶黄酮的抑制强度呈逐渐减少的状态,其前期的抑制力虽然低于VC,但是后期抑制力强于VC,所以最终乌榄叶黄酮和VC的ORAC值分别为(4 177.5±99.6)、(4 211.5±166.1)umol TE/g,差距较小。乌榄叶与VC相比较,具有更持久的抗氧化能力,可以作为持久的抗氧化剂。
2.6 对D-半乳糖诱导小鼠氧化损伤的影响
2.6.1 对小鼠行为、体重的影响
乌榄叶黄酮对ICR小鼠体质量的影响表见表1。
D-半乳糖致氧化损伤模型小鼠与空白组相比较逐渐表现出活动减少,毛色明显变得灰暗粗糙并伴有脱毛现象;而其他组的小鼠总体状态均优于模型组。如表1所示,长期注射D-半乳糖对体重并没有显著的影响。其中模型组与空白组相比体重增加量有轻微的降低,而且乌榄叶黄酮给药组与阳性组和空白组没有显著性差别。这表明长期给予乌榄叶黄酮对小鼠的体重变化没有显著影响。

表1 乌榄叶黄酮对ICR小鼠体质量的影响(n=10)Table 1 Effects of TFCPL on body weight(g)of ICR mice(n=10)
2.6.2 对小鼠肝脏、肾脏和胰腺指数的影响
乌榄叶黄酮对肝脏、肾脏和胰腺指数的影响表见表2。
如表2所示,乌榄叶黄酮低、中、高剂量和VC均可使氧化损伤小鼠肝脏、肾脏和胰腺指数显著增高(P<0.05),但与空白组也具有差异(P<0.05),表明虽然对损伤小鼠具有缓解作用,但是与空白组和阳性组相比仍然具有轻微的损伤。在肾脏指数中低剂量组与空白组具有显著性差异(P<0.05)说明低剂量组对于小鼠肾脏损伤的缓解作用较弱。
2.6.3 对小鼠血清 T-AOC、MDA含量及 GSH-Px、SOD活性的影响
乌榄叶黄酮对小鼠血清T-AOC、MDA含量及GSH-Px、SOD活性的影响表见表3。
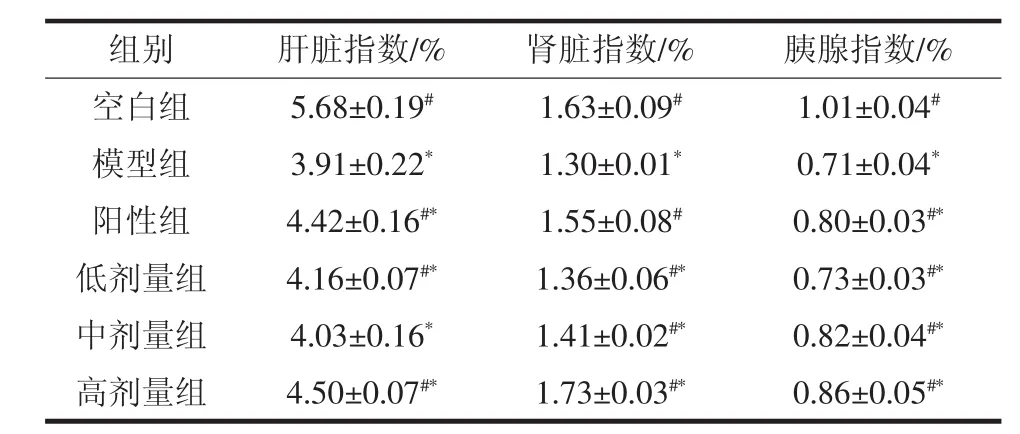
表2 乌榄叶黄酮对肝脏、肾脏和胰腺指数的影响(n=10)Table 2 Effects of TFCPL indices of liver,kidney and pancreas of mice(n=10)

表3 乌榄叶黄酮对小鼠血清T-AOC、MDA含量及GSH-Px、SOD活性的影响(n=10)Table 3 Effects of TFCPL on serum T-AOC,MDA content and GSH-Px,SOD activity(n=10)
如表3所示,模型组的T-AOC显著低于空白组小鼠(P<0.05),表明D-半乳糖可以破坏抗氧化系统并加速衰老过程。乌榄叶黄酮不同剂量组的T-AOC明显高于模型组小鼠(P<0.05),而且与空白组无显著性差异(P>0.05)。与空白组相比,模型组小鼠血清中MDA含量显著增加(P<0.05),表明D-半乳糖成功建立了小鼠衰老动物模型;随着其浓度的增加MDA含量减低,而且与模型组比,3个剂量对血清中MDA含量均有显著差异(P<0.05)。与空白组相比,模型组显著降低SOD和GSH-Px活性(P<0.01);乌榄叶黄酮不同剂量组中小鼠的SOD、GSH-Px活性高于模型组,而且中剂量组和高剂量组与空白组无明显的差异(P>0.05),而低剂量效果不明显。表明乌榄叶对D-半乳糖诱导的衰老小鼠SOD、GSH-Px活性具有恢复作用。因此乌榄叶具有改善衰老小鼠氧化应激的作用。
2.6.4 对小鼠肝组织病理改变的影响。
乌榄叶黄酮对D-半乳糖诱导损伤小鼠肝脏组织的影响图见图8。

图8 乌榄叶黄酮对D-半乳糖诱导损伤小鼠肝脏组织的影响(HE,200×)Fig.8 Effect of TFCPL on liver histology in D-gal-treated mice(HE,200×)
空白组小鼠的肝组织的肝细胞结构正常而且有明显的边界,肝细胞呈条索状排列[图8(A)]。模型组小鼠肝脏出现一定程度的损伤,肝细胞表现出细胞间隙增大,少量细胞核碎裂或固缩和气球变性等病理损伤,还观察到具有其他损伤,如病灶性坏死,淋巴细胞浸润[图8(B)]。在乌榄叶黄酮低剂量组发现有明显的气球样变性和纤维化的改善[图8(D)];中剂量组肝细胞形态发生改变,肝组织结构变得明显,细胞间隙减少[图8(E)];高剂量组和阳性对照组的改善更为显著,其中炎性细胞浸润得到缓解,接近与正常细胞 [图8(C)、图(F)]。结果表明乌榄叶黄酮可以有效改善肝脏组织病理学损伤,而且呈浓度依赖性。
5 结论
本研究对乌榄叶黄酮体外抗氧化能力进行了评价,结果证明其与VC、BHT抗氧化能力相当,且与质量浓度在一定范围内呈量效关系,表明其在体外具有较强的抗氧化活性。氧化应激引起的自然衰老可以通过长期给予D-半乳糖模拟,乌榄叶黄酮可以通过改变D-半乳糖诱导衰老小鼠血清中T-AOC,MDA,SOD和GSH-PX水平来改善氧化应激防御和抑制细胞凋亡,显著调节氧化损伤小鼠的抗氧化酶活性和过氧化物质的含量;此外,乌榄叶黄酮显著减弱肝脏的组织病理学变化。本研究表明乌榄叶黄酮可以作为食品和治疗中的新型天然抗氧化剂;也为以后乌榄叶在食品、药品以及保健品方面的研究提供了理论和试验基础;其产生抗氧化作用的途径和通路,需要进一步的研究。

