血液透析与血液灌流联合治疗尿毒症脑病患者血清NSE及GFAP水平变化的研究
章 茵 张 鑫 刘 帆 郭秀明
尿毒症脑病是肾内科常见的并发症,又被称为肾性脑病,可严重影响患者的健康和生活质量[1-2]。血液透析(hemodialysis,HDF)和血液灌流(hemoperfusion,HP)是临床常用的尿毒症脑病血液净化方式,HDF是通过透析膜的作用,清除血液中无法透过透析膜的小分子毒性物质,从而达到治疗的目的[3]。HP通过将血液引导灌流器后,由灌流器中的
吸附剂去除体内血液中的外源性药物、毒素及代谢产物,从而清除血液中的有害物质,达到净化血液的目的[4]。由于两者单独使用的效果不是十分理想,因此临床逐渐将两者联合用于尿毒症脑病的治疗。本研究旨在探讨HDF与HP联合治疗尿毒症脑病患者的疗效。
1 资料与方法
1.1 一般资料
本研究采取回顾性研究方法,选取2015年3月至2017年5月在攀枝花市第二人民医院进行HDF治疗的80例尿毒症脑病患者,根据治疗方法的不同,将常规HDF治疗的患者纳入HDF组,HDF+HP治疗的患者纳入联合组,每组40例。HDF组中男性22例,女性18例;年龄36~77岁,平均年龄(55.6±14.1)岁;透析时间(3.8±1.9)年;治疗前患者的格拉斯哥昏迷(GCS)评分为(3.8±1.6)分,昏迷时间(9.2±2.0)h。联合组中男性25例,女性15例;年龄42~79岁,平均年龄(57.0±12.8)岁;透析时间(4.0±1.5)年;治疗前患者的GCS评分为(3.6±1.5)分,昏迷时间(8.8±1.5)h。两组的年龄、性别、透析时间、GCS评分以及昏迷时间比较无差异,具有可比性;本研究实施前获得患者家属的知情同意及医学伦理委员会的批准。
1.2 纳入与排除标准
(1)纳入标准:①透析治疗时间>6个月;②尿毒症脑病的诊断标准参考人民卫生出版社《内科学》第8版中的标准:有中枢神经系统异常的症状体征,患者有嗜睡、朦胧及意识模糊,谵妄、幻觉、狂躁及木僵,理解判断力、定向力及记忆力减退,睡眠障碍,扑击样震颤、惊厥、抽搐及昏迷等临床症状表现;③昏迷时间>6 h;④GCS评分<7分。
(2)排除标准:①脑血管疾病、颅内占位病变导致的患者昏迷;②既往具有精神疾病、痴呆等病史;③使用药物及创伤等因素导致的患者昏迷。
1.3 仪器设备
采用Fresenius 4008S型透析机(德国费森公司);HA 330型血液灌流器(珠海健帆生物科技有限公司)。
1.4 治疗方法
(1)HDF组。采用HDF治疗。Fresenius 4008S型透析机,透析器均为Rexeed-15 L,透析膜面积1.5 m2,血管通路均选用动静脉内瘘,置换液量应控制在50 ml/min左右,血流量应控制在200 mmol/L左右,透析液应控制在500 ml/min,当患者出现出血迹象时给予低分子肝素,肝素量为1.0 mg/kg,每小时增加5 mg。
(2)联合组。在HDF组治疗的基础上联合HP治疗。采用HA 330型HP器进行联合治疗,血流量控制在200 ml/min左右,灌流时间3 h/次,2次/周。
1.5 检测方法
采用比色法检测血清血肌酐(serum creatinine,Scr)、尿素氮(blood urea nitrogen,BUN)、钾离子、钠离子及氯离子,试剂盒由上海海军医学院研究所提供;采用酶联免疫法测定神经元特异性烯醇化酶(neuron-specific enolase,NSE)、神经胶质纤维酸性蛋白(glial fibrillary acidic protein,GFAP),试剂盒由南京建成生物工程研究所购入;采用免疫比浊法检测β2微球蛋白(β2-microglobulin,β2-MG),相关仪器购自南京莱步科技郑州有限公司,检测试剂购自北京康佳宏原生物科技有限公司。
1.6 观察指标
观察对比两组患者治疗前后的Scr、BUN、β2-MG、钾离子、钠离子、氯离子、NSE、GFAP水平及GCS评分。
1.7 统计学方法
采用SPSS 16.0统计软件进行数据分析,定量资料结果以均值±标准差(±s)表示,符合正态分布用t检验,计数资料采用百分率(%)表示,用x2检验,以P<0.05为差异有统计学意义。
2 结果
2.1 两组患者治疗前后肾功能指标比较
治疗前联合组与HDF组患者的Scr、BUN及β2-MG水平相比,差异无统计学意义(t=0.604,t=0.711,t=1.066;P>0.05);治疗后联合组患者的Scr、BUN及β2-MG显著低于HDF组,差异有统计学意义(t=3.306,t=4.882,t=5.277;P<0.05),见表1。
表1 两组尿毒症脑病患者治疗前后肾功能指标比较(±s)
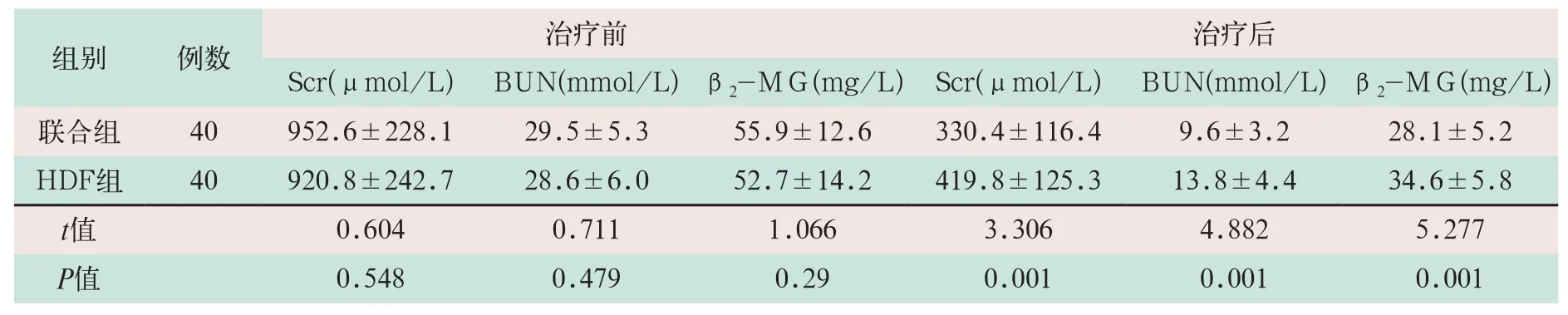
表1 两组尿毒症脑病患者治疗前后肾功能指标比较(±s)
注:表中HDF为血液透析;Scr为血肌酐;BUN为尿素氮;β2-MG为β2微球蛋白。
治疗后Scr(μmol/L) BUN(mmol/L) β2-MG(mg/L)Scr(μmol/L) BUN(mmol/L) β2-MG(mg/L)联合组 40 952.6±228.1 29.5±5.3 55.9±12.6 330.4±116.4 9.6±3.2 28.1±5.2 HDF组 40 920.8±242.7 28.6±6.0 52.7±14.2 419.8±125.3 13.8±4.4 34.6±5.8 t值 0.604 0.711 1.066 3.306 4.882 5.277 P值 0.548 0.479 0.29 0.001 0.001 0.001组别 例数 治疗前
表2 两组尿毒症脑病患者治疗前后电解质水平比较(±s)
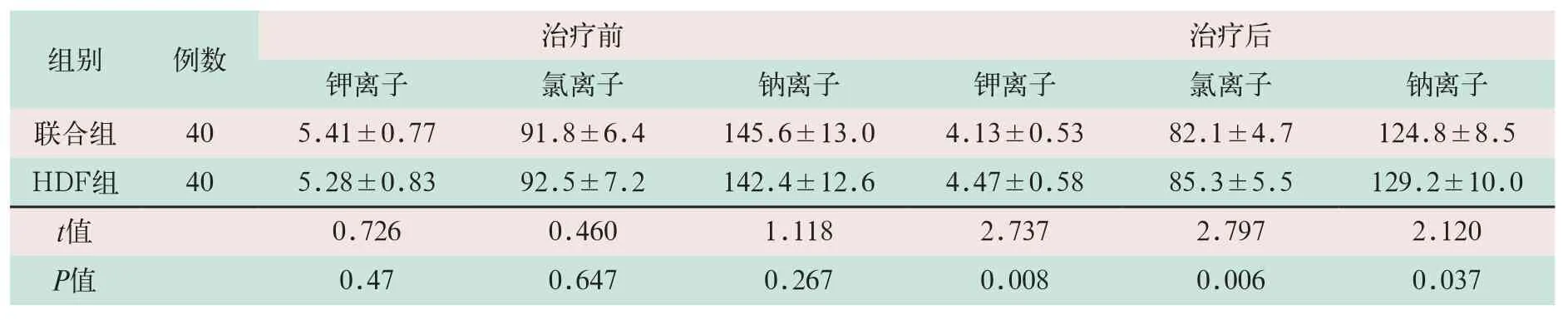
表2 两组尿毒症脑病患者治疗前后电解质水平比较(±s)
治疗后钾离子 氯离子 钠离子 钾离子 氯离子 钠离子联合组 40 5.41±0.77 91.8±6.4 145.6±13.0 4.13±0.53 82.1±4.7 124.8±8.5 HDF组 40 5.28±0.83 92.5±7.2 142.4±12.6 4.47±0.58 85.3±5.5 129.2±10.0 t值 0.726 0.460 1.118 2.737 2.797 2.120 P值 0.47 0.647 0.267 0.008 0.006 0.037组别 例数 治疗前
表3 两组尿毒症脑病患者治疗前后血清NSE和GFAP水平比较(±s)
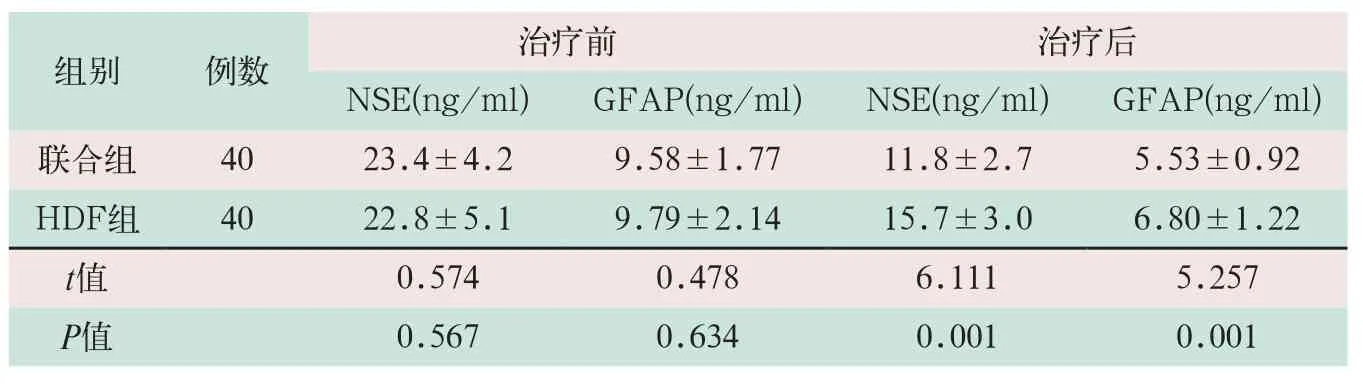
表3 两组尿毒症脑病患者治疗前后血清NSE和GFAP水平比较(±s)
注:表中NSE为神经元特异性烯醇化酶;GFAP为神经胶质纤维酸性蛋白。
组别 例数 治疗前 治疗后NSE(ng/ml) GFAP(ng/ml) NSE(ng/ml) GFAP(ng/ml)联合组 40 23.4±4.2 9.58±1.77 11.8±2.7 5.53±0.92 HDF组 40 22.8±5.1 9.79±2.14 15.7±3.0 6.80±1.22 t值 0.574 0.478 6.111 5.257 P值 0.567 0.634 0.001 0.001
2.2 两组患者治疗前后电解质水平比较
治疗前联合组与HDF组患者的钾离子、钠离子和氯离子水平比较,差异无统计学意义(t=0.726,t=0.460,t=1.118;P>0.05);治疗后联合组患者的钾离子、钠离子和氯离子水平显著低于HDF组,其差异有统计学意义(t=2.737,t=2.797,t=2.120;P<0.05),见表2。
2.3 两组患者治疗前后血清NSE和GFAP水平比较
治疗前联合组与HDF组患者的血清NSE和GFAP水平比较,差异无统计学意义(t=0.574,t=0.478;P>0.05);治疗后联合组患者的血清NSE和GFAP水平显著低于HDF组,其差异有统计学意义(t=6.111,t=5.257;P<0.05),见表3。
2.4 两组患者治疗前后GCS评分比较
治疗前联合组与HDF组患者的GCS评分差异无统计学意义(t=0.577,P>0.05);治疗后两组患者的GCS评分均较治疗前显著升高,其差异有统计学意义(t=-13.156,t=-12.254;P<0.05),且联合组的GCS评分高于HDF组,其差异有统计学意义(t=2.380,P<0.05),见表4。
表4 两组尿毒症脑病患者治疗前后GCS评分比较(分,±s)
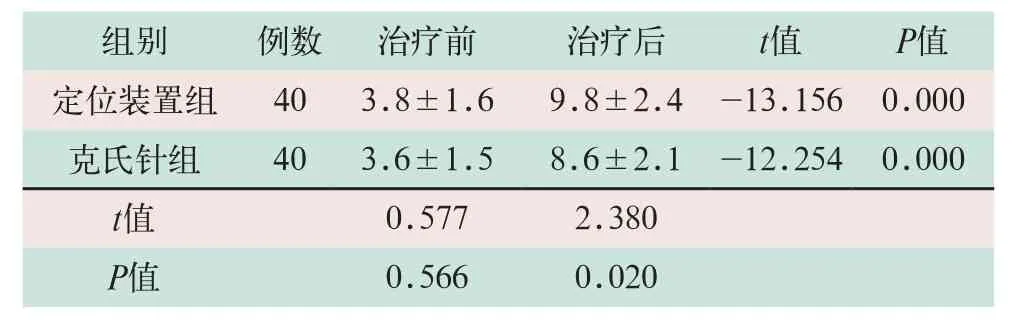
表4 两组尿毒症脑病患者治疗前后GCS评分比较(分,±s)
组别 例数 治疗前 治疗后 t值 P值定位装置组 40 3.8±1.6 9.8±2.4 -13.156 0.000 克氏针组 40 3.6±1.5 8.6±2.1 -12.254 0.000 t值 0.577 2.380 P值 0.566 0.020
3 讨论
尿毒症脑病患者临床表现为失眠、焦虑、抑郁等精神性症状,同时会出现记忆力衰退、无法集中注意力、嗜睡和精神错乱等,严重情况下患者会出现扑翼样震颤、四肢抽搐等,对患者的生活造成严重不变[5]。患者脑内的神经元同时发生病理性改变,皮质颗粒层的神经元染色质溶解,树突变性呈珠串状,细胞空泡变性;神经元皱缩或固缩,神经元细胞减少;脑白质区会出现脱髓鞘区;胶质细胞增生形成小胶质细胞结节[6-7]。目前临床上尚未发现治疗尿毒症脑病的有效药物,常用的治疗方法为HDF和HP[8]。HDF通过透析器较小的膜孔,以及弥散的作用原理能够清除血液中有毒性的小分子物质,但大分子物质的清除能力较弱[9]。
HP是将患者的循环血液从体内引到体外的灌流器中,通过其中的吸附剂的作用,清除体内外源性的有毒物质或多余的代谢产物,能有效清除大分子毒素、Scr、类毒素等和多种药物等大分子物质,但对尿素、水、磷酸和电解质的清除能力较弱[10]。本研究结果显示,Scr、BUN、β2-MG、血清NSE以及GFAP的水平在两组治疗后的水平均显著低于治疗前,且联合组的水平明显低于对照组。表明通过HDF与HP联合使用,能够显著降低患者体内Scr、BUN、β2-MG、血清NSE以及GFAP的水平。HDF能够清除小分子的Scr、BUN,HP能够清除大分子的β2-MG、血清NSE及GFAP,两者联合使用能够同时清除大分子和小分子对神经和肾脏功能产生毒害的物质,补充单独使用某一血液净化方法的缺陷,增强血液净化作用。
烯醇化酶是在糖酵解过程中发挥重要作用的酶,且在神经元中广泛存在,并调节神经元细胞的代谢功能,当大脑受到损伤时,烯醇化酶则会通过血脑屏障进入到脑脊液或血液中,引起外环境中NSE水平的升高[11]。β2-MG在体内的大量潴留会引起钾离子、氯离子的转运异常,损害神经细胞突出的功能,引起中枢神经系统及外周神经系统病变,同时通过影响神经信号的传递,导致神经功能异常[12]。
尿毒症脑病患者可能由于甲状旁素的表达水平升高,引起脑内环境中的钙离子水平升高,抑制脑细胞内的酶功能的发挥,通过级联反应,引起一系列的酶无法发挥功能,从而导致大脑神经元的损伤[13]。患者发生尿毒症脑病时会引起脑内环境代谢的紊乱,钠钾泵的功能也受到影响,使大脑内的能量传递系统受到影响,因此神经递质的作用降低,神经元之间的相互作用也随之减弱,信号传递功能无法正常进行,导致大脑无法发挥正常的调控功能,引起患者的精神、情绪的变化[14-15]。
本研究结果显示,两组治疗后血清中钾离子、钠离子和氯离子的水平都降低,且联合组各离子的水平显著低于HDF组,表明HDF+HP联合使用能够增强有毒物质的清除率,同时能够清除血清中多余的离子,维持血液中各离子的平衡;此外,通过有毒物质的清除,恢复血清和脑内环境的稳态,可能通过脑内酶代谢系统功能的恢复,使各离子的水平降低,恢复了脑内电解质的平衡,使大脑内的神经调控功能得到恢复。
本研究中,治疗后两组患者的GCS评分较治疗前均显著升高,联合组的GCS评分高于HDF组,表明通过治疗清除体内有毒物质,改善体内的代谢功能和电解质平衡后,能够使神经功能得到一定程度的恢复,两者联合使用能够增强对神经的保护功能。
本研究通过HFF联合HP治疗尿毒症脑病,表明两者联合使用能够同时清除血液中大分子和小分子的有毒物质,改善患者的血液循环,起到保护神经、加速患者康复的作用,对临床肾性脑病的治疗具有一定的指导价值。

