SPECT肾动态显像方法及其影响因素
陈 炜 梁 颖 耿建华
单光子发射计算机断层成像术(single photon emission computed tomography,SPECT)锝99-二乙三胺乙酸(technetium-99m-diethylenetriaminepentaacetic acid,99Tcm-DTPA)肾动态显像能同时进行显像和测定肾小球滤过率(glomerular filtration rate,GFR)值,在临床上被广泛应用[1-3]。但多种检查方法及影响因素均对GFR的测定有一定影响[4-7]。通过阐述SPECT肾动态显像方法及其影响因素,为临床应用提供借鉴。
1 SPECT 99Tcm-DTPA肾动态显像图像采集
1.1 GFR值
GFR是指单位时间内从肾小球滤过的血浆容量(ml/min),是评价肾脏功能的重要指标,也被认为是评估肾功能最好的指标[8]。准确评估GFR对判断慢性肾脏病的分期、早期发现肾功能不全、评估肾功能状态、观察干预治疗效果及调整经肾脏代谢药物的剂量、判断开始肾脏代替治疗时机均具有重要价值,也可以作为判断肾移植术后并发症的客观指标[9]。SPECT肾动态显像法已广泛用于健康人及活体肾脏移植术前、术后供体和受体的GFR评估[10-13]。
1.2 显像药物
肾动态显像剂应具备4个特性[14]:①完全从肾小球滤过;②不被破坏、吸收及分泌;③具有生理惰性;④不与血浆蛋白结合(或少量、仅少量、微量结合)。其原因是若某种物质完全从肾小球滤过,但不被肾小管重吸收和分泌,则该物质单位时间内从肾小球滤过的容量就代表了单位时间内从肾小球滤过的血浆容量。众多的肾动态显像剂中99Tcm-DTPA最为常用,99Tcm-DTPA属肾小球滤过型显像剂,分子量为500,血浆蛋白结合为3%~5%,静脉注射2~3 h后只会有<10%的显像剂存在于血液内,90%以上都被肾小球滤过。
1.3 显像药物注射方法
准备显像剂时选择<5 ml注射器,注射针头为7号,优选肘部直通血管(肘静脉血管),采用弹丸式注射99Tcm-DTPA 3~10 mci(111~370 MBq),注射药物的多少取决于SPECT设备的灵敏度。注射的质量是决定显像质量的第一步关键因素,若注射到静脉外(打漏),则必然会影响净注射量的计算,最后测得的GFR值比正常规范方法所得值要低。若出现这种情况,患者必需隔日后重新做肾动态检查。
1.4 图像采集及采集条件
(1)图像采集。肾动态显像现均采用双探头SPECT,放射性显像剂99Tcm-DTPA放射化学活度>95%。受检者在检查前30 min饮用500~800 ml的饮用水(10 ml/kg),检查前排尿排空膀胱。①先对装99Tcm-DTPA的注射器用SPECT计数10 s,将注射器置于SPECT双探头前位、后位同等距离处进行影像采集;②将受检者双肾置于SPECT双探头中央,一侧肘静脉采用弹丸式注射99Tcm-DTPA后,即刻进行前位、后位影像采集;③动态影像采集完成后,将注射器残余药物计数10 s,采集条件与满针相同。
(2)采集条件。采集能峰140 keV,能窗20%;第一时相1帧/2 s,共采集30帧;第2时相1帧/15 s,共采集48帧。
2 SPECT数据处理及GFR值计算
2.1 肾动态显像Gates法测定GFR值
依据Gates法提取放射性计数,图像采集完成后,先利用感兴趣区(region of interest,ROI)技术在后位图像上均勾画左、右肾轮廓及本底区ROI,然后在应用仪器的常规处理程序中输入身高、体重对所得图像进行处理,利用Gates计算公式计算出GFR值。
2.1.1 Gates单探头法测量计算GFR值

Gates单探头法GFR计算为公式1[15]:式中μ为99Tcm的射线在软组织中线性衰减系数,取值为0.153/cm[16];RX、LX分别为右侧、左侧肾脏深度(cm)(使用Tonnesen[16]公式计算获得);满、空针计数分别为注射前、后注射器计数,e为常数。
2.1.2 Gates双探头几何均数法测量(GFRGM)计算GFR值
借助ROI技术勾画双肾轮廓和本底ROI,提取前、后位图像上双肾及本底ROI的时间-放射性计数曲线,得到2~3 min时段双肾及本底的放射性计数。先由满、空针的前、后位图像计数差计算检查床的透射率,并由此对后位图像中各ROI计数进行床的衰减校正。随后计算各肾前、后位ROI的净计数(减去各自本底计数),并由各肾前、后位净计数计算其几何均值。Gates双探头几何均数法GFR计算为公式2:式中下标GM为几何均值,d为肾区身体厚度(cm),μ的取值分两种情况:①同目前公认值μ=0.12/cm,此值近似99Tcm射线在软组织中的线性衰减系数实际值,称为双探头GM1法(GFRGM1)[17];②同Gates单探头法中μ=0.153/cm,称为双探头GM2法(GFRGM2)。

2.2 双血浆法测定GFR值
受检者在注射99Tcm-DTPA2 h、4 h后分别采集肘静脉血4 ml,并予肝素抗凝,2000 r/min离心,然后将血浆分离出来。采用移液管精确取出1 ml血清,用放射免疫γ计数仪测量放射性计数并计算,其中测量时间为60 s。双血浆法测定GFR值计算为公式3[18]:式中D为注入体内药物的放射性计数;T1为第1次采血时间(min),P1为T1时的放射性计数;T2为第2次采血时间(min),P2为T2时的放射性计数。
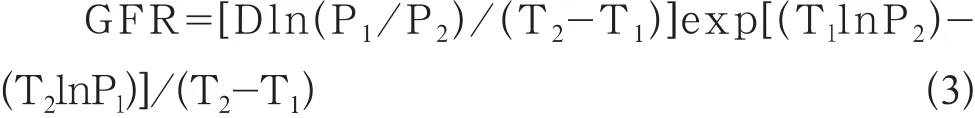
3 Gates单双探头几何均数法与双血浆法GFR均值比较
相关实验数据表明,单、双探头GM1当μ=0.12/cm时与双血浆法均值无明显差异,显示单探头和双探头GM1法与双血浆法从GFR均值上有较好的一致性,差异无显著性[19];单探头和双探头GM法之间均有明显差异,当μ=0.153/cm时,双探头GM2法的GFR均值远大于双血浆法,显示Gates双探头几何均数法当μ=0.153/cm时,GFR值是不合理的。
肾动态显像Gates法与双血浆法检测结果有较好的相关性,GFR均值无明显偏差,表明肾动态检测GFR值这两种方法具有较好的一致性,均可用于不同肾功能损伤肾脏疾病患者GFR值的测定,有较好的准确性。
4 测定GFR值的影响因素
不同患者体型、年龄、血浆蛋白结合、肾脏ROI的勾画、肾脏深度的测定、放射性计数的测定、注射放射药物的质量、本底校正以及衰减校正等均影响Gates法和双血浆法测定的GFR值。
4.1 不同年龄段对GFR值的影响
随着年龄的变化,正常人群的GFR值也在发生变化,因年龄与肾脏深度有很大的相关性,年龄的增长,脂肪组织呈向心性分布,肌肉组织减少,正常人群的GFR值随年龄变化很大,20~60岁,年龄每增长10岁GFR值会降低4 ml/min[20]。儿童及老年人因其生理上的特殊性,GFR值的测定使用经体表面积标化的GFR(即NGFR),NGFR=GFR×1.73 m2/SA(SA为体表面积)。
在儿童核素肾动态显像检查中,常忽略肾脏中心和皮肤之间的组织衰减。若只考虑软组织衰减,肾脏深度在儿童核素肾动态显像检查中每变化1 cm,GFR结果就会变化14%。临床工作中,用核医学侧位显像测定儿童肾脏深度校正检查结果。
4.2 血浆蛋白对GFR值的影响
肾动态显像检查中,理想的显像剂是不与血浆蛋白结合,而99Tcm-DTPA在血浆中与白蛋白有一定程度结合,可达3%~5%,这种结合效应使测得的肾小球滤过率比真实值降低约10%[21-22]。这一效应造成测定GFR值降低的主要机制是:①结合物分子量增大,通过滤过膜难度增加,难以通过;②结合物带负电荷,滤过膜也带负电荷,之间互相排斥,从而肾小球滤过的99Tcm-DTPA减少,造成测定结果偏差。患者GFR值越大,未结合的显像剂排出体外的速度越快,剩余的显像剂与血浆蛋白结合所占的比例增长越快,测得GFR值误差就越大[23];对此最好的解决方法是测定每批显像剂的血浆蛋白结合率,然后对测得的GFR值进行校正。
但有研究表明,临床测定GFR主要是进行个体间或个体自身的对比,且99Tcm-DTPA结合率稳定,因此一般对实际测值不进行校正,只是在分析实际测值的临床意义时予以注意。
4.3 肾脏及ROI选择对GFR值的影响
进行肾动态显像检查,均以肾脏摄取放射性显像剂的量测定肾功能,因此,肾动态显像中GFR值的计算和肾图曲线等均建立在ROI基础上,ROI分为肾脏ROI和本底ROI。
肾脏ROI是对至少1 min内的肾脏图像进行叠加后,手动勾画所需要的肾脏区域,叠加出来的图像拥有更好的信噪比。肾脏ROI的勾画应根据目的不同有选择进行:①若要评估肾脏的相对功能,则需包含全部肾单位,要勾画出完整的肾脏;②若要研究肾实质,则应只勾画出肾实质,如果勾画了集合系统,最后的结果必然有一定的误差;③若要研究尿路系统,则应增加勾画集合系统[24]。
本底ROI是指肾脏前后软组织摄取的放射性计数。在肾动态显像中,放射性计数并不全是肾脏摄取,肾脏前后软组织也摄取了一定的放射性计数,肾脏的放射性计数净摄取量应去除这部分放射性计数。在手动勾画图像过程中时,前后是重叠的,没办法直接减除这一部分的放射性计数。临床工作中发现,肾旁本底ROI与肾脏前后软组织的放射性计数非常相近,可以通过测定肾旁本底ROI的放射性计数来替代肾脏前后软组织的放射性计数[25]。ROI的形状有2种:圆形,包绕全肾;半月形,避开肝脾及髂动脉后选择肾脏外下缘。研究表明半月形ROI比圆形ROI得到的GFR值更准确[26]。
肾脏ROI和本底ROI的设置及大小对GFR有很大影响。本底ROI设置于肾脏正下方0~16个像素距离范围内、20~160个像素大小可减少本底距离和大小对GFR的影响。
4.4 肾脏深度对GFR值的影响
探头和肾脏间的软组织会造成肾脏放射性计数的衰减,需根据肾脏的深度进行校正。肾脏深度指从皮肤到肾脏中心的距离。在成人核素肾动态显像检查中肾脏深度变化1 cm,所得GFR值将出现16%的差异[22]。肾脏深度的测定常用3种方法:①利用核医学侧位显像进行测量;②Tonnesen法,利用体重与身高之比来估算;③利用B超测定。
Gates认为测定GFR的最佳条件组合为:①画半月形本底ROI;②对GFR进行深度校正;③注射显像剂后2~3 min时测定肾脏的放射性摄取,此时的数据最能代表肾脏功能。Gates法中肾脏深度根据患者的体重和身高(Tonnesen法[16])估算,左肾和右肾深度计算分别为公式4和公式5[14]:

式中体重单位为kg,身高单位为cm。
上述公式显示,身高的改变与GFR值呈负相关变化,体重的改变与GFR值呈正相关变化。通过对结果进行身高、体重值增减处理后,发现身高、体重值不同,肾脏深度估算值就不同,左、右肾的分肾GFR值占总比率不变,但总GFR值有所改变,且身高或体重改变5个单位以上,GFR值就出现显著性差异。
Taylor等[27]研究认为,Tonnesen法是在患者坐位时,B超探头以倾斜的角度用测定值推导出来的,容易低估肾脏深度,应该在仰卧位时测定肾脏深度,同时考虑年龄因素,左肾和右肾深度计算分别为公式6和公式7:

式中体重单位kg,身高单位cm。
患者的体位对测定肾脏深度有一定影响,当患者仰卧位时两肾深度之间的差距缩小,这种差距的减小有利于减小GFR测定值的误差。当患者由仰卧位转为坐位时,肾脏会向前向下移位,两肾深度之间的差距会增大。由此可见,Tonnesen法提供的肾脏深度没有仰卧位准确。
4.5 显像剂注射质量和剂量对GFR值的影响
注射显像剂的质量好坏,能本质上影响GFR值,只有高质量的“弹丸式”注射才能保证测得准确的GFR值。高质量的显像剂要求体积为0.5~1.0 ml;高质量的注射要求注射部位无显像剂渗漏情况发生,显像剂渗漏必然影响净注射量的计算,测得GFR值比正常规范方法所得值要低。如出现这种情况,患者必需隔日后重新做肾动态检查,且注射器在检查前后放射性计数测定相同的条件下进行,尤其是注射前后的注射器不能混淆,否则因活度不同致计数率不同而影响结果。注射的显像剂剂量大小对GFR值的影响较小,正常剂量为111~370 MBq,当注入剂量过小时GFR值略偏低;当注入剂量过高时,GFR测定值略偏高。
4.6 仪器、操作技术和患者的准备情况对GFR值的影响
患者在检查前做好充分准备,保持血浆流量在正常的生理状态,检查过程中保持平静,坚决避免急促呼吸以免引起体位改变。技术人员应具备优良的静脉穿刺技术以确保显像剂顺利注射进患者体内。99Tcm-DTPA体积在0.5~1.0 ml(正常剂量为74~185 MBq)。晶体的厚度、准直器的类型等都能对结果产生影响,不同型号的设备光电倍增管数量和晶体数量及均匀性校正线路等不同,都能对最终结果产生不同影响。
上述因素较为常见,且对GFR的测定结果影响较大,在其他诸如患者肾脏疾病的严重程度和肾脏形态的变化因素中,99Tcm在软组织中的衰减系数可能会由于γ光子的散射而减小,因此实际值约为0.10~0.14/cm,99Tcm在软组织中的衰减系数的变化会影响99Tcm-DTPA肾动态显像测定GFR的结果[27]。
5 展望
肾动态显像Gates法与双血浆法均可应用于不同肾功能损伤患者分肾GFR的测定,有研究显示,双血浆法更适用于肾储备功能的测定[28]。将两种方法检测结果的平均值作为最后的肾功能评估结果可以更准确地反映患者实际的分肾功能。
GFR是评价肾小球滤过功能的重要指标,同时有助于判断肾脏分期和评估肾功能状态,在临床诊治方面均有重要意义[29-30]。目前,主要问题在于确定GFR临界值,由于存在诸多的影响因素,导致测定GFR值没有确定性。希望在以后的科研工作中,能根据上述影响因素及特点对大量病例进行分组,逐组统计分析,从而得出较为准确的GFR值,更好地指导临床工作。

