钙化及非钙化乳腺导管内原位癌超声特征及其雌激素受体和人表皮生长因子受体-2表达
庞彩霞,胡 波,魏亚萍,杨华峰
(1.宁波市妇女儿童医院超声科,2.乳腺外科,浙江 宁波 315012)
乳腺导管内原位癌(ductal carcinoma in situ, DCIS)是乳腺浸润性癌的癌前病变,正确认识和诊治DCIS对控制乳腺癌的发生、发展有重要作用[1-2]。乳腺导管内肿瘤多伴有乳头溢血,且其超声表现复杂多变,导致对乳腺导管内良恶性肿瘤的诊断准确率较低[3]。随着医学技术的发展及乳腺癌知识的普及,乳腺DCIS的检出率逐渐增加[4]。本研究通过分析大样本乳腺DCIS的超声特征,并探讨其与预后预测指标雌激素受体(estrogen receptor, ER)和人表皮生长因子受体-2(human epidermal growth factor receptor-2, Her-2)表达的关系,探讨以非侵袭性方法预测DCIS预后的可行性。
1 资料与方法
1.1 一般资料 回顾性分析2013年5月—2017年9月于我院就诊并经手术病理证实的148例乳腺DCIS患者,均为女性,年龄25~77岁,平均(44.2±8.8)岁;其中无意触及肿块83例,钼靶体检发现乳腺肿块29例,乳头溢血或溢液28例,乳房胀痛8例。
1.2 仪器与方法 采用Hitachi Hivision Ascendus彩色多普勒超声诊断仪,EUP-L74M探头,频率7.5 MHz。根据病灶的具体情况调节二维超声增益、扫查深度及聚焦部位,使图像尽可能清晰,记录其超声特征,包括是否探及肿块、有无边缘毛刺、有无后方回声衰减、导管是否扩张、肿块纵横比以及有无微钙化(微钙化指簇状或斑片状强回声,单个直径<1 mm)。以CDFI观察肿块内血流信号,对有血流信号者以脉冲多普勒观察血流波形特征,并测量阻力指数(resistance index, RI)。启动超声弹性成像模式,获取肿块硬度特征,采用罗葆明等[5]提出的改良5分法作为评分标准。根据超声检出是否存在钙化将患者分为钙化组和非钙化组。
1.3 病理检查 ER蛋白的表达以细胞核内出现棕黄色颗粒为阳性染色,否则为阴性。依据乳腺癌Her-2检测指南(2014版)[6],根据细胞膜的染色状况对Her-2蛋白表达的强度进行评价:无着色或<10%癌细胞膜着色为(-);>10%癌细胞呈现微弱、不完整的细胞膜着色为(+);>10%癌细胞呈现弱至中度完整的细胞膜着色为(++);>10%肿瘤细胞呈现强、完整的细胞膜着色为(+++)。将Her-2(-)和(+)判定为阴性,Her-2(+++)为阳性。对Her-2(++)则根据荧光原位杂交(fluorescence in situ hybridization,FISH)实验进一步检验基因有无扩增,无扩增定义为阴性,有扩增定义为阳性。
1.4 统计学分析 采用SPSS 18.0统计分析软件。计量资料以±s表示。2组间比较采用两独立样本t检验;计数资料以频数或百分数表示,2组间比较采用χ2检验。P<0.05为差异有统计学意义。
2 结果
148例DCIS均为单发病灶,位于左侧乳腺70例,右侧乳腺78例。148例中,超声检出66例(66/148,44.59%)DCIS存在微钙化,其中钙化组66例和非钙化组82例。钙化组患者年龄25~75岁,平均(45.1±7.8)岁,非钙化组患者年龄27~77岁,平均(43.9±9.2)岁,2组间年龄差异无统计学意义(t=1.41,P=0.10)。
2.1 乳腺DCIS的超声特征 非钙化组DCIS超声均可探及软组织肿块,钙化组51例(51/66,77.27%)可探及肿块,15例未探及明确的肿块边界,表现为单纯性钙化,2组间差异有统计学意义(P=0.01)。非钙化组27例(27/82,32.93%)可见导管扩张(图1),钙化组12例(12/66,18.18%)可见导管扩张(图2),2组差异有统计学意义(P=0.04)。非钙化组72例(72/82,87.80%)、钙化组48例(48/66,72.73%)弹性成像评分为4~5分,差异有统计学意义(P=0.02)。2组间边缘毛刺、后方回声、血流RI及纵横比差异均无统计学意义(P均>0.05)。见表1。
2.2 2组间ER、Her-2表达比较 钙化组DCIS患者ER阳性表达率为42.42%(28/66),非钙化组为69.51%(57/82),2组差异有统计学意义(χ2=10.98,P<0.01,图1)。钙化组DCIS患者Her-2阳性表达率为30.30%(20/66),非钙化组为14.63%(12/82),2组差异有统计学意义(χ2=5.30,P=0.02,图2)。
3 讨论
3.1 乳腺DCIS的超声特征 作为一种简单快速的检查方法,超声对早期诊断DCIS具有重要价值,近年来已作为初筛工具广泛用于临床[4]。乳腺癌超声征象的本质是癌组织与正常组织生物学差异的影像学表现[7],由于癌组织及其间质受促癌基因、细胞因子及激素的调节,导致其超声表现具有多样性。乳腺DCIS的主要超声征象为形态不规则的低回声肿块,边缘多有毛刺,纵横比常<1,可伴微钙化,部分患者可见导管扩张[8]。微钙化是乳腺DCIS最具特征的超声征象之一,表现为导管内斑片状或点状强回声,直径一般<1 mm,后方不伴声影,对诊断DCIS尤为重要[8-9]。在本研究中,44.59%(66/148)DCIS伴钙化,其中15例DCIS表现为单纯性钙化。金红[8]对46例病理确诊的乳腺DCIS患者进行回顾性分析,发现高频超声显示低回声结节伴微钙化者占43.48%(20/46),本研究结果与之相似。本研究中非钙化组DCIS均可探及肿块,导管扩张更明显,并且其弹性成像评分更高,而2组边缘毛刺、后方回声、RI及纵横比差异无统计学意义,与吴朋等[9]通过比较钙化与非钙化DCIS在乳腺X线摄影、超声、MRI的不同表现所得研究结果类似。另外,本研究中68.24%(101/148)DCIS纵横比<1,可能与肿物未突破基底膜,沿导管走行生长有关。
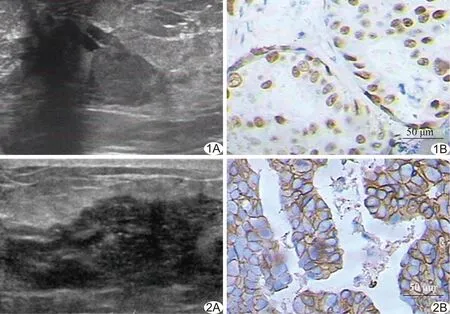
图1 患者44岁,乳腺DCIS,非钙化组 A.声像图示左侧乳腺中央区低回声区,无钙化,局部可见导管扩张; B.免疫组化染色(×200)示ER阳性 图2 患者41岁,乳腺DCIS,钙化组 A.声像图示右侧乳腺内上象限低回声区,可见簇状微钙化,未见导管扩张; B.免疫组化染色(×200)示Her-2(+++)
3.2 DCIS微钙化与ER、Her-2表达的关系 ER、Her-2在乳腺癌的发生、发展、转移过程中起重要作用,是乳腺癌内分泌治疗和靶向治疗的研究热点。ER是抗雌激素类药物内分泌治疗的靶点,而Her-2是具有酪氨酸激酶活性的肿瘤驱动基因,是乳腺癌靶向药物赫赛汀的作用靶点。Her-2高表达提示肿瘤恶性程度高,复发率高,生存期短,是乳腺癌有价值的预后指标[2]。
研究[7]表明,乳腺癌超声征象与肿瘤的生长方式有关,而肿瘤基因及分子表达水平不同影响其生长方式。笔者的前期研究[10]结果显示,在乳腺浸润性导管癌中,毛刺征、后方回声衰减与ER阳性表达呈正相关,而微钙化与Her-2表达呈正相关。微钙化是癌组织发生坏死后钙盐沉积以及恶性肿瘤影响局部钙磷代谢而形成;乳腺癌恶性度越高,其坏死越明显,则越倾向于发生钙化。本研究中非钙化组DCIS患者ER阳性表达率显著高于钙化组,而钙化组患者Her-2阳性表达率则高于非钙化组。Osborne等[11]认为间质纤维成分多的乳腺癌细胞多呈中等分化,ER多呈阳性表达。本研究中非钙化DCIS弹性成像评分更高,提示非钙化DCIS肿块硬度大、间质纤维多,与非钙化组DCIS患者ER阳性表达率高相符合。余蓉等[12]研究发现,DCIS患者中,肿块内钙化与ER、孕激素受体(progesterone receptor, PR)、Ki-67、Her-2的表达呈正相关。吴朋等[9]观察存在钙化的乳腺DCIS,发现其中病理组织学显示高级别、坏死、孕激素受体阳性、Her-2表达阳性者较非钙化DCIS更常见。王心怡等[13]发现高级别DCIS中伴微小钙化的比例更高,提示钙化作为诊断DCIS的重要表现,在一定程度上与肿瘤的侵袭性相关,而Her-2是乳腺癌预后不良的预测因素[2]。
综上所述,乳腺癌的肿瘤生物学行为引起的组织病理学改变是其超声表现的基础。乳腺钙化与非钙化DCIS的超声表现存在差异,非钙化组DCIS患者ER阳性表达率高,钙化组患者Her-2阳性表达率高,间接提示伴钙化的DCIS更具侵袭性。

