基于HPLC-Q-TOF/MS和GC/MS的香丹注射液化学成分分析
高 添, 杨凌鉴,2, 盛鑫康, 师白梅, 韩焰青, 贾 璞∗, 张亚军, 王世祥,于 洁, 郑晓晖∗
(1.西北大学生命科学学院,陕西西安 710069;2.安康学院化学化工学院,陕西安康 725000)
香丹注射液是由丹参水提物与降香饱和芳香水按一定比例配伍精制而成的中药制剂,属于国家基本药物,具有扩张血管和增强冠脉血流量等作用,临床上常用于治疗由血瘀等诱发的冠心病、心肌缺血及脑血管相关疾病[1-3]。目前,香丹注射液的化学成分研究多局限于单一药材成分或个别指标成分进行定性定量检测[4-5],而个别成分的分析难以阐明制剂的有效成分。因此,全面分析香丹注射液化学成分轮廓对于明确制剂的药效物质基础具有重要意义。
近年来,高效液相色谱-四级杆飞行时间质谱(HPLC-Q-TOF/MS) 和气相色谱-质谱联用技术(GC/MS)等色谱-质谱联用技术凭借其具有的高分离性、高分辨率以及高灵敏度等优势,在不需要对照品的情况下能提供化合物结构表征所需的精确质量数、元素组成、质谱碎片等信息,在中药非挥发性成分和挥发性成分的定性检测方面得到了日益广泛地应用[6-7]。
本研究首次采用 HPLC-Q-TOF/MS结合 GC/MS的分析方法对香丹注射液中化学成分进行定性分析,采用高分辨质谱分析结合对照品比对及相关文献共鉴定出53个水溶性化合物,主要为酚酸类、有机酸类、丹参酮类和氨基酸类等。采用标准质谱图库检索结合文献资料参考,共鉴定出9个挥发性成分,较为全面地揭示了其化学组成,以期为香丹注射液的质量控制和药效物质基础研究提供参考。
1 仪器与试药
1.1 仪器 Agilent 1260 HPLC-6520 Accurate-Mass Q-TOF LC/MS联用系统、 Agilent 6890N GC/5973N MSD气相色谱-质谱联用仪系统 (美国Agilent公司);VER-TEX26型快速混匀器 (海门市其林贝尔仪器制造有限公司);优普UPD-II-10T超纯水机(四川优普超纯科技有限公司);XS105DU型电子天平 (瑞士Mettler Toledo公司);KQ5200DE型数控超声波清洗仪 (昆山市超声仪器有限公司)。
1.2 试药 丹参素钠 (DSS)、原儿茶酸 (PA)、原儿茶醛 (PAL)、香草酸 (VA)、咖啡酸 (CA)、迷迭香酸 (RA)、丹酚酸B(Sal B)对照品 (均购自于中国食品药品检定研究院,批号分别为110855-201311、 110809-201205、 110810-200205、110776-200402、 110885-200102、 111871-201203、111562-201212,含有量均大于 98%);紫草酸(LA)对照品 (批号 PCM-SM-006,含有量大于98%)购自天津万象恒远科技有限公司;丹酚酸A(Sal A)对照品 (批号为DST160928-009,含有量大于98%)购自成都德思特生物技术有限公司;香丹注射液 (四川升和药业股份有限公司,国药准字 Z51021309,批号 1510203,规格 10 mL×5支);上述对照品与注射剂均于4℃条件下冷藏备用。
色谱纯甲醇及乙腈、质谱级甲酸及甲酸铵(美国Fisher Scientific公司);超纯水 (电阻率为18.25 MΩ)由优普UPD-II-10T超纯水机系统制备;其他试剂均为分析纯。
2 方法
2.1 色谱-质谱联用条件
2.1.1 HPLC-Q-TOF/MS 条件 Agilent TC-C18色谱柱 (4.6 mm×250 mm,5 μm); 流动相0.05%甲酸水 (A) -甲醇 (B), 梯度洗脱 (0~25 min,7% ~15%B; 25~45 min, 15% ~25%B; 45~80 min,25% ~50%B; 80~100 min, 50% ~80%B; 100~115 min, 100%B; 115~120 min, 5%B); 柱温30℃;体积流量0.6 mL/min;柱后分流比为3∶1;进样量 20 μL。
2.1.2 质谱条件 电喷雾离子源 (ESI);采用正负离子2种模式进行检测;负离子条件下毛细管电压3 500 V;正离子模式下为4 000 V;干燥气体积流量10 L/min;干燥气温度350℃;雾化气压力275.8 kPa;碎裂电压 135 V;扫描范围 100~1 100 m/z;采样频率0.2 s;碰撞能分别设为10、20、30、40 eV;采集数据前利用调谐液校准质量轴,保证质量测定误差小于10×10-6。见图1。
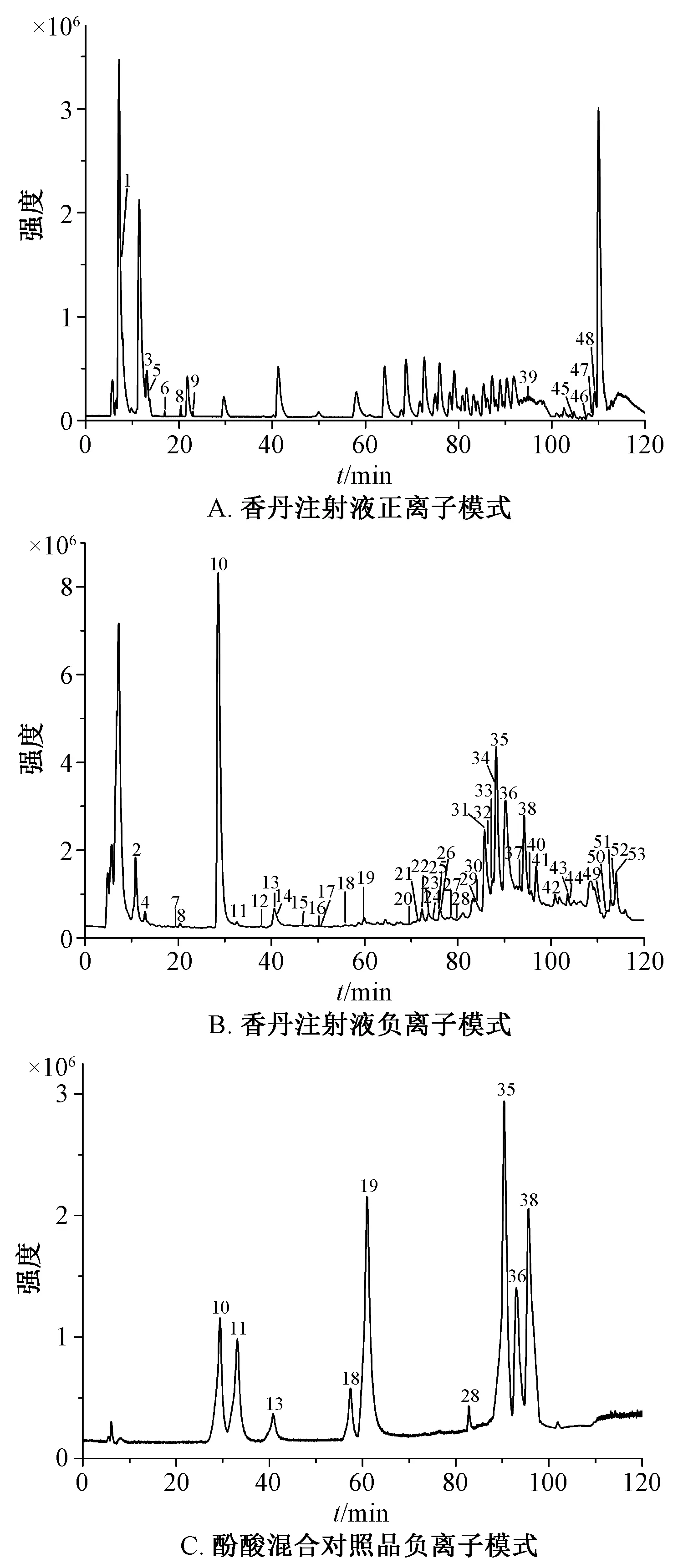
图1 各样品总离子流图Fig.1 Total ion current chromatograms of various samples
2.1.3 GC/MS条件 Agilent HP-5 MS毛细管色谱柱 (30 m×0.25 mm, 0.25 μm); 程序升温, 初始温度60℃,保持0 min,以1.5℃/min的速率升温至110℃,保持5 min,再以1.5℃/min的速率升温至120℃,保持10 min,接着以2℃/min的速率升温至160℃,保持5 min,最后以20℃/min的速率升温至260℃,保持0 min;载气氦气;体积流量1.5 mL/min; 分流比1∶1; 进样体积1 μL;进样口温度260℃;气质接口温度260℃;电离方式电子轰击 (EI);电离能量70 eV;扫描范围m/z 30~600; 扫描间隔0.5 s。
2.2 溶液制备
2.2.1 酚酸混合对照品溶液制备 精密称取丹参素钠、原儿茶酸、原儿茶醛、香草酸、咖啡酸、紫草酸、迷迭香酸酸、丹酚酸B、丹酚酸 A对照品各5.0 mg,置于5.0 mL的棕色量瓶中,用甲醇定容,得到1.0 mg/mL的各酚酸混合对照品贮备液。再用甲醇稀释,得到25 mg/L各酚酸混合对照品溶液。
2.2.2 供试品溶液制备
2.2.2 .1 HPLC-Q-TOF/MS供试品溶液 精密量取同一批次香丹注射液1.0 mL,置于5.0 mL量瓶中,用超纯水定容,经0.22 μm微孔滤膜过滤,即得。
2.2.2 .2 GC/MS供试品溶液 精密量取同一批次的香丹注射液10.0 mL,置于20.0 mL的具塞试管中,用5.0 mL二氯甲烷萃取3次,合并萃取液,经无水硫酸钠干燥后,将萃取液自然挥发至约0.5 mL,即得。
3 结果
3.1 水溶性成分 按 “2.2.2.1”项下方法制备供试品溶液,在 “2.1.1”项条件下进样,利用质谱数据获取各成分结构鉴定所需的母离子及子离子在合理测定误差内的精确质量数、计算其元素组成。香丹注射液中水溶性成分在正离子和负离子模式采集的总离子流图以及酚酸混合对照品在负离子模式采集的TIC图见图1。通过对照品比对、质谱裂解规律分析和文献报道,从香丹注射液水溶性成分中鉴定出53个化合物,其中包括31个酚酸、5个丹参酮、8个有机酸、4个氨基酸、3个核苷、2个其他类化合物,见表1。
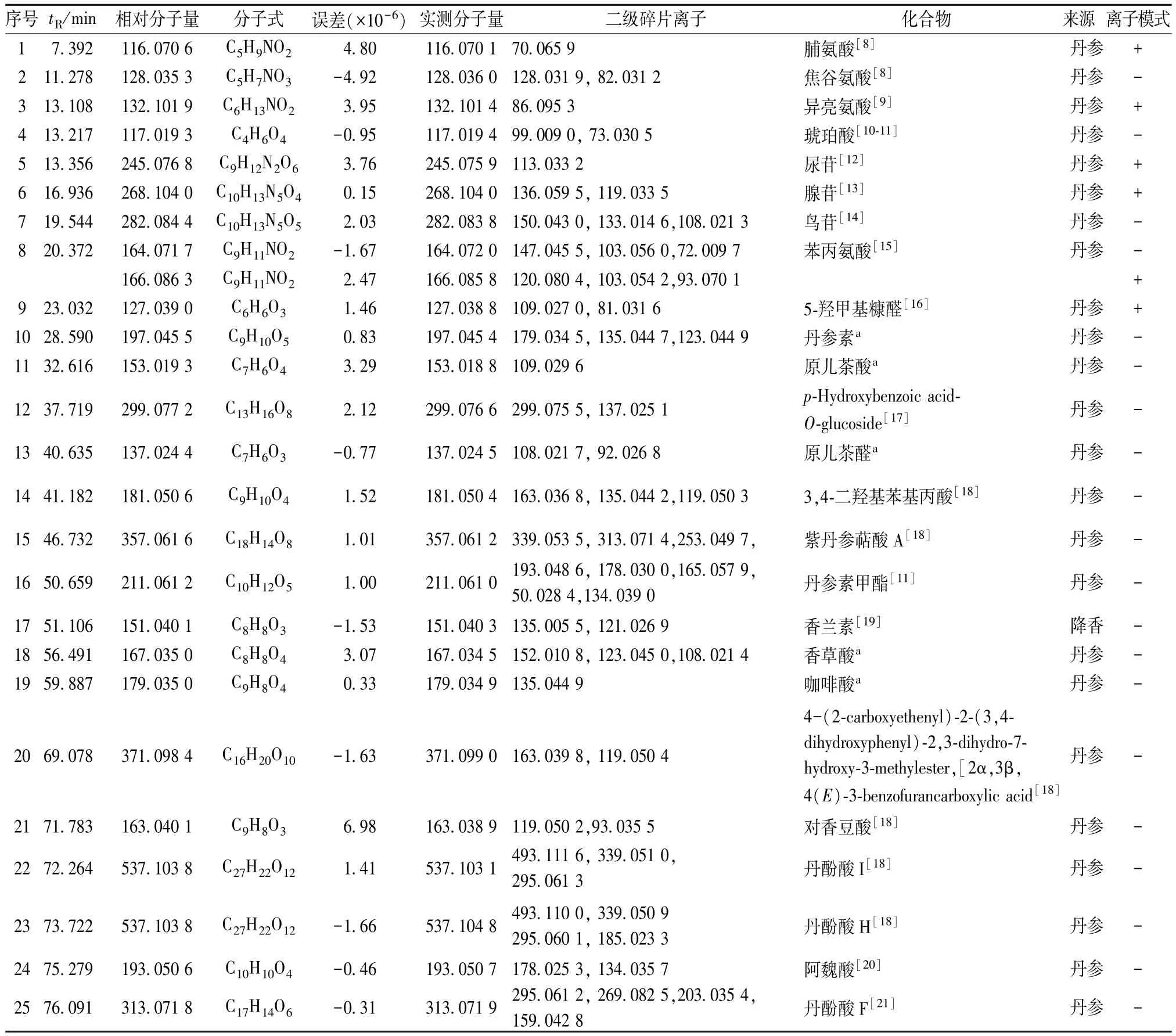
表1 香丹注射液HPLC-Q-TOF/MS分析Tab.1 HPLC-Q-TOF/MS analysis of Xiangdan Injection
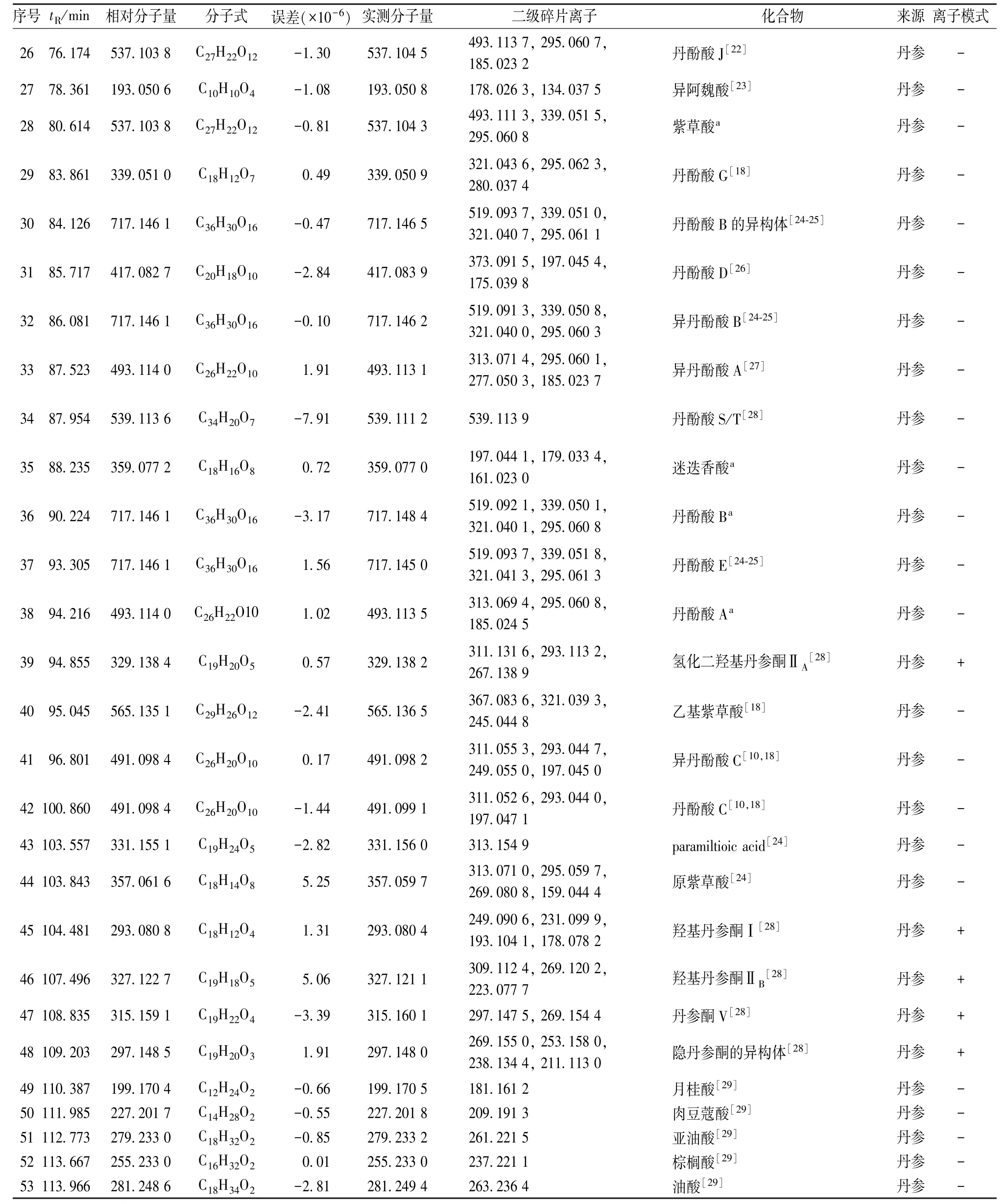
续表1
3.1.1 酚酸类成分鉴定 在香丹注射液中共检测出31个酚酸类物质,其中30个来自丹参,1个来自降香,该类成分在负离子模式下响应较好。丹酚酸中含有丹参素、原儿茶酸、咖啡酸及其二聚体或多聚体的结构,且二级质谱中常出现丹参素,咖啡酸以及咖啡酰氧基等中性丢失。以化合物36为例,在负离子模式下,生成了准分子离子峰m/z 717.14( [M-H]-), 子离子 m/z 519.09, m/z 339.05,m/z 321.04, m/z 295.06, 表明母离子 717.14([M-H]-)分别丢失了一分子丹参素,一分子丹参素加一分子咖啡酸,两分子丹参素,一分子丹参素加一分子咖啡酸以及一分子二氧化碳。通过对照品和文献 [24-25]比对,确定化合物36为丹酚酸B,其二级质谱图和质谱裂解途径见图2。

图2 丹酚酸B质谱裂解模式Fig.2 Massspectra and fragmentpathway of salvianolic acid B
3.1.2 有机酸类成分鉴定 在香丹注射液中共检测到8个有机酸类成分,均来源于丹参,该类化合物在负离子模式下响应较好。由于该类化合物中含有羧基基团,因此其分子离子峰在裂解过程中存在44 Da(CO2)的中性丢失。以色谱峰4为例,其准分子离子峰[M-H]-的质荷比为m/z 117.019 4,在外加碰撞能量的作用下,该离子又进一步碎裂生成[M-H-CO2]-的碎片离子 m/z 73.030 5, 其生成机制为脱去一分子CO2,根据文献 [10-11],将其鉴定为琥珀酸,其二级质谱图和质谱裂解途径见图3。
3.1.3 丹参酮类成分鉴定 丹参酮类成分正离子模式下响应较好。正离子模式下,共检测到5个该类化合物,均来自于丹参。以化合物45为例,母离子为m/z 293.080 4( [M+H]+),由于脱去一分子羟基和一分子羰基,生成了特征性子离子m/z 249.090 6,该子离子继续丢失一分子水形成子离子m/z 231.09,根据文献 [28],其质谱信息与羟基丹参酮I一致,因此,将化合物45归属为羟基丹参酮I,其二级质谱图和质谱裂解途径见图4。
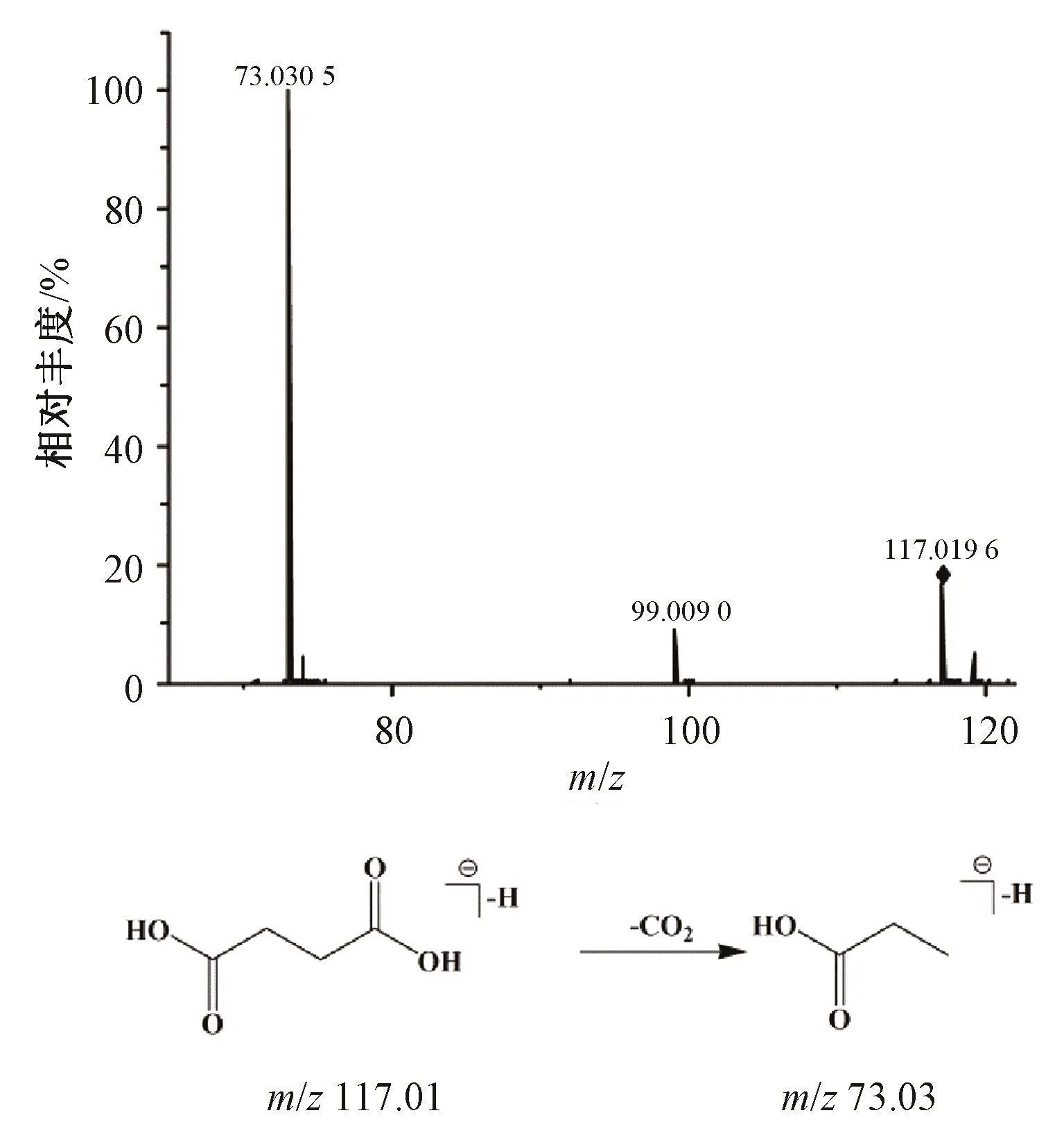
图3 琥珀酸质谱裂解模式Fig.3 Mass spectra and fragment pathway of succinic acid
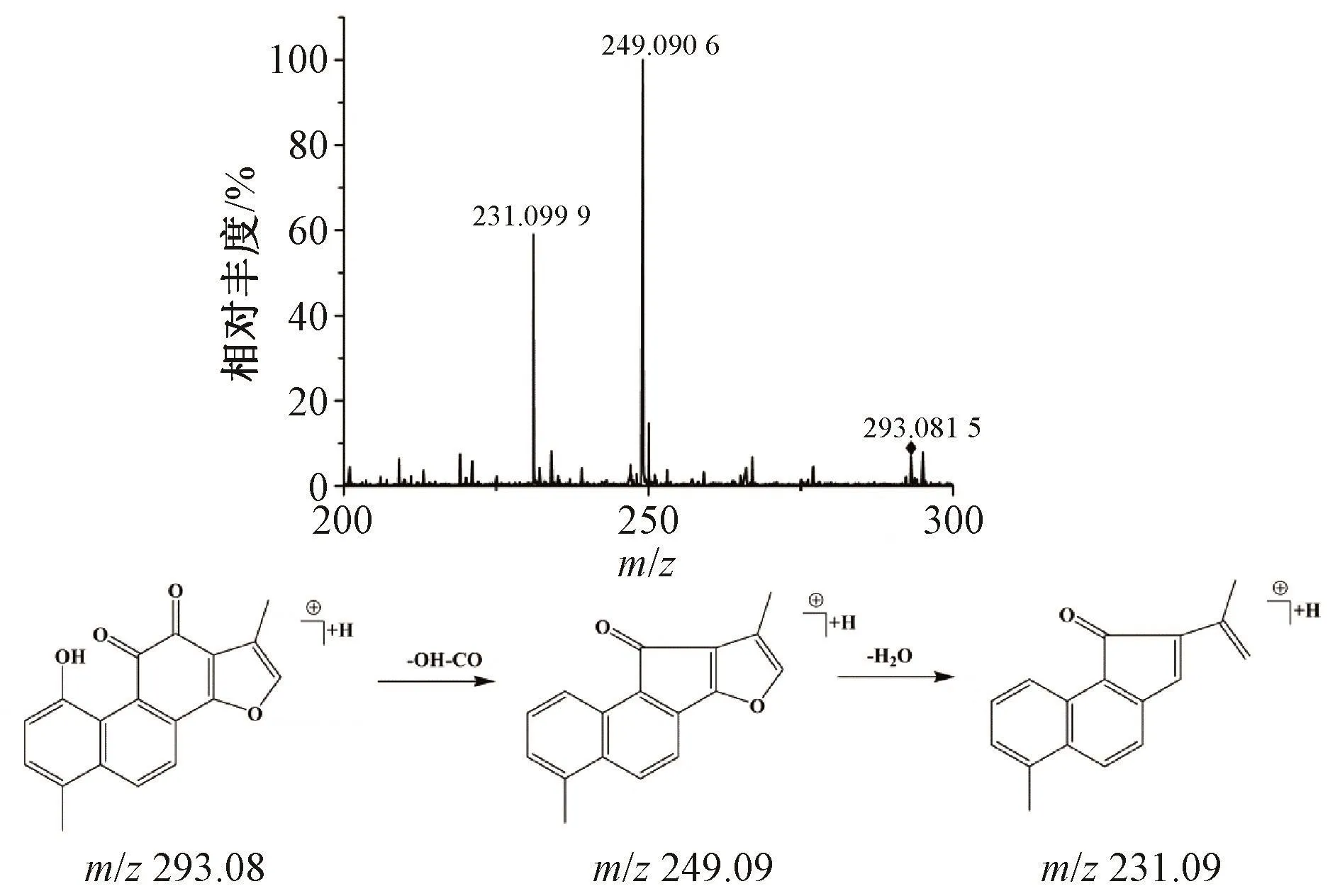
图4 羟基丹参酮I质谱裂解模式Fig.4 Massspectra and fragmentpathway of hydroxytanshinoneⅠ
3.1.4 氨基酸类化合物鉴定 通过在质谱时间窗内提取离子流图共发现4个物质的色谱峰分别为化合物1~3、8,根据文献 [8-9,15]中检索化合物的一级二级质谱信息,确定这4个物质分别为脯氨酸、焦谷氨酸、异亮氨酸、苯丙氨酸,且均来自于丹参。以化合物1为例,有1个分子离子峰m/z 116.070 1([M+H]+),其主要的碎片离子为m/z 70.060 1,其形成机理是通过母离子丢失一分子甲酸而得到,基于文献 [8],推测化合物1为脯氨酸,见图5。
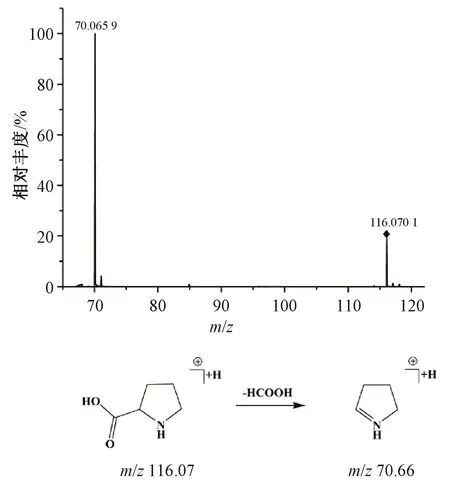
图5 脯氨酸质谱裂解模式Fig.5 Mass spectra and fragment pathway of proline
3.1.5 核苷类化合物鉴定 化合物5~6质子化后得到分子离子峰 [M+H]+,其质荷比分别为m/z 245.075 9和268.104 0,进一步脱去核糖残基得到子离子m/z 113.033 2和m/z 136.059 5,根据已有文献 [12-13],确定化合物5~6分别为尿苷、腺苷;化合物7首先去质子化得到准分子离子峰m/z 282.084 4([M-H]-),然后脱去一分子核糖得到m/z 150.043 0 ( [M-H-132]-), 接着脱去一分子氨 (NH3) 得到碎片离子 m/z 133.013 8[M-H-132-17]-,结合文献 [14],推断化合物7为鸟苷,见图6。
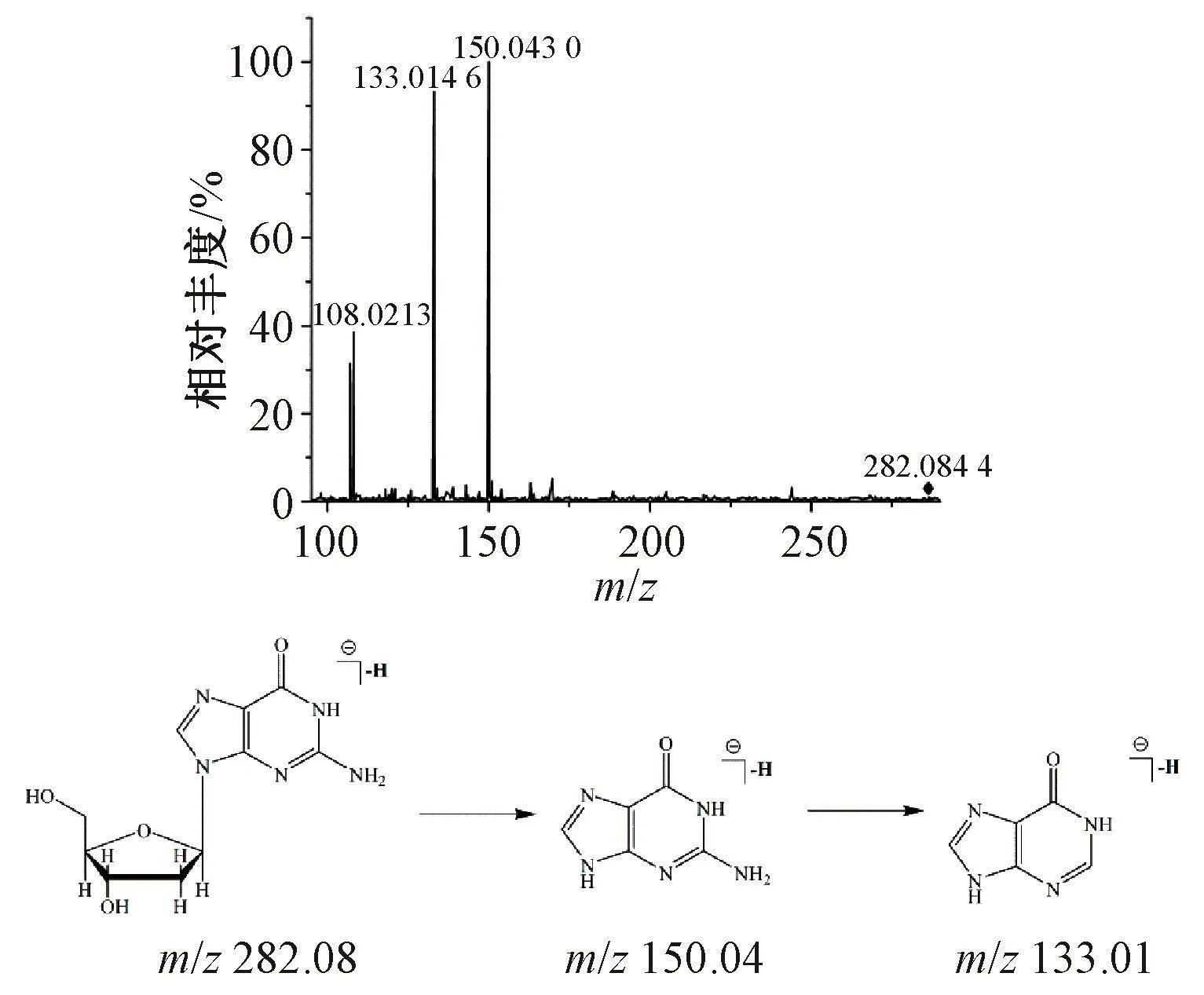
图6 鸟苷质谱裂解模式Fig.6 Mass spectra and fragment pathway of guanosine
3.2 挥发性成分 在 “2.1.2”项条件下,对香丹注射液GC/MS分析供试品溶液进行定性分析,获取香丹注射液挥发性成分GC/MS总离子流图,见图7。将香丹注射液二氯甲烷萃取液总离子流图中各色谱峰在NIST库中进行检索,并与文献资料进行比对, 确定出香兰素[22-32]、 橙花叔醇[32-34]、2, 4-二甲基-2, 6-庚二烯醛[32,35]等 9 个化合物,见表2。

图7 挥发性成分GC/MS总离子流图Fig.7 GC-MS total ion current chromatogram of volatile constituents
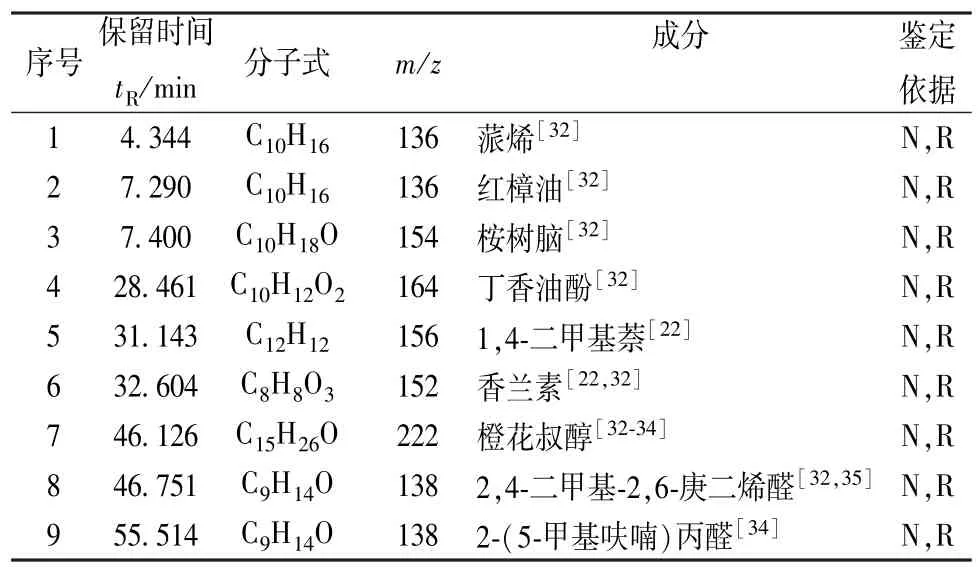
表2 挥发性成分GC/MS分析Tab.2 GC/MS analysis of of volatile constituents
4 讨论
4.1 挥发性成分提取溶剂考察 本研究对提取溶剂进行了考察,分别尝试了石油醚、二氯甲烷及乙酸乙酯3种溶剂,发现当提取溶剂为二氯甲烷时,GC/MS中检测的色谱峰个数较多,且提取过程中不出现乳化现象,因而采用二氯甲烷作为萃取溶剂。
4.2 条件优化
4.2.1 HPLC-Q-TOF/MS条件优化 液相色谱条件和质谱采集参数是影响液相色谱-质谱高效分离和灵敏检测的关键因素[36-38]。在流动相选择方面,由于甲醇表现出与乙腈相似的分离效果且较为廉价,因而本实验选择甲醇作为有机相;在水相添加剂的选择方面,本研究分别选取了0.05%甲酸水-甲醇、0.1%甲酸水-甲醇、0.2%甲酸水-甲醇、1 mmol/L甲酸铵-甲醇、 2 mmol/L 甲酸铵-甲醇、5 mmol/L甲酸铵-甲醇等6种不同的流动相体系,当水相中甲酸的比例为0.05%时,香丹注射液中各成分的质谱响应最好,分辨率最佳;在洗脱方式选择方面,香丹注射液中成分复杂且部分成分极性十分接近,因而,本研究采用了梯度洗脱的方式;在柱温选择方面,当柱温为30℃时,香丹注射液中各成分分离较好。
在质谱采集模式选择方面,本研究发现,负离子模式下香丹注射液中酚酸类、有机酸等成分的质谱响应较好,正离子模式下丹参酮类、氨基酸等成分的质谱响应较好,因而本研究同时采用正负离子2种模式对香丹注射液水溶性成分进行检测。其次,对毛细管电压、碎裂电压、雾化气压力、干燥气温度、干燥气流速等质谱参数进行了优化。
4.2.2 GC-MS条件优化 温度是影响GC/MS分离检测的重要因素[39]。由于香丹注射液中挥发性成分较为复杂,采用恒温的方式无法达到良好效果,且降低了质谱检测的分辨率,因而本研究采用程序升温条件,各挥发性成分的分离和分辨率较好。
4.3 成分分析 近年来,关于香丹注射液中水溶性成分的检测多集中在丹参素、原儿茶醛、丹参酚酸 B等酚酸类成分,未涉及其他成分的报道[40]。本研究在前人基础上,采用HPLC-Q-TOF/MS法对香丹注射液中的水溶性成分进行表征,不仅检出31个酚酸,还检出丹参酮、有机酸、氨基酸、核苷等其他4类成分共22个化合物,其中酚酸类化合物占60%,表明丹参酚酸类成分为香丹注射液的主要成分。
在香丹注射液挥发性成分的GC/MS分析中,共检出香兰素、橙花叔醇等9个化合物,与文献[22]报道的成分基本一致,并未检出文献 [41-43]中报道的降香挥发油中氧化石竹烯、没药烯、金合欢烯等成分,推测可能与香丹注射液制剂中降香药材的来源以及制剂的加工形式有关。
本研究建立的 HPLC-Q-TOF/MS和 GC/MS分析方法较为全面地表征了香丹注射液中的化学成分,不仅完善了香丹注射液的质量控制方法,还可为该制剂体内药效物质基础研究奠定基础。

