优化18F-FHBG自动化合成方法及其质量评估
,,,,*
(1.郑州大学第一附属医院核医学科,河南 郑州 450052;2.河南省分子影像医学重点实验室,河南 郑州 450052)
核素报告基因显像是监测机体细胞内、外源性基因表达最具潜力的方法之一,其中最关键点是报告基因和放射性药物(报告探针)的选择。单纯疱疹病毒胸苷激酶基因(HSV1-tk基因)是最常用的报告基因之一[1],而18F-FHBG为检测HSV1-tk基因表达最具特异性的显像剂之一[2]。18F-FHBG的主要优点是在HSV1-tk非表达细胞中浓聚较少,而在靶器官表达显著;但其制备过程复杂,且产率较低。为减少合成时间,提高18F-FHBG产率,本研究对洗脱方法和纯化方法进行改进,用全自动合成一锅法[3-4]和SEP-PAK C18[5]小柱固相萃取法合成正电子示踪剂18F-FHBG;并对合成产物进行质量鉴定,分析纯化后的产物在健康昆明小鼠体内的生物分布,并观察其在健康新西兰大白兔体内的PET/CT显像特征,评估采用改进方法合成的18F-FHBG的质量稳定性,为下一步高效合成18F-FHBG进行HSV1-tk/18F-FHBG核素报告基因显像研究提供参考。
1 材料与方法
1.1 实验动物 随机选取健康昆明小鼠20只[合格证号SCXK(豫)2017-0004],雄性,6~8周,体质量25.5~30.5 g,平均(28.00±2.50)g,用于观察18F-FHBG生物学分布;选取健康新西兰大白兔4只[合格证号SCXK(豫)2017-0008],雄性,体质量2.0~3.0 kg,平均(2.50±0.50)kg,用于观察18F-FHBG PET/CT显像特征;均购自河南省实验动物中心。本实验通过郑州大学伦理委员会批准。
1.2 试剂 美国药典级乙醇(US pharmacopoeia,USP Milliper公司);前体N2-(对甲氧苯基二苯基甲基)-9-[(4-甲苯磺酰基)-3-对甲氧苯基二苯基甲氧基-甲基丁基]鸟嘌呤;HCl、NaOH、Buffer(北京化学试剂厂);H218O(丰度97%)以及无水乙腈等。
1.3 仪器 医用回旋加速器(Sumitomo HM-20S);多功能模块(住友CFN-multi-p100);CFN-multi-P100(配备Allrtech 626双泵和UVSI 200全波长紫外检测器,Grace Alltima C18 HPLC柱);Sep-Pak C18及QMA柱(Waters公司);IC-H柱(Alltech公司);PET/CT成像系统(Siemens Biography True Point 64 52环);Syngo工作站(Siemens True D融合软件)。
1.4 合成方法 采用住友合成模块合成18F-FHBG,自行设计流程。合成反应开始前,将所有试剂加于预先设计的相应位置,用回旋加速器加速质子轰击 H218O,经18O(p,n)反应生成18F-;18F-在He气的作用下通过SEP-PAK QMA阴离子小柱并被QMA柱捕获,在真空泵的作用下将0.7 ml kryptofix2.2.2和0.2 ml碳酸钾混合溶液倒吸通过QMA柱,将18F-洗脱注入反应瓶。为保证加入前体前是绝对无水环境,将反应瓶加热至120℃,持续6~8 min,随后加入1.0 ml乙腈溶液,加热至100℃,持续5 min,完成2次除水。
将0.75 ml前体N2-(对甲氧苯基二苯基甲基)-9-[4-甲苯磺酰基]-3-对甲氧苯基二苯基甲氧基-甲基丁基]鸟嘌呤溶液加入反应瓶,加热至120℃,反应持续8 min,此过程中前体与18F-发生亲核取代反应,完成后冷却浓缩反应液。将0.75 ml盐酸溶液加入到反应瓶中,加热至95℃,持续5 min,完成水解反应,此时混合液pH值为酸性且含有杂质,需进一步中和及纯化。加入0.5 ml NaOH和1.0 ml磷酸二氢钠缓冲液(Buffer)混合液于反应瓶中,中和产物混合液,产物混合液通过SEP-PAK C18小柱时可吸附于小柱上。以预先备好的乙醇通过C18小柱洗脱产物,于产物瓶中注入生理盐水稀释18F-FHBG,经无菌滤膜滤过备用,制成注射液。
1.5 放射化学纯度和体外稳定性检测 采用HPLC法测定18F-FHBG注射液的化学纯度和放射化学纯度。HPLC分析条件:C18分析柱,流动相为 3 mmol/L NaH2PO4的10%乙醇溶液,流速为1 ml/min,紫外(UV)检测波长为254 nm[5]。
1.6 动物实验
1.6.1 生物分布实验 将20只健康昆明小鼠随机分成4组,每组5只。经尾静脉注射放射性药物18F-FHBG注射液(5.55 MBq)约0.1 ml,分别在给药后5、30、60、120 min采用断脊法处死小鼠,取心脏、肺脏、肝脏、脾脏、肾脏、胃、小肠、股骨、肌肉、脑和血液样本分别置于试管中,以天平称重,并用井型γ探测器测其放射性计数,经衰减校正后,计算单位组织摄取率(每克组织占注射剂量的百分比,单位%ID/g)。
1.6.2 活体PET/CT显像 对4只新西兰大白兔经肌肉注射2%戊巴比妥钠1 ml/kg体质量[6],待其进入深度麻醉状态后,经耳缘静脉注入0.2 ml18F-FHBG注射液(11.1~14.8 MBq/kg体质量),分别在给药后10、30、60、90、120 min进行PET/CT扫描,3分钟/床位,经Syngo工作站处理获得PET/CT图像。
表1 正常昆明小鼠不同部位生物分布结果(%ID/g,±s)

表1 正常昆明小鼠不同部位生物分布结果(%ID/g,±s)
部位放射性摄取率5 min30 min60 min120 min心脏0.033±0.0090.022±0.0070.020±0.0070.015±0.002肺脏0.057±0.0090.049±0.0040.047±0.0080.034±0.005肝脏0.074±0.0080.070±0.0040.049±0.0060.017±0.004脾脏0.059±0.0080.048±0.0050.036±0.0040.016±0.002肾脏0.271±0.0030.370±0.0090.490±0.0040.460±0.003胃0.062±0.0020.064±0.0040.070±0.0020.046±0.009小肠0.052±0.0080.086±0.0060.167±0.0110.157±0.018股骨0.019±0.0020.018±0.0050.017±0.0040.002±0.002肌肉0.020±0.0030.019±0.0040.002±0.0010.002±0.002脑0.019±0.0020.017±0.0030.016±0.0020.015±0.003血液0.243±0.0800.050±0.0220.006±0.0030.004±0.002
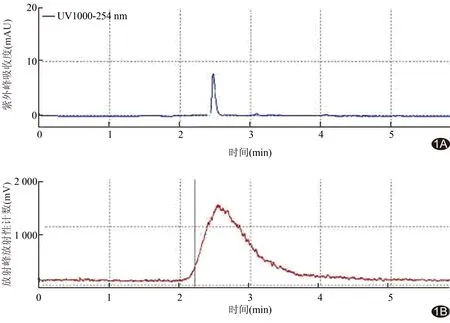
图1 18F-FHBG的HPLC质量控制图谱 A.紫外峰,UA=254 nm; B.放射峰,tR=2.5 min
2 结果
2.118F-FHBG合成及质量控制指标18F-FHBG自动化合成时间为19~25 min。获得的18F-FHBG产品为无色溶液,pH≈7.0,放射性浓度>70 MBq/ml。18F-FHBG未校正的合成效率为(19.00±5.00)%(n>10)。产品经放射层析图谱分析,结果呈现单峰,与标准品19F-FHBG保留时间(retention time, tR)一致,均为tR=2.5 min;经紫外层析图谱分析,只发现溶剂峰,未发现前体峰,即HPLC法测定注射液中18F-FHBG的放射化学纯度>99%。见图1。
2.218F-FHBG的体外稳定性检测 将18F-FHBG产品在生理盐水和血清中稀释,测定正电子示踪剂的稳定性。采用生理盐水稀释18F-FHBG产品,室温放置5、30、60、90、120 min及6 h后其放射化学纯度分别为(98.31±0.64)%、(98.08±0.83)%、(97.40±0.69)%、(97.21±0.53)%、(97.23±0.52)%及(97.24±0.61)%;采用血清稀释18F-FHBG,室温放置5、30、60、90、120 min及6 h后其放射化学纯度分别为(98.07±0.68)%、(98.02±0.82)%、(97.33±0.59)%、(97.12±0.51)%、(97.13±0.54)%及(96.96±0.62)%。在生理盐水和血清中,6 h内18F-FHBG放射化学纯度均未明显减低,可满足进一步研究需要。
2.3 生物分布结果 在小鼠血液中,注射18F-FHBG 5 min时摄取率最高,为(0.243±0.080)%ID/g,之后快速下降,30 min时下降至(0.050±0.022)%ID/g,120 min时接近本底水平。在小鼠心脏、肝脏、肺脏和脾脏中,注射18F-FHBG 5 min时摄取率最高,随时间延长而逐渐降低,120 min下降至观察时间的最低值。在小鼠胃和小肠中,注射18F-FHBG 60 min时摄取率最高,之后逐渐下降。在小鼠肾脏中,注射18F-FHBG 60 min时摄取率最高。小鼠股骨和肌肉对18F-FHBG的摄取率较低。小鼠脑组织对18F-FHBG的摄取率也较低,且在120 min内无明显变化。见表1。
2.4 活体PET/CT显像结果 新西兰大白兔PET/CT结果表明,注射18F-FHBG 10、30、60、90及120 min时,放射性分布较高的分别为膀胱、肾脏、肠道及肝胆。图2为注射18F-FHBG 10 min时,放射性分布已遍及兔全身,肝胆、肾脏及肠道已开始显像;与其他显像时间相比,注射18F-FHBG 10 min时肾脏显像最明显,此后随时间延长其代谢逐渐减弱。图3为注射18F-FHBG 30 min时,肾脏显像已逐渐减少,肠道及肝胆显像逐渐增强;图4为注射18F-FHBG 60 min时,肾脏显像更弱,空肠、回肠显像逐渐减弱,而盲肠、乙状结肠显像逐渐增加。图5为注射18F-FHBG 90 min时,肾脏已几乎不显像,空肠、回肠显像减弱更加明显,盲肠显像逐渐增强。图6为注射18F-FHBG 120 min时,盲肠显像最明显,其他器官几乎不显像。在整个放射性显像过程中,由于血液清除速率快,使显像过程中本底较低,其他器官显像明显,对比效果较好。
3 讨论
18F-FHBG的合成方法包括一锅法[5,7]和二锅法[8-9],一锅法是在同一反应瓶中完成亲核、水解、中和三步反应;二锅法是将相应的反应分步完成,然后将生成的中间体转移到同一反应瓶中进行后续反应。目前较少采用二锅合成法合成18F-FHBG。Shiue等[5]采用手动一锅法合成18F-FHBG,所得产物产率较高,且放射化学纯度>97%,但手动合成会导致操作者辐射剂量增多,分装放射性药物时,手部是全身受辐射剂量最高部位[10]。有学者[9]提出全自动一锅合成法。本研究采用全自动合成模块合成18F-FHBG,不仅可减少操作者辐射剂量,而且合成效率高,可重复性强。
为减少反应时间、增加18F-FHBG产率,本研究主要对2个方面进行改进:①产物洗脱液;②采用纯化方法。传统洗脱液包含二氯甲烷、0.1%三乙胺和5%~10%乙醇;洗脱产物后,需分洗脱液与产物。有学者[11]采用传统洗脱液洗脱产物,合成时间相对较长。本研究采用乙醇代替传统洗脱液,产物18F-FHBG吸附在SEP-PAK C18小柱后,直接用乙醇将18F-FHBG从小柱中洗脱,不需蒸发乙醇溶剂,溶液经生理盐水稀释后获得18F-FHBG混合液,可直接用于后续动物活体实验。产物18F-FHBG混合液的纯化方法包括HPLC[6,8]和SEP-PAK C18[8,12]固相萃取方法。有学者[6]同时采用上述2种纯化方法,对比发现采用SEP-PAK C18固相萃取方法获得的产物产率高于HPLC纯化法,合成时间自90 min缩短至60 min。本研究采用SEP-PAK C18固相萃取法纯化产物,操作简单,纯化过程时间短,合成效率明显提升,产品合成时间为23~26 min,未校正的合成效率为(19.00±5.00)%。

图2 注射18F-FHBG 10 min时正常新西兰大白兔全身显像 A~F.放射性分布已遍及全身,肝胆、肾脏、肠道已开始显像 图3 注射18F-FHBG 30 min时正常新西兰大白兔全身显像情况 A~F.肾脏显像已逐渐减少,肠道及肝胆显像逐渐增强 图4 注射18F-FHBG 60 min时正常新西兰大白兔全身显像情况 A~F.肾脏显像更弱,空肠、回肠显像逐渐减弱,而盲肠、乙状结肠显像逐渐增加
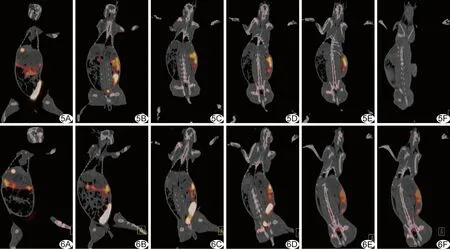
图5 注射18F-FHBG 90 min时正常新西兰大白兔全身显像情况 A~F.肾脏已几乎不显影,空肠、回肠显影也更弱,盲肠显影逐渐增强 图6 注射18F-FHBG 120 min时正常新西兰大白兔全身显像情况 A~F.盲肠显影最明显,其他器官几乎不显影
本研究中18F-FHBG在正常昆明小鼠体内的生物学分布结果及新西兰大白兔全身PET/CT显像结果与既往研究[12]结果一致。对动物注射18F-FHBG混合液后,18F-FHBG在血液中的清除速率较快,显像时可增加图像对比度。骨骼、肌肉对18F-FHBG摄取较少,且随时间延迟摄取率逐渐降低,提示后期显像研究中本底较低,靶/非靶的比值增加,有利于观察病灶。18F-FHBG在小鼠肾脏内分布最多,表明药物主要经过泌尿系统排泄,推测该示踪剂用于泌尿系统研究时可受到一定程度的影响。胃肠道是18F-FHBG体内排泄的另一途径。18F-FHBG在小鼠脑组织中的摄取率极少,且随时间变化改变较小,提示18F-FHBG可能无法通过血脑屏障,用于观察血脑屏障破坏的疾病时对比效果可能较好。

