不同生态环境下水稻穗部性状QTL鉴定
刘进 姚晓云 刘丹 余丽琴 李慧 王棋 王嘉宇, * 黎毛毛, *
不同生态环境下水稻穗部性状QTL鉴定
刘进1, 2,#姚晓云1, 2, #刘丹3余丽琴1李慧1王棋2王嘉宇2, *黎毛毛1, *
(1江西省农业科学院 水稻研究所/水稻国家工程实验室(南昌)/国家水稻改良中心南昌分中心, 南昌 330200;2沈阳农业大学 水稻研究所, 沈阳 110866;3黑龙江省农业科学院 牡丹江分院, 黑龙江 牡丹江 157041;#共同第一作者;∗通讯联系人, E-mail: ricewjy@126.com; Lmm3056@163.com)
【目的】发掘与产量相关的穗粒性状QTL对进一步克隆和利用高产基因具有重要意义。【方法】以超级粳稻龙稻5号和典型高产籼稻中优早8号杂交衍生的重组自交系群体为试材,在4种环境下对穗部性状进行比较和QTL分析。【结果】共检测到63个穗部性状QTL,分布于除第9染色体外的11条染色体上。在4个环境下分别检测到27、27、18和35个QTL。其中,16个QTL能在2个环境下被检测到,12个在3个以上环境下稳定表达,分别占QTL总数的25.40%和19.05%;第1、3、4和5染色体的多效QTL簇能在不同环境下稳定表达,对穗部性状具有明显的调控作用。【结论】第3染色体STS3.3−STS3.6区间的、第4染色体RM5688−RM1359区间的是2个新的稳定表达的多效性QTL簇。此外,上位性效应是调控穗部性状的重要组分。
水稻; 生态环境; 穗部性状; 上位性效应
水稻是最重要的粮食作物之一,养活了全球一半以上的人口。因此,不断提高水稻产量,对于保障国家粮食安全和社会稳定具有重要意义[1-2]。目前来看,进一步提高水稻产量潜力,无外乎株型改良、杂种优势利用和有利基因的发掘三个主要途径[3]。通过鉴定和克隆与高产相关的功能基因,并结合分子育种技术来培育高产水稻品种是当前进一步实现超高产的可行途径之一[4-7]。因此,穗部相关基因的克隆不仅在分子水平上阐明了水稻高产分子机理,也为开展基因聚合育种提供了优异基因资源,具有重大理论研究与实践利用价值[8-9]。
水稻产量构成因素,包括有效穗数、每穗粒数、结实率和千粒重等,均属于多基因控制的数量性状,易受环境的影响,基因型与环境的互作效应是影响穗部产量性状表现的重要因素之一,遗传基础十分复杂[5, 10-11]。关于水稻穗部性状基因的克隆和生物学功能研究前人已有报道,已初步定位的QTL较多,稳定表达的相对较少[5],其中仅有29个产量相关的穗粒QTL/基因被精细定位或克隆,其中,包括调控穗粒数的QTL/基因,如、/、、、、、、、等;控制籽粒大小的QTL/基因,如、、、、、、、、、、、、、、和等(http://www.gramene.org/, http://www.ricedata.cn/ gene/)。尽管在水稻产量相关性状分子机理方面已取得长足的进步,但有关穗部产量性状的遗传机理仍不甚清楚,一些精细定位或已克隆的高产基因在育种实践中难以得到广泛运用,诸多问题仍亟待解决,仍需对穗部产量性状相关基因及其分子调控机理进行深入的研究,发掘更多有益基因资源[5, 12-14]。
基于此,本研究以龙稻5号(粳型超级稻)和中优早8号(高产大穗籼稻)杂交衍生的RIL群体为试验材料,在海南、沈阳、南昌早季和南昌晚季4种不同的生态环境下对水稻穗部性状进行QTL分析,以期阐明不同环境下穗部性状的表达规律,发掘新的稳定表达的主效QTL位点,为水稻穗部性状遗传育种提供理论基础和基因资源。
1 材料与方法
1.1 试验材料与田间试验
试验材料为以粳型超级稻龙稻5号为母本和高产籼稻中优早8号为父本杂交衍生的重组自交系(RIL)群体,该群体包含180个F7株系。于2016年在海南(E1)、2016年在沈阳(E2)、2017年分早季(E3)和晚季(E4)在南昌进行试验。单苗栽插,每系3行,每行8株,E1、E3和E4环境下行株距为20.0 cm×16.5 cm,E2环境30.0 cm×13.3 cm,田间管理同当地大田栽培管理。
1.2 性状测定
成熟后在中间一行5穴取10个典型稻穗,分别测定穗部性状的8个参数指标,包括穗长、一次枝梗数、二次枝梗数、每穗颖花数、每穗实粒数和千粒重,计算结实率和着粒密度,2次重复,取均值统计分析。
1.3 遗传图谱构建
抽穗期采集亲本和RIL群体各家系的叶片,采用CTAB法提取基因组DNA。PCR扩增体系12 µL,包括DNA模板2.0 µL,10 μmol/L引物各1.5 µL,6 µL的2×EsMaster PCR混合体系,1.0 µL ddH2O。扩增程序如下: 94℃下4 min,94℃下45 s,55℃~58℃下45 s,72℃下45 s,32个循环;72℃下10 min,12℃下保存。PCR扩增产物用4%~5%的琼脂糖凝胶电泳检测。利用亲本间具有明显多态性的标记构建遗传图谱,遗传图谱包括223个分子标记(SSR、InDel和ILP标记),图谱覆盖基因组约1514.0 cM,标记间的平均距离为6.79 cM,平均每对染色体上的标记数为18.58。
1.4 QTL分析
采用QTL ICI Mapping 4.0的完备区间作图(ICIM)方法[15]进行加性效应、加性×加性上位互作效应QTL分析,LOD的阈值设为2.50(多环境下稳定表达时LOD值≥2.40),当实际求得的LOD值大于LOD阈值时,就判定该区段存在1个QTL,同时估算每个QTL的加性效应值和贡献率;同时应用ICIM-EPI进行上位性分析,LOD值为4.50。QTL的命名遵循McCouch等[16]的原则。
2 结果与分析
2.1 表型分析
不同生态环境下,粳型超级稻龙稻5号均表现出短穗、少分枝、穗粒少和高结实率,高产籼稻中优早8号均表现为大穗、多分枝、穗粒多和低结实的特点,除一次枝梗外,双亲穗部性状的7个指标均存在显著或极显著差异;不同株系间穗部性状各指标均存在较大幅度变异,呈现双向超亲分离,近似于连续的正态分布,这表明穗部性状均为多基因控制的数量性状,符合QTL作图的要求(表1)。
2.2 穗部性状相关性分析
不同种植环境下,RIL群体不同穗部性状间存在显著或极显著的相关性,多数性状间相关性在4个环境下方向一致,不同环境下相关系数存在明显变化。其中,穗长与一次枝梗、二次枝梗、每穗颖花数等性状间存在显著相关关系,但不同生态环境下存在明显变化;一次、二次枝梗与每穗颖花数、每穗实粒数和着粒密度间存在显著或极显著相关,一次、二次枝梗与千粒重存在负相关,相关性不显著;每穗颖花数、每穗实粒数、结实率和着粒密度间存在明显的相关关系,与千粒重相关性不显著;千粒重与着粒密度存在显著相关,不同环境下相关的方向性有所不同(表2)。表明穗部产量相关性状是复杂的性状,各性状间关系紧密,相互作用共同影响水稻产量;不同性状间相关系数和方向性受环境的影响,不同生态环境下存在一定变化。

表1 亲本和RIL群体穗部性状表型分析
*和**分别表示亲本间差异达0.05和0.01显著水平。E1−2016年, 海南; E2−2016年, 沈阳; E3−2017年, 南昌早季; E4−2017年, 南昌晚季。下同。
PL, Panicle length; PRBN, Primary rachis branch number; SRBN, Secondary rachis branch number; GN, Grain number; FGN, Filled grain number; SSR, Seed setting rate; SD, Seed density; TGW, Thousand grain weight;*and**represent significant differences between the parents at the 5% and 1% level, respectively. E1, Hainan(2016); E2, Shenyang(2016); E3, Nanchang(early season, 2017); E4Nanchang(late season, 2017). The same as below.
2.3 QTL分析
共检测到控制8个穗部性状的63个QTL(表3~4),四个环境下分别检测到27、27、18和35个,分布于第1、2、3、4、5、6、7、8、10、11和12染色体上,LOD值介于2.40~12.28,解释5.25%~22.00%的表型变异,其中12个QTL能在3个以上环境下被同时检测到,16个QTL能在2个环境下被重复检测到,其他35个QTL仅能在单一环境下被发现。
2.3.1 穗长
4个生态环境下共检测到7个调控穗长QTL(表3),分别位于第2、3、6、8和12染色体上,其中能在4个不同生态环境下被检测到,和能在两个环境下被重复检测到,其余5个QTL均只能在单一环境下被检测到;和表型贡献率和加性效应值均值较大。
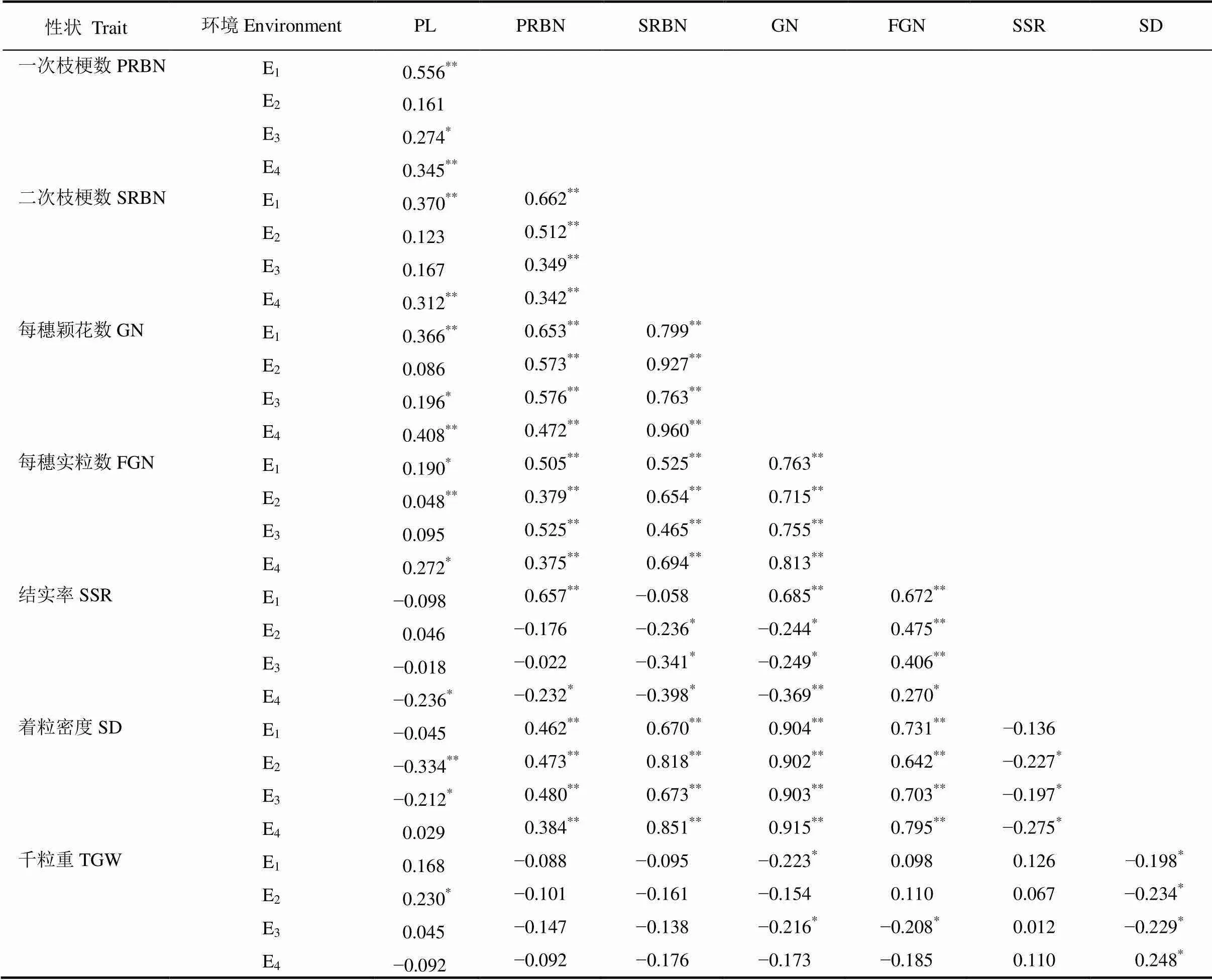
表2 不同生态环境下RILs群体穗部性状间的相关系数
*和**分别表示相关性达0.05和0.01显著水平。
*and**represent significant correlation at 5% and 1% levels, respectively.
2.3.2 一次枝梗数
共检测到11个一次枝梗数相关的QTL,分布于第1、3、4、6、7、8、10和11染色体上,四个生态环境分别检测到4、6、3和3个相关的QTL,其中和能在三个环境下被重复检测到,能在两个环境下被检测到,其他位点均仅在单一环境下被检测到(表3)。
2.3.3 二次枝梗数
控制二次枝梗数的QTL共有11个,分别位于第1、2、3、4、5、6、7、8和10染色体上,LOD值介于2.50~6.91,表型贡献率为5.33%~27.54%,其中和能在3个以上生态环境下检测到;和能在2个生态环境下被检测到,其余6个位点均仅在单一环境下被发现;和的效应明显,表型贡献率均值大于13.00%,前者增效等位基因来自中优早8号,后者增效等位基因来自于龙稻5号(表3)。
2.3.4 每穗颖花数
控制每穗颖花数的QTL有7个(表3),分别位于第1、2、3、4、6和10染色体上,不同生态环境分别检测到2、4、3和5个相关的QTL,其中能在4个环境中同时被检测到,和能在3个环境下被检测到,其他5个QTL仅能在单个环境下检测到,和效应值较大,贡献率均值超过12.00%,效应值均大于15粒/穗。
2.3.5 每穗实粒数
检测到8个调控每穗实粒数的QTL,分布于第1、4、5、6和10染色体上(表4),LOD值介于2.66~8.01,单一QTL解释5.85%~22.31%的表型变异,加性效应值为−16.90~14.55;、、和能在两个以上生态环境下被检测到,其他4个位点均仅在单一环境下表达。

表3 水稻穗部性状QTL
PEV, Percentage of explained phenotypic variation; Additive effect expressed in terms of estimated change in the phenotype. The same as below.
2.3.6 结实率
4个环境下共检测到3个影响结实率的QTL(表4),分别位于第2、3和4染色体上,仅有能在三不同环境下被检测到,其他QTL均只在沈阳被检测到;稳定表达的贡献率分布为15.74%、9.84%和11.46%,其增效等位基因均来自中优早8号。
2.3.7 着粒密度
4个环境下共检测到11个控制着粒密度的QTL(表4),三亚、沈阳、南昌早稻和南昌晚稻环境下分别检测到4、4、1和7个QTL,其中能在3个环境下被检测到,其贡献率和加效性值均较大,和能在2个环境下被检测到;、和能在两个不同环境下被检测到,其他7个QTL仅能在单以环境下检测到。
2.3.8 千粒重
控制千粒重的QTL共有5个(表4),分布于第3、4、5、8和11染色体上,不同生态环境下分别检测到3、2、3和2个相关的QTL,其中能在3个环境下被重复检测到,、和均能在两个生态环境下被检测到。
2.4 多效性区间分析
检测到穗部性状QTL具有明显的成簇分布现象,主要集中在第1、3、4、6和10染色体的6个区间(图1、表5)。其中,第1染色体的RM6902−RM259区间QTL簇,来自中优早8号的等位基因可增加一次枝梗数和二次支梗数,最终提高每穗颖花数、每穗实粒数和着粒密度,相关位点均能在多个环境下被检测到;第3染色体的ST3.3−STS3.6区间QTL簇,可同时增加穗长、一次枝梗数、二次枝梗数、每穗颖花数、每穗实粒数和结实率;位于第4染色体短臂RM5688−RM1359区间的,显著影响二次枝梗数和着粒密度,进而影响每穗颖花数、每穗实粒数、结实率和千粒重;位于第4染色体长臂RM13031−RM348区间的,显著影响一次枝梗数和着粒密度,进而影响二次枝梗数、每穗颖花数、每穗实粒数和结实率;位于第6染色体RM217−R6M14区间的,显著影响穗长,进而调控一次枝梗数、二次枝梗数、每穗颖花数、每穗实粒数和着粒密度;位于第10染色体RM1375− RM6737区间的,显著影响一次枝梗数和二次枝梗数,进而调控每穗颖花数、每穗实粒数和着粒密度。QTL成簇分布是一因多效或基因连锁引起,这也可以解释性状间的相关性。
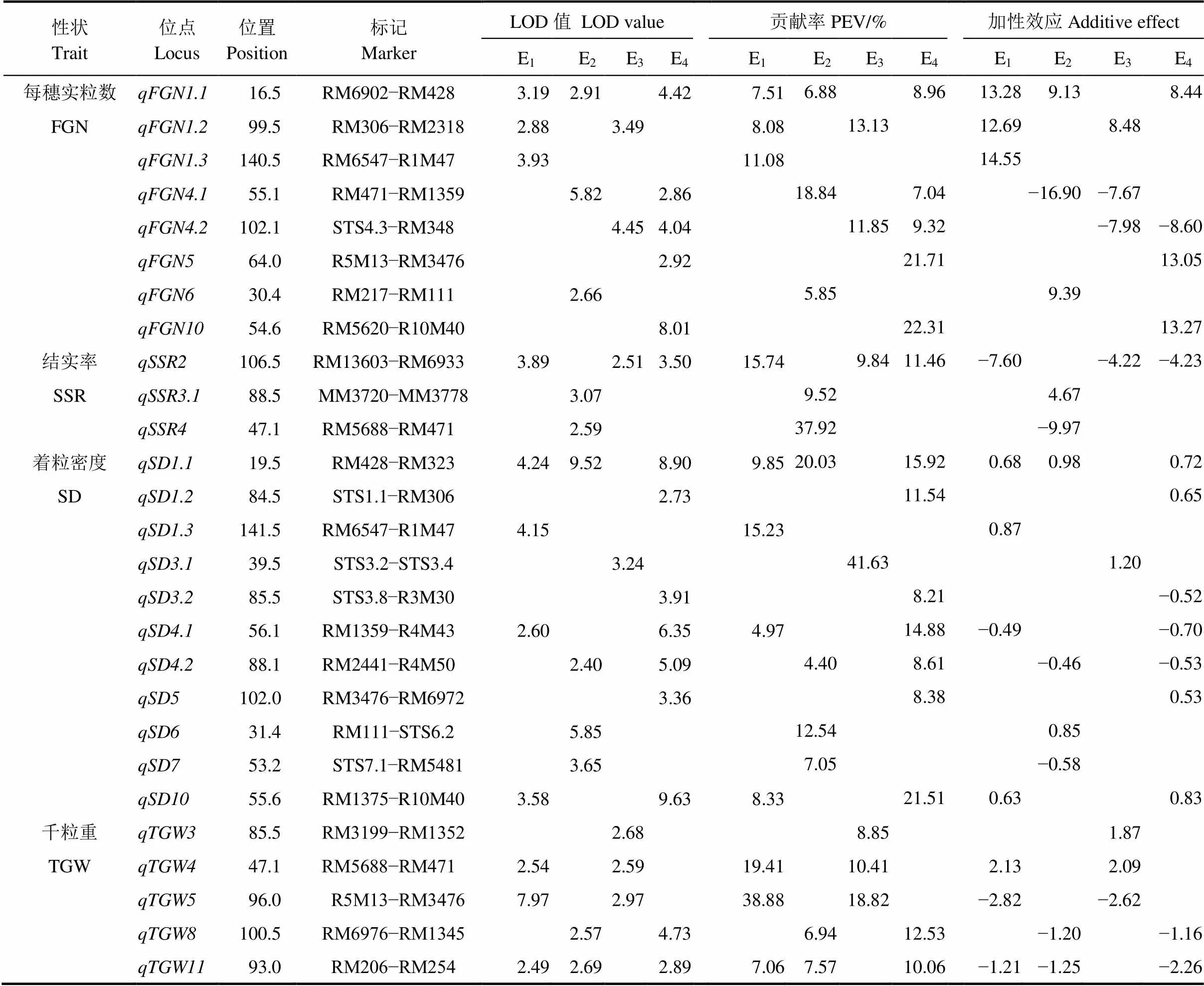
表4 水稻穗部性状QTL
2.5 上位性分析
ICIM-EPI模型检测穗部产量相关性状的上位性效应,共检测到37对上位性互作位点,分布于水稻12条染色体上(表6)。在穗长上,检测到5对互作位点,位于第1染色体RM259−RI02519区间与第1、10和12染色体存在明显的上位性互作效应,位于第4染色体RM5688−RM471区间与位于第1染色体的RM6547−R1M47区间能在不同环境下被检测到;一次枝梗性状共检测到10对上位性互作位点,位于第4染色体的RM5688−RM471和RM3648−RM1113区间与第1、7、12染色体相应区间存在明显的上位性互作效应;二次枝梗性状的上位性位点共有5对,分别位于第1、2、3、4、5和12染色体上,位于第1染色体RM259−RI02519区间和第4染色体RM5688−RM471和RM3648− RM1113区间的加性主效QTL具有明显的上位性效应;检测到3对调控每穗颖花数相关的位点,分别位于第1、3、7、9、11和12染色体上,3对位点间均存在明显的互作效应,其中位于第1染色体的STS1.2−RM7180的加性效应QTL能明显增加颖花数;仅检测到2对调控每穗实粒数的上位性效应位点,分别为第1与第2染色体,第4与第8染色体;共检测到8对调控结实率的上位性位点,位于第3、4、7和8染色体上的位点染色体对其他染色体区间存在明显的上位性效应;检测到3个调控着粒密度的上位性效应位点,上位性互作分别存在于第4染色体RM5688−RM471区间与第1染色体RM6547− R1M47、第2染色体STS2.4−RM13603区间和第7染色体RM1209−RM3555区间。这表明,上位性互作是调控水稻穗部产量性状的重要遗传组成,穗部产量性状的调控位点存在多个上位性互作,上位性可以存在于加性效应的QTL间互作,也可存在于加性效应的QTL与非加性效应位点间互作,此外,也可能存在于2个都非加性效应的位点间。

,和分别表示在单一,两个和三个以上生态环境下检测到的穗部产量性状QTL。
Fig. 1. Location of QTL detected for panicle traits in the RIL population.

表5 水稻穗部性状多效性区域分析
SNP−穗部籽粒相关性状;*表示稳定表达的多效性QTL簇。
SNP, Seed number of panicle; *represent the stable pleiotropic QTL cluster.
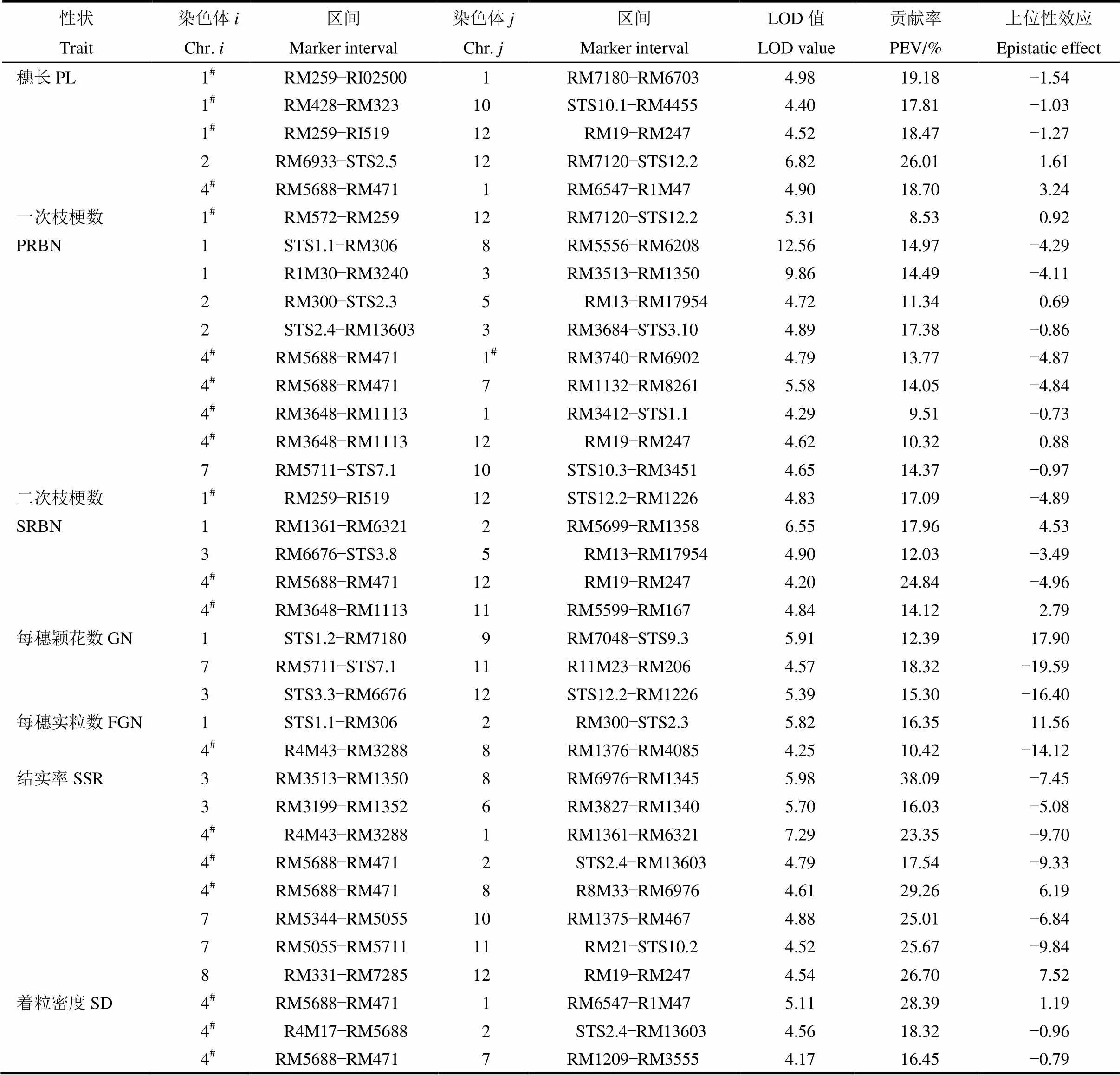
表6 水稻穗部性状QTL的加性×加性上位性互作分析
#表示上位性互作位点相应区间存在主效QTL。
#represents major QTL in this epistatic region.
3 讨论
水稻穗部性状主要包括穗长、枝梗数和穗粒数等,它们是构成稻穗的“基本骨架”,与产量密切相关。水稻穗部性状多属于数量性状,容易受到环境条件的影响,因此控制同一性状的QTL在不同环境或不同研究群体中的表达情况并不尽一致,同一研究群体在不同环境下QTL的检测结果也会有所差异[13, 17-19]。冯跃等[19]在不同氮条件下共检测到52个控制产量性状的QTL,仅有11个QTL在不同氮素环境下共位表达,而其他QTL均只在单一环境下被检测到;赵建国等[20]以泸恢99×日本晴杂交衍生的重组自交群体为试验材料,对穗部性状进行QTL定位,共检测到22个加性效应,其中2个QTL与环境发生明显互作;任春园等[21]以BIL群体为试验材料,不同年份环境下共检测到14个穗部性状的QTL,其中、、和在不同环境下稳定表达;胡大维等[11]在3个环境下共检测到74个加性效应的QTL,贡献率介于3.7%~ 43.2%,其中仅有和能在3个环境下均被检测到。由此可见, 控制水稻穗部性状的基因座具有较广泛的遗传多样性, 而且其遗传表达易受环境条件的影响。本研究以籼粳杂交衍生的RIL群体为试验材料,在海南、沈阳、南昌早季和晚季4种不同生态环境下对穗部性状进行QTL分析,共检测到控制8个穗部性状的63个QTL,分布于第1、2、3、4、5、6、7、8、10、11和12染色体上,四个环境下分别检测到27、27、18和35个QTL,其中12个QTL能在3个环境下被同时检测到,占总QTL的19.05%,16个QTL能在2个环境下被重复检测到,占总QTL的25.40%,其余QTL仅能在单一环境下被发现;3个以上生态环境下稳定表达的穗部性状的QTL分别为、、、、、、、、、、和。这表明尽管穗部性状是数量性状,受多个基因控制,但穗部性状也受效应较大并且稳定表达的QTL影响。这为我们今后利用分子标记辅助选择进行穗部性状的改良试验提供元件。
多效性是指同一染色体区间的QTL同时对多个性状产生作用,这种情况在作物中普遍存在。Guo等[22]研究表明产量各构成因子对产量均存在影响,不同构成因素对产量的影响存在极显著差异,其对应QTL位点存在部分遗传重叠;Cao等[23]对产量相关性状进行QTL分析,共检测到42个加性效应QTL,其中位于第3和7染色体产量性状与抽穗期的QTL存在明显重叠;占小登等[24]在不同环境条件下,共检测到32个调控生育期和产量相关性状的QTL,效应较大和稳定表达的QTL呈现成簇分布规律;佘东等[25]以CSSLs群体为试验材料对穗部性状进行QTL分析,共检测到26个QTL,其中第2、6和8染色体存在QTL簇能同时控制二次枝梗数、穗粒数和实粒数。与前人研究结果相似,本研究检测到的QTL存在明显的遗传重叠现象;检测到63个相关的QTL分布在26个染色体区段,位于第1、2、3、4、5、6和10染色体上的QTL成簇分布,7个区段上共包含37个相关QTL,占QTL总数的58.73%。位于第1、3、4和5染色体的多效性QTL簇能在不同环境下稳定表达,对穗部性状具有明显的调控作用。此外,本研究还检测到37对上位性互作位点,分布于所有12条染色体上,上位性互作是调控水稻穗部性状的重要遗传组成,上位性可存在于加性效应的QTL间,也可存在于加性效应的QTL间及非加性效应位点间互作,水稻穗部性状不仅由加性效应QTL决定, 还受非等位基因之间的互作或多重互作效应的位点影响, 穗部性状是一个受多位点调控的具有复杂性状,这与前人研究结果相似[25-27]。
有关穗部性状相关的QTL研究较多[10, 20, 24-35]。与前人研究结果比较发现,检测到的相似或相近位点较多;如位于第1染色体上RM428−RM323区间检测到的多效性QTL簇与相同,位于第5、6和10染色体上的多效性QTL簇与任春园等[21]和吴亚辉等[12]检测结果相近,在第4染色体上的RM13031−RM348区间的()与Kinoshita等[33]定位的和、Singh等[34]定位的QTL和Zhou等[35]精细定位的QTL所在染色体区间相近;而第3染色体STS3.3−STS3.6区间的(,,,,和)和第4染色体RM471−RM1359区间的(,,,,,和)是2个新的稳定表达的多效性QTL簇,主要通过调控穗长,影响一次枝梗数和二次枝梗数,最终影响每穗颖花数,主要通过调控二次枝梗数和二次枝梗粒数来调控穗粒性状。目前,我们正在对主效QTL和进行剖析,解析相关QTL对一次枝梗和二次枝梗的颖花数、实粒数、结实率与维管束性状的影响,并筛选和构建次级遗传群体对目标QTL进行精细定位和功能分析,有望获得进一步研究结果。
[1] 袁隆平. 超级杂交水稻育种研究的进展. 中国稻米, 2008, 14(1): 1-3
Yuan L P. Study development on breeding of super hybrid rice., 2008, 14(1): 1-3. (in Chinese)
[2] 方福平, 程式华. 论中国水稻生产能力. 中国水稻科学, 2009, 23(6): 539-566.
Fang F P, Cheng S H. Rice production capacity in China., 2009, 23(6): 539-566. (in Chinese with English abstract)
[3] 程式华, 曹立勇, 庄杰云, 吴伟明. 关于超级稻品种培育的资源和基因利用问题.中国水稻科学, 2009, 23(3): 223-228.
Cheng S H, Cao L Y, Zhuang J Y, Wu W M. Discussion on germplasm and gene utilization in breeding of super rice., 2009, 23(3): 223-228. (in Chinese with English abstract)
[4] 樊叶杨, 王凯, 庄杰云, 程式华. 水稻产量性状QTL的克隆研究及育种应用进展. 中国稻米, 2010, 16(6):1-5.
Fan Y Y, Wang K, Zhuang J Y, Cheng S H. Progress on cloning and utilization of QTL for yield traits in rice., 2010, 16(6): 1-5. (in Chinese)
[5] 黄勇, 胡勇, 傅向东, 邢永忠. 水稻产量性状的功能基因及其应用. 生命科学, 2016, 28(10): 1147-1155.
Huang Y, Hu Y, Fu X D, Xing Y Z. Functional genes for grain yield related traits and their application in rice breeding., 2016, 28(10): 1147-1155. (in Chinese with English abstract)
[6] Bai X F, Wu B, Xing Y Z. Yield-related QTLs and their applications in rice genetic improvement., 2012, 54(5): 300-311.
[7] Rao Y C, Li Y Y, Qian Q. Recent progress on molecular breeding of rice in China., 2014, 33(4): 551-564.
[8] Miura K, Ashikari M, Matsuoka M. The role of QTLs in the breeding of high-yielding rice., 2011, 16(6): 319-326.
[9] Guo L B, Ye G Y. Use of major quantitative trait loci to improve grain yield of rice., 2014, 21(2): 65-82.
[10] 姜树坤, 王嘉宇, 姜辉, 洛育, 孙世臣, 张喜娟, 白良明, 陈温福, 张凤鸣, 徐正进. 粳稻穗部结构性状的QTL分析. 植物生理学报, 2013, 49(12): 1347-1354
Jiang S K, Wang J Y, Jiang H, Luo Y, Sun S C, Zhang X J, Bai L M, Chen W F, Zhang F M, Xu Z J. Dissection of QTLs for panicle structure traits in rice (L. spp.)., 2013, 49(12): 1347-1354. (in Chinese with English abstract)
[11] 胡大维, 圣忠华, 陈炜, 李潜龙, 魏祥进, 邵高能, 焦桂爱, 王建龙, 胡培松, 谢黎虹, 唐绍清. 超级稻品种中嘉早17高产相关性状的QTL定位. 作物学报, 2017, 43(10): 1434-1447.
Hu D W, Sheng Z H, Chen W, Li Q L, Wei X J, Shao G N, Jiao G A, Wang J L, Hu P S, Xie L H, Tang S Q. Identification of QTLs associated with high yield of super rice variety Zhongjiazao 17., 2017, 43(10): 1434-1447.(in Chinese with English abstract)
[12] 吴亚辉, 陶星星, 肖武名, 郭涛, 刘永柱, 王慧, 陈志强. 水稻穗部性状的QTL分析. 作物学报, 2014, 40(2): 214-221.
Wu Y H, Tao X X, Xiao W M, Guo T, Liu Y Z, Wang H, Chen Z Q. Dissection of QTLs for panicle traits in rice ()., 2014, 40(2): 214-221. (in Chinese with English abstract)
[13] 姚晓云, 李清, 刘进, 姜树坤, 杨生龙, 王嘉宇, 徐正进. 不同环境下水稻株高和穗长的QTL分析. 中国农业科学, 2015, 48(3): 407-414.
Yao X Y, Li Q, Liu J, Jiang S K, Yang S L, Wang J Y, Xu Z J. Dissection of QTLs for plant height and panicle length traits in rice under different environment., 2015, 48(3): 407-414. (in Chinese with English abstract)
[14] 王小菁, 萧浪涛, 董爱武, 王台, 钱前, 漆小泉, 陈凡, 左建儒, 杨淑华, 顾红雅, 陈之端, 姜里文, 白永飞, 孔宏智, 种康. 2016年中国植物科学若干领域重要研究进展. 植物学报, 2017, 52(4): 394-452.
Wang X J, Xiao L T, Dong A W, Wang T, Qian Q, Qi X Q, Chen F, Zuo J R, Yang S H, Gu H Y, Chen Z D, Jiang L W, Bai Y F, Kong H Z, Chong K. Research advances in plant science in china in 2016., 2017, 52(4): 394-452. (in Chinese with English abstract)
[15] Wang J K, Li H H, Zhang L Y. QTL ICI Mapping V4.0[2014]. http://www.isbreeding.net.
[16] McCouch S R. Gene nomenclature system for rice., 2008, 1: 72-84.
[17] Bai X F, Luo L J, Yan W H, Mallikarjuna R K, Xing Y Z. Quantitative trait loci for rice yield-related traits using recombinant inbred lines derived from two diverse cultivars., 2011, 90(2): 209-215.
[18] Zhu J Y, Zhou Y, Liu Y H, Wang Z D, Tang Z X, Yi C D, Tang S Z, Gu M H, Liang G H. Fine mapping of a major QTL controlling panicle number in rice., 2011, 27(2): 171-180.
[19] 冯跃, 翟荣荣, 林泽川, 曹立勇, 魏兴华, 程式华. 不同供氮水平下水稻产量性状的QTL分析. 中国水稻科学, 2013, 27(6): 577-584.
Feng Y, Zhai R R, Lin Z C, Cao L Y, Wei X H, Cheng S H. QTL analysis for yield traits in rice under two nitrogen levels., 2013, 27(6): 577-584. (in Chinese with English abstract)
[20] 赵建国, 蒋开锋, 杨莉, 杨乾华, 万先齐, 曹应江, 游书梅, 罗婧, 张涛, 郑家奎. 水稻产量相关性状QTL定位. 中国水稻科学, 2013, 27(4): 344-352.
Zhao J G, Jiang K F, Yang L, Yang Q H, Wan X Q, Cao Y J, You S M, Luo J, Zhang T, Zheng J K. QTL mapping for yield related components in a RIL population of rice., 2013, 27(4): 344-352. (in Chinese with English abstract)
[21] 任春元, 范淑秀, 刘进, 朱琳, 杨绮文, 刘丹, 马殿荣, 王嘉宇. 不同年份水稻抽穗期和穗部性状QTL分析. 沈阳农业大学学报, 2017, 48(1): 78-83.
Ren C Y, Fan S X, Liu J, Zhu L, Yang Q W, Liu D, Ma D R, Wang J Y. QTL analysis for heading stage and panicle traits at different years in rice., 2017, 48(1): 78-83. (in Chinese with English abstract)
[22] Guo L B, Ye G Y. Use of major quantitative trait loci to improve grain yield of rice., 2014, 21(2): 65-82.
[23] Cao L Y, Wu J L, Fan Y Y, Cheng S H, Zhuang J Y. QTL analysis for heading date and yield traits using recombinant inbred lines ofrice grown in different cropping seasons., 2010, 129(6): 676-682.
[24] 占小登, 于萍, 林泽川, 陈代波, 沈希宏, 张迎信, 付君林, 程式华, 曹立勇. 利用大粒籼/小粒粳重组自交系定位水稻生育期及产量相关性状QTL. 中国水稻科学, 2014, 28(6): 570-580.
Zhan X D, Yu P, Lin Z C, Chen D B, Shen X H, Zhang Y X, Fu J L, Cheng S H, Cao L Y. QTL mapping of heading date and yield related traits in rice using a recombination inbred lines (RILs) population derived from BG1/XLJ., 2014, 28(6): 570-580. (in Chinese with English abstract)
[25] 佘东, 刘强明, 李大露, 梁银凤, 刘二宝, 党小景, 洪德林. 利用II-32B/A7444组合CSSL群体定位水稻7个穗部性状QTL. 作物学报, 2017, 43(5): 658-668.
She D, Liu Q M, Li D L, Ling Y F, Liu E B, Dang X J, Hong D L. Mapping QTLs for seven panicle traits in rice(L.) using chromosome segment substitution lines derived from II-32B/A7444., 2017, 43(5): 658-668. (in Chinese with English abstract)
[26] 赵芳明张桂权, 曾瑞珍, 杨正林, 凌英华, 桑贤春, 何光华. 利用单片段代换系研究水稻产量相关性状QTL加性及上位性效应. 作物学报, 2012, 38(11): 2007- 2014.
Zhao F M, Zhang G Q, Zeng R Z, Yang Z L, Ling Y H, Sang X C, He G H. Epistatic and additive effects of QTLs for yield-related traits using single segment substitution lines of rice (L.)., 2012, 38(11): 2007-2014. (in Chinese with English abstract)
[27] 李兴星, 郑剑, 周军杰, 秦小健, 南文斌, 杨永清, 张汉马, 李贤勇, 梁永书. 粳稻资源‘热粳35’重要农艺性状的QTLs定位. 植物生理学报, 2016, 52(8): 1176-1190.
Li X X, Zheng J, Zhou J J, Qin X J, Nan W B, Yang Y Q, Zhang H M, Li X Y, Ling Y S. Locating QTLs for important agronomic traits inrice ‘Rejing 35’., 2016, 52(8): 1176-1190. (in Chinese with English abstract)
[28] 韩保林, 顾朝剑, 张洪凯, 廖泳祥, 彭永彬, 张红宇, 徐培洲, 陈晓琼, 吴先军. 水稻穗部性状的QTL定位及上位性分析. 分子植物育种, 2017, 15(6): 2218- 2227.
Han B L, Gu C J, Zhang H K, Liao Y X, Peng Y B, Zhang H Y, Xu P Z, Chen X Q, Wu X J. QTL mapping and epistasis analysis for panicle traits in rice ().2017, 15(6): 2218-2227. (in Chinese with English abstract)
[29] 苏相文, 高方远, 曹墨菊, 任鄄胜, 陆贤军, 吴贤婷, 刘光春, 任光俊. 利用重组自交系剖析大穗型香稻保持系川香29B产量相关性状的遗传基础. 分子植物育种, 2015, 13(1): 39-50.
Su X W, Gao F Y, Cao M J, Ren J S, Lu X J, Wu X T, Liu G C, Ren G J. Genetic basis of the traits related to yield in rice maintainer line Chuanxiang 29B with large panicle and aroma using recombinant inbred lines., 2015, 13(1): 39-50. (in Chinese with English abstract)
[30] Peng Y L, Gao Z Y, Zhang B, Liu C L, Xu J, Ruan B P, Hu J, Dong G J, Guo L B, Liang G H, Qian Q. Fine mapping and candidate gene analysis of a major QTL for panicle structure in rice., 2014, 33(11): 1843-1850.
[31] 张应洲, 罗荣剑, 圣忠华, 焦桂爱, 唐绍清, 胡培松, 魏祥进. 日本晴/中嘉早17 重组自交系产量性状QTL定位. 中国农业科学, 2017, 50(19): 3640-3651.
Zhang Y Z, Luo R J, Sheng Z H, Jiao G A, Tang S Q, Hu P S, Wei X J. QTL mapping of yield associated traits of Nipponbare×Zhongjiazao 17 RIL population.2017, 50(19): 3640-3651. (in Chinese with English abstract)
[32] Liu T M, Mao D H, Zhang S P, Xu C G, Xing Y Z. Fine mapping, a QTL controlling the number of spikelets per panicle, to a BAC clone in rice (L.)., 2009, 118(8): 1509-1517.
[33] Kinoshita N, Kato M, Koyasaki K, Kawashima T, Nishimura T, Hirayama Y, Takamure I, Sato T, Kato K. Identification of quantitative trait loci for rice grain quality and yield-related traits in two closely relatedL. subsp. japonica cultivars grown near the northernmost limit for rice paddy cultivation., 2017, 67(3): 191-206.
[34] Singh V K, Ellur R K, Singh A K, Nagarajan M, Singh B D, Singh N K. Effect ofQTL for grain number per panicle in genetic backgrounds of twelve different mega varieties of rice., 2018, 11: 8.
[35] Zhou Y, Tao Y J, Yuan Y, Zhang Y Z, Miao J, Zhang R, Yi C D, Gon Z Y, Yang Z F, Liang G H. Characterisation of a novel quantitative trait locus,, for grain number and yield in rice (L.)., 2018, 131(3): 637-648.
Identification of QTL for Panicle Traits under Multiple Environments in Rice(L.)
LIU Jin1, 2, #, YAO Xiaoyun1, 2, #, LIU Dan3, YU Liqin1, LI Hui1, WANG Qi2, WANG Jiayu2, *, LI Maomao1, *
(Rice Research Institute, Jiangxi Academy of Agricultural Sciences/National Engineering Laboratory for Rice()/(),,;Rice Research Institute,,;Mudanjiang Branch of Heilongjiang Academy of Agricultural Sciences,*,:;)
【Objective】It is important to explore new panicle and grain traits QTL related to yield for further cloning and utilization of high yield genes. 【Method】A recombinant inbred line (RIL) population derived from the cross between Longdao 5 (super high-yielding) and Zhongyouzao 8 (typical) was used to identify QTL for panicle traits in multiple environments.【Result】Sixty-three QTLs were detected on chromosomes 1, 2, 3, 4, 5, 6, 7, 8, 10 and 12. Among them, 27, 27, 18 and 35 QTLs were detected in four ecological environments, respectively. Among these QTLs, 16 QTLs were detected in two environments, 12 QTLs were detected in more than three environments, namely 25.40% and 19.05% were stably and reliably detected across multi-environments. The QTLs with pleiotropic genetic overlap effect clustered on chromosomes 1, 3, 4 and 5 were detected in multi-environments, indicating they have significant effects on panicle traits. 【Conclusion】(STS3.3−STS3.6) on chromosome 3 and(RM5688−RM1359) on chromosome 4 may be two novel pleiotropic QTL clusterscontrolling panicle traits. In addition, epistatic effect plays an important role in the regulation of panicle traits.
rice(L.); environment; panicle traits; epistasis interaction
10.16819/j.1001-7216.2019.8100
Q343.1+5; S511.01
A
1001-7216(2019)02-0124-11
2018-09-03;
2018-11-19。
国家重点研发计划资助项目(2016YFD0100101-11);江西省青年科学基金资助项目(20171BAB214026);江西现代农业科研协同创新专项(JXXTCX201701-01);江西省农业科学院博士启动基金资助项目(20162CBS007)。

