基于TLR4-MyD88-TRAF6信号通路的儿茶素没食子酸酯抗小神经胶质细胞炎性损伤作用
刘 艳,张 懿,雷 锐,侯红英
(恩施土家族苗族自治州中心医院健康管理中心,恩施 445000)
早期研究证实较多慢性疾病的发生发展均与炎性反应相关,比如阿尔茨海默症、帕金森等神经变性疾病[1-2]。因此,降低中枢神经系统炎性因子水平对防治神经性疾病具有非常关键的作用,要求科研人员寻找较强抗炎活性的药物显得尤为重要。儿茶素没食子酸(EGCG)是一种天然黄烷醇型化合物,具有抗氧化应激及抗炎性反应的药理活性,能够透过血脑屏障,在大脑中发挥生物学效应[3-4]。过度的炎性反应会激活小神经胶质细胞,后者又会更进一步产生炎症因子,诱发神经变性疾病[5-6]。
研究已证实Toll样受体4(TLR4)可被脂多糖(LPS)激活而诱导炎性通路活化,而MyD88、TRAF6为TLR4信号通路的下游靶点,已成为近些年研究的热点[7-8]。有相关报道提示EGCG能通过抑制TLR4/NF-κB信号通路抑制LPS诱导的巨噬细胞炎性因子的释放[9]。因此,文章研究EGCG对小神经胶质细胞(BV-2)炎性损伤的保护作用,并探讨其对TLT4-MyD88-TRAF6信号通路活化的影响。
1 材料及方法
1.1 细胞 BV-2细胞购自武汉巴菲尔生物有限公司(来源于美国ATCC细胞库)。
1.2 药物及试剂 儿茶素没食子酸酯(成都普瑞法科技开发有限公司,批号:1257-08-5,纯度≥98%);DMEM培养基及胎牛血清均购自美国Gibco公司;胰蛋白酶购自美国Thermo scientific公司(批号:R001100);CCK8试剂盒购自北京智杰方远科技有限公司(批号:CK04);白介素-6(IL-6)、白介素-1β(IL-1β)及肿瘤坏死因子-α(TNF-α)ELISA 试剂盒购自上海恒远公司(批号分别为:WK20059,WK10034,WK20017);SDS-PAGE 凝胶配制试剂盒购自沈阳万类生物科技有限公司(批号:P0012AC);兔抗大鼠β-actin(货号ab108267)、一氧化氮合酶(iNOS)(货号 ab152104)、COX-2(货号 ab105217)、TLT4(货号 ab125364)、MyD88(货号 ab1562075)及TRAF6(货号ab1075248)一抗均购自英国Abcam公司;HRP标记山羊抗兔IgG二抗购自武汉谷歌生物有限公司。
1.3 仪器 BIORAD-550型酶标仪(美国伯乐公司);BBS-V800型单人超净台(山东鑫贝西公司);SPX-250型细胞培养箱(美国Thermo公司);GE-100型凝胶电泳仪(北京六一仪器厂);双色红外激光成像系统(BIO-RAD,美国)。
1.4 BV-2细胞培养 采用DMEM完全培养基培养,培养箱条件为37℃、5%CO2浓度,待细胞长满至95%左右时用磷酸盐缓冲液(PBS)清洗后加入胰酶消化,显微镜下观察待细胞变圆后加入培养基终止消化,分装于3个培养瓶进行传代培养。
1.5 分组及药物处理 将细胞分为正常对照组、LPS(1 mg/L)诱导组、LPS+低剂量(50 μmol/L)EGCG组、LPS+中剂量(100 μmol/L)EGCG 组、LPS+高剂量(200 μmol/L)EGCG组,LPS和EGCG处理细胞24 h后进行后续实验。
1.6 检测指标与方法
1.6.1 CCK8法 将对数生长期细胞进行消化重悬接种于96孔板,待细胞贴壁后吸去旧培养基,按“1.5”项分组及药物处理24 h后吸去旧培养基,然后每孔加入10 μL CCK8试剂,继续放置培养箱中孵育1.2 h后,置于酶标仪中测定每孔细胞的吸光度OD值,检测波长设置为450 nm。
1.6.2 酶联免疫吸附法(ELISA)实验 将对数生长期细胞进行消化重悬接种于6孔板,待细胞贴壁后吸去旧培养基,按“1.5”项分组及药物处理24 h后收集细胞及细胞上清,细胞上清用于炎性因子IL-6、IL-1β及TNF-α水平检测,其操作步骤严格按照说明书进行。
1.6.3 Western Blot 将“1.6.2”项收集的细胞裂解制备成匀浆,离心收集上清提取细胞蛋白。BCA法测定细胞总蛋白浓度。各孔取50 μg的蛋白上样,于12%聚丙烯酰胺凝胶电泳进行蛋白分离(浓缩胶70 mV 电压,40 min;分离胶 120 mV 电压,90 min)。将分离后的蛋白电转移(275 mA电流,90 min)至PVDF膜。加入5%脱脂奶粉封闭液于摇床上室温封闭1 h。用TBST洗膜3次,每次8 min,分别加入iNOS、COX-2、TLT4、MyD88 及 TRAF6 抗体(体积稀释比例均为1∶1 000)4℃反应过夜。次日先以TBST洗膜3次,每次10 min。后加入HRP标记的山羊抗兔IgG(体积稀释比例为1∶3 000),室温反应1 h。再用TBST洗膜3次,每次10 min。按ECL试剂盒说明进行显影。采用双色红外激光成像系统对蛋白条带灰度值进行分析。
1.7 统计学方法 采用SPSS 20.0软件进行统计分析,实验数据用均数±标准差(x±s)表示,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验,P<0.05为差异具有统计学意义。
2 结果
2.1 EGCG对BV-2细胞存活率的影响 BV-2细胞增殖情况见图1。与正常对照组相比,LPS诱导组细胞相对存活率明显降低(P<0.05);与 LPS 诱导组相比,各浓度EGCG组细胞相对存活率明显升高,差异均有显著性(P<0.05),并且随着 EGCG 浓度的升高,细胞相对存活率也随着增高,呈现出剂量依赖性。
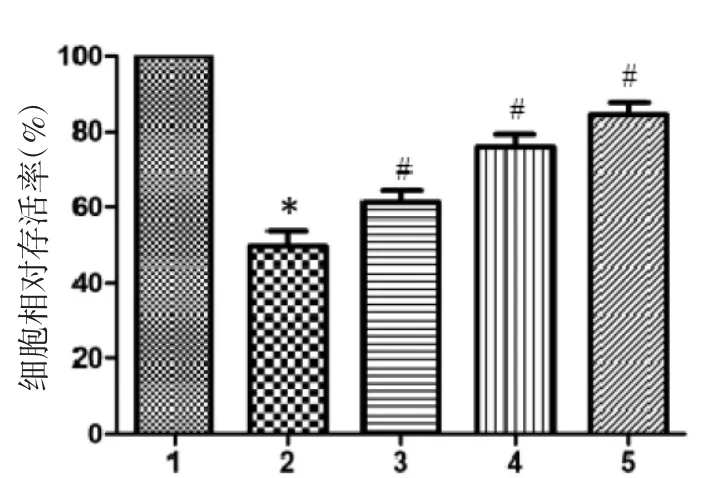
图1 不同组间BV-2细胞增殖情况比较Fig.1 Comparison of the proliferation of BV-2 cells in different groups
2.2 EGCG对BV-2细胞上清炎性因子水平的影响 BV-2细胞上清炎性因子水平见表1。与正常对照组比较,LPS诱导组细胞上清中IL-6、IL-1β及TNF-α 水平均显著升高(P<0.05);与 LPS诱导组相比,各浓度EGCG组细胞上清中IL-6、IL-1β及TNF-α水平均明显降低,差异均有显著性(P<0.05),并且随着EGCG浓度的升高,细胞上清炎性因子水平也随着降低,呈现出剂量依赖性。
表1 不同组间炎性因子水平的比较(x±s)Tab.1 Comparison of the inflammatory cytokines levels in different groups±s)pg/mL

表1 不同组间炎性因子水平的比较(x±s)Tab.1 Comparison of the inflammatory cytokines levels in different groups±s)pg/mL
注:与正常对照组比较,*P<0.05;与 LPS 诱导组比较,#P<0.05。
分组 IL-6 IL-1β TNF-α正常对照组 635.4±116.9 63.8±10.7 81.9±11.6 LPS 诱导组 1 805.7±322.7* 146.1±34.2* 198.4±36.8*LPS+低剂量 EGCG 组 1 413.9±267.3# 110.6±23.8# 147.6±25.7#LPS+中剂量 EGCG 组 998.2±205.2# 99.7±10.8# 121.4±14.1#LPS+高剂量 EGCG 组 717.6±128.7# 75.9±12.6# 93.8±14.9#
2.3 EGCG对BV-2细胞中炎性蛋白iNOS和COX-2表达的影响 BV-2细胞中炎性蛋白表达见图2。与正常对照组比较,LPS诱导组细胞中炎性蛋白 iNOS 和 COX-2 表达水平均显著升高(P<0.05);与LPS诱导组相比,各浓度EGCG组细胞中炎性蛋白iNOS和COX-2表达水平均明显降低,差异均有显著性(P<0.05),并且随着 EGCG 浓度的升高,细胞炎性蛋白iNOS和COX-2表达水平也随着降低,呈现出剂量依赖性。
2.4 EGCG对BV-2细胞中TLT4-MyD88-TRAF6信号通路的影响 BV-2细胞中TLT4、MyD88及TRAF6蛋白表达见图3。与正常对照组比较,LPS诱导组细胞中TLT4、MyD88及TRAF6蛋白表达水平均显著升高(P<0.05);与 LPS 诱导组相比,各浓度EGCG组细胞中TLT4、MyD88及TRAF6蛋白表达水平均明显降低,差异均有显著性(P<0.05),并且随着EGCG浓度的升高,细胞TLT4、MyD88及TRAF6蛋白表达水平也随着降低,呈现出剂量依赖性。说明EGCG能明显抑制BV-2细胞中TLT4-MyD88-TRAF6信号通路的活化。
3 讨论
EGCG属于中药单体中较多见的多酚类化合物,其临床药理作用较为广泛,主要用于防治心肌肥大及纤维化、诱导肿瘤细胞凋亡及迁徙、改善关节炎及增强糖尿病大鼠的肾功能[10]。除此之外,对EGCG临床应用的安全性评估发现,EGCG及其制剂引起的不良反应少见、代谢完全、在体内的残留极少,正是因为它的临床疗效显著及毒副作用低而促使了研究者对它的研发利用[11]。但是,其对神经炎症的抵抗作用研究甚少。本文便从抗炎角度出发研究了EGCG对LPS诱导BV-2细胞炎性损伤的影响,为后期的体内研究提供理论参考,为其开发为预防及治疗神经炎症所致中枢神经系统退行性疾病药物奠定基础。
LPS刺激BV-2细胞产生过量的炎性因子,主要通过激活该细胞膜上LTR4受体的活化,导致了神经炎症的发生发展。于是,降低BV-2细胞活化及炎性反应能够改善炎症环境、保护神经元炎性损伤。文章研究提示,EGCG能促使BV-2细胞的增殖、抑制炎性因子(IL-6、IL-1β 及 TNF-α)水平、降低炎性蛋白(iNOS及COX-2)表达,还影响细胞膜炎性受体TLR4的表达,说明EGCG可以预防或缓解中枢神经系统炎性损伤。

图2 不同组间炎性蛋白表达比较Fig.2 Comparison of the inflammatory proteins expression in different groups

图3 不同组间TLT4、MyD88及TRAF6蛋白表达比较Fig.3 Comparison of the TLT4,MyD88 and TRAF6 proteins expression in different groups
LTR4受体主要介导LPS诱导的炎性信号向胞内传导,在多种神经变性疾病发生发展中起着重要的作用[12]。其中髓样分化因子88(MyD88)依赖性途径及非依赖性途径是LTR4的下游信号通路;并且研究发现MyD88依赖性途径参与细胞内信号传导的分子包括IRAK及TRAF6等,主要介导NF-κB活化及细胞因子的产生[13]。并且早期报道EGCG能通过抑制TLR4/NF-κB信号通路抑制LPS诱导的巨噬细胞炎性因子的释放[9]。因此,本研究探讨了EGCG对LPS诱导TLT4-MyD88-TRAF6信号通路活化的影响。结果发现EGCG能显著抑制BV-2细胞中TLT4、MyD88及TRAF6蛋白的表达,进一步降低了LPS诱导的BV-2炎性损伤。综上所述,EGCG通过抑制TLT4-MyD88-TRAF6信号通路活化而影响IL-6、IL-1β及TNF-α等炎性因子的过度表达,而有效保护LPS所致神经元损伤发挥抗炎作用。