miR-221通过调节PTEN影响肺癌细胞对吉非替尼的耐药性*
郑礼平,陈艺丹,张 楠,全 文,梁翠微,龚五星
(珠海市人民医院, 暨南大学附属珠海医院肿瘤科, 广东 珠海 519000)
肺癌目前是我国常见的恶性肿瘤,其发病率和死亡率都占恶性肿瘤的首位,严重威胁人民健康[1]。非小细胞肺癌(non-small-cell lung cancer,NSCLC)占肺癌总数的85%左右,而大部分患者确诊时已是晚期,无法行根治性手术切除。表皮生长因子受体酪氨酸激酶抑制剂(epidermal growth factor receptor-tyrosine kinase inhibitor,EGFR-TKI),如吉非替尼和厄洛替尼等,因为有疗效确切、不良反应轻微、口服给药方便等优点,已成为晚期NSCLC极其重要的治疗手段,但在10~11个月的无进展生存后,患者会对EGFR-TKI产生耐药[2-3]。
微小RNA(microRNA,miRNA,miR)是一组进化保守的内源性非编码小分子RNA,能在转录后水平负性调控基因的表达。大量研究已证实,miRNA在肿瘤细胞产生耐药性的过程中发挥着重要的作用[4-5]。miR-221参与了肿瘤的发生,我们前期研究也证实miR-221能够促进肺癌A549细胞增殖[6]。但miR-221是否会影响NSCLC 对EGFR-TKI的耐药,目前还没有报道。因此本研究将miR-221抑制物转染至吉非替尼耐药细胞株PC9/GR中,观察其对细胞耐药性的影响,并探讨具体的作用机制,为肺癌新的治疗方法提供实验基础。
材 料 和 方 法
1 材料和试剂
人肺腺癌细胞PC9/GR(吉非替尼耐药细胞) 和PC9 (吉非替尼敏感细胞)由本实验室保存。吉非替尼(gefitinib, 商品名:易瑞沙)购自AstraZeneca;RPMI-1640培养基和胎牛血清购自Gibco;抗人第10号染色体缺失的磷酸酶及张力蛋白同源物(phosphatase and tensin homologue deleted on chromosome ten, PTEN)抗体购自Abcam; miR-221 inhibitor和miR-NC购自上海吉玛制药;CCK-8试剂购自日本同仁化学研究所;RNA提取试剂TRIzol和脂质体LipofectamineTM2000购自Invitrogen;辣根过氧化物酶标记的抗兔、抗鼠II抗均购自武汉博士德公司;双萤光素酶检测试剂盒购自Promega。
2 方法
2.1细胞培养及转染 肺癌PC9/GR细胞和PC9细胞在含10%胎牛血清的RPMI-1640培养基中培养,放置于37 ℃、5% CO2和相对湿度95%的恒温培养箱中。当细胞生长至约90%融合时,用胰酶消化细胞,吹打为单细胞悬液后进行离心,后使用RPMI-1640培养基进行稀释,制成5×108/L的悬液。将PC9/GR细胞转种在6孔板中,置于培养箱中培养24 h,在细胞融合80%~90%时转染,在转染前2 h更换成未含血清的新鲜培养基,将细胞分为:实验(miR-221 inhibitor)组,转染miR-221 inhibitor;对照(control)组,转染miR-NC;空白(blank)组,单用无血清培养基培养。转染过程按照LipofectamineTM2000转染试剂盒说明书进行,转染24~48 h后收集细胞进行各项指标检测。
2.2RT-qPCR检测细胞中miR-221的表达 收集细胞,采用TRIzol法提取各组细胞的总RNA,后用紫外分光光度计来检测RNA的浓度和纯度,控制A260/A280于1.8~2.0之间。依照RT-qPCR试剂盒提供的操作说明合成cDNA。扩增反应条件设置为:95 ℃预变性30 s; 95 ℃变性5 s、55 ℃延伸20 s、最后72 ℃退火20 s,40个循环。U6为内参照。标本重复检测3次,使用2-ΔΔCt法来分析计算。miR-221的上游引物序列为5’-CAGCATACATGATTCCTTGTGA-3’,下游引物序列为5’-CTTTGGTGTTTGAGATGTTTGG-3’;U6的上游引物序列为5’-CTCGCTTCGGCAGCACA-3’,下游引物序列为:5’-AACGCTTCACGAATTTGCGT-3’。
2.3CCK-8法检测肺癌细胞对吉非替尼的敏感性 将各组细胞接种于96孔板内,每孔1 000个细胞,置于37 ℃、5% CO2的培养箱中培养24 h,在细胞贴壁后加入不同浓度的吉非替尼,设置7个呈2倍递增梯度的浓度(1~64 μmol/L),对照孔则不加药物,每个药物浓度设平行重复6孔。继续培养48 h后,往每孔加入10 μL CCK-8试剂,37 ℃继续孵育2 h。然后在酶标仪上采用450 nm波长测量各孔的吸光度(A)。重复进行实验3次。计算细胞存活率:存活率(%)=实验孔A值/对照孔A值×100%。根据细胞存活率计算出吉非替尼的半数抑制浓度(the half-maximal inhibitory concentration,IC50)。
2.4Western blot检测PTEN蛋白的表达 收集各组细胞,用RIPA细胞裂解液提取蛋白质样品,用BCA法测定总蛋白浓度。取样品蛋白50 μg,然后用SDS-PAGE进行分离,后转移蛋白至PVDF膜,用5%脱脂奶粉室温封闭1 h;加抗PTEN抗体及GAPDH抗体,4 ℃摇床孵育过夜;次日在室温下用TBST液漂洗3次;同样方法稀释 II 抗,室温孵育1 h,TBST漂洗3次,最后用ECL发光试剂盒发光、显影及分析。
2.5双萤光素酶报告基因检测 首先合成PTEN 3’-UTR序列片段以及突变的3’-UTR序列片段,其中PTEN 3’-UTR序列片段能和miR-221相应序列互补结合,然后克隆这2个片段到pGL3-Luciferase基因下游多克隆位点上。肺癌PC9/GR细胞按4×108/L接种在6孔板中。用LipofectamineTM2000将萤光素酶报告载体与miR-221 inhibitor及miR-NC进行共转染。转染48 h后收集细胞,根据Promega公司双萤光素酶报告基因进行相应检测。
3 统计学处理
使用SPSS 19.0统计软件进行数据分析。实验数据用均数±标准差(mean±SD)表示。两组间均数比较采用独立样本t检验;多组间比较采用单因素方差分析(one-way ANOVA),两两比较采用Bonferroni校正的t检验。以P<0.05为差异有统计学意义。
结 果
1 miR-221在肺癌细胞中的表达
RT-qPCR结果显示,PC9/GR细胞中的miR-221表达量明显高于PC9细胞(P<0.01),见图1。转染miR-221 inhibitor能够显著降低PC9/GR细胞中miR-221的表达,实验组miR-221表达量较对照组明显减少(P<0.01);对照组和空白组间miR-221含量的差异无统计学显著性,见图2。
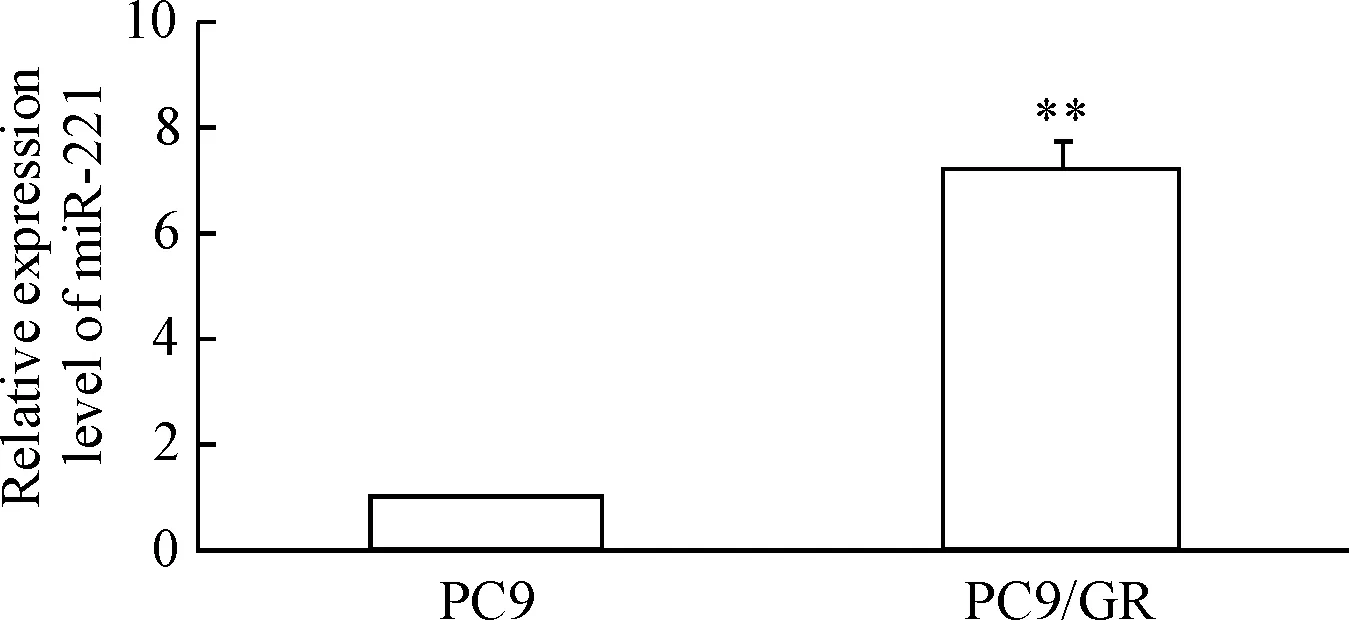
Figure 1.The expression levels of miR-221 in the lung cancer PC9 cells and PC9/GR cells. Mean±SD.n=3.**P<0.01vsPC9 cells.
图1肺癌PC9细胞和PC9/GR细胞中miR-221的表达
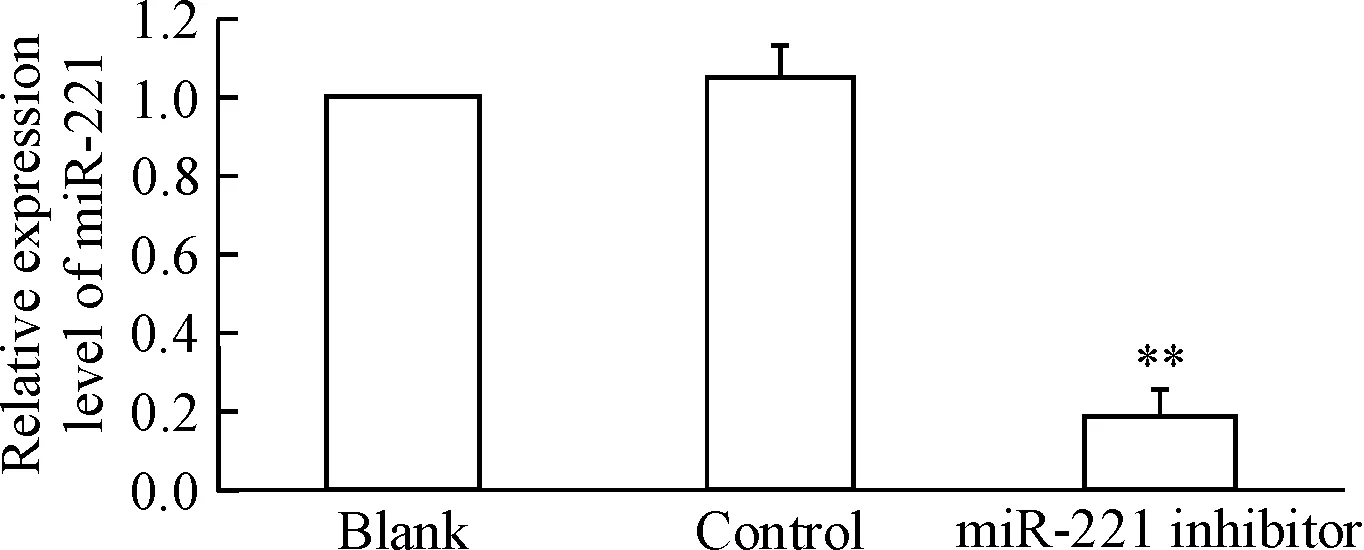
Figure 2.The expression level of miR-221 in the PC9/GR cells transfected with miR-221 inhibitor. Mean±SD.n=3.**P<0.01vsblank group.
图2肺癌PC9/GR细胞转染miR-221inhibitor后miR-221的表达
2 PC9/GR细胞转染miR-221 inhibitor后对吉非替尼耐药性的变化
实验组细胞的存活率低于对照组(P<0.05),见图3。吉非替尼对实验组、对照组和空白组细胞的IC50分别是(4.65±0.48)μmol/L、(15.78±0.78)μmol/L和(14.54±0.85)μmol/L,实验组细胞对吉非替尼的耐药性明显低于对照组(P<0.01),见图4。
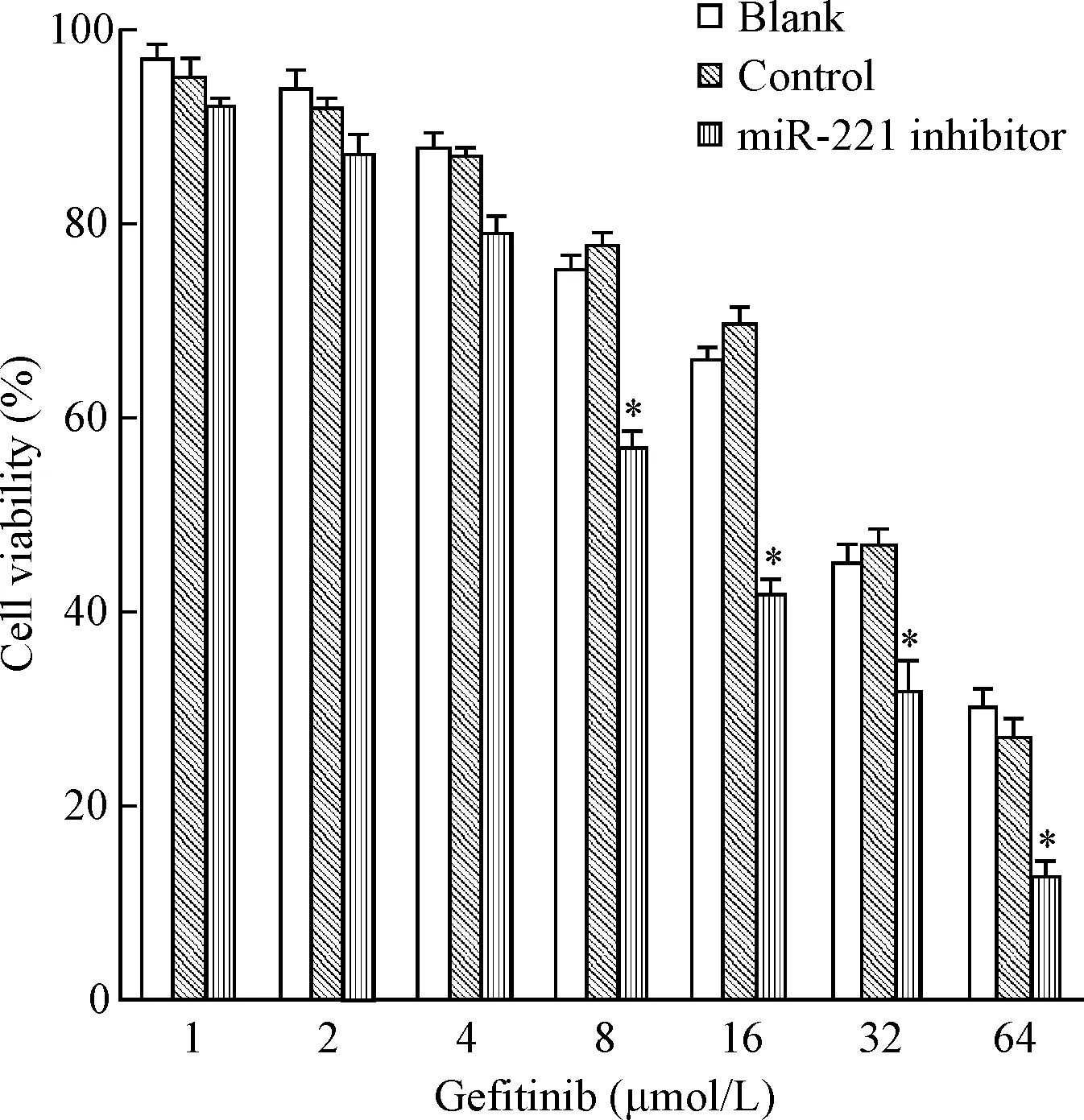
Figure 3.The viability of PC9/GR cells treated with gefitinib for 48 h. Mean±SD.n=3.*P<0.05vsblank group.
图3吉非替尼处理48h后PC9/GR细胞的存活率
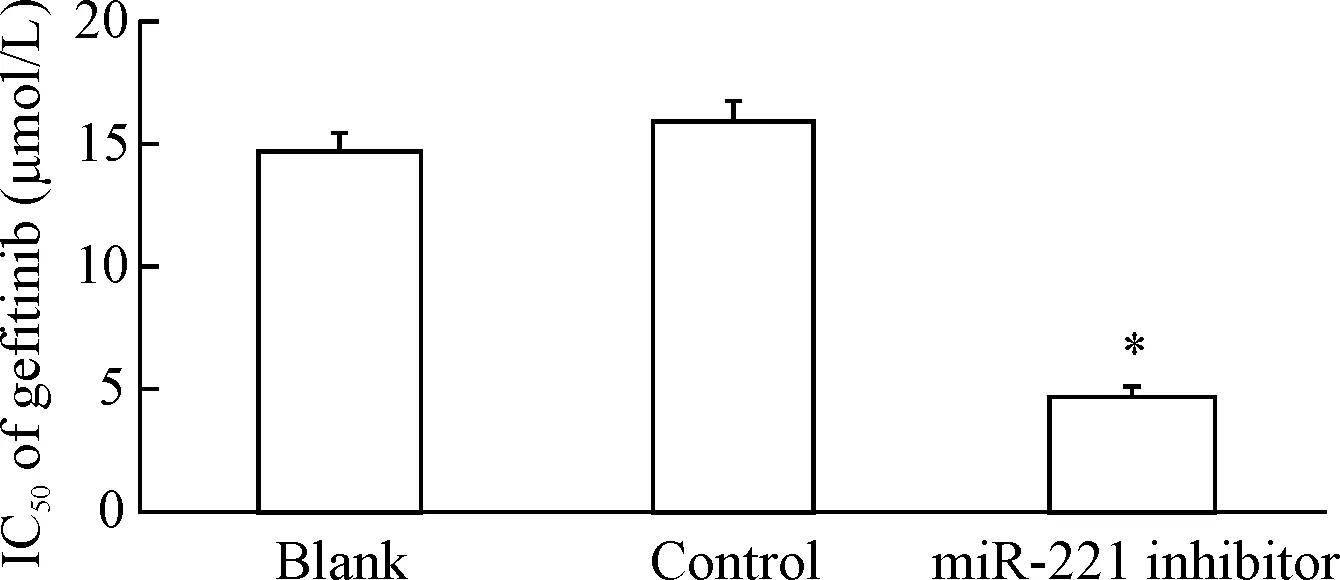
Figure 4.The IC50of gefitinib for PC9/GR cells after gefitinib treatment for 48 h. Mean±SD.n=3.*P<0.05vsblank group.
图4吉非替尼处理48h后PC9/GR的IC50
3 Western blot检测PTEN蛋白的表达
与PC9细胞相比,PC9/GR细胞中的PTEN蛋白表达量明显下降(P<0.05),见图5。转染miR-221 inhibitor能够显著增加PC9/GR细胞中PETN的表达, Western blot显示实验组的PTEN蛋白水平较对照组和空白组升高(P<0.05),见图6。
4 PTEN是miR-221的下游靶基因
通过生物信息学软件TargetScan预测miR-221的靶基因,提示PTEN可能是其下游作用基因。双萤光素酶报告基因结果显示,含野生型PTEN的 3’-UTR序列细胞中,转染miR-221 inhibitor后萤光素酶活性较对照组和空白组明显增强(P<0.05);而含突变型PTEN的3’-UTR序列细胞中,3组的萤光素酶活性的差异无统计学显著性,见图 7。
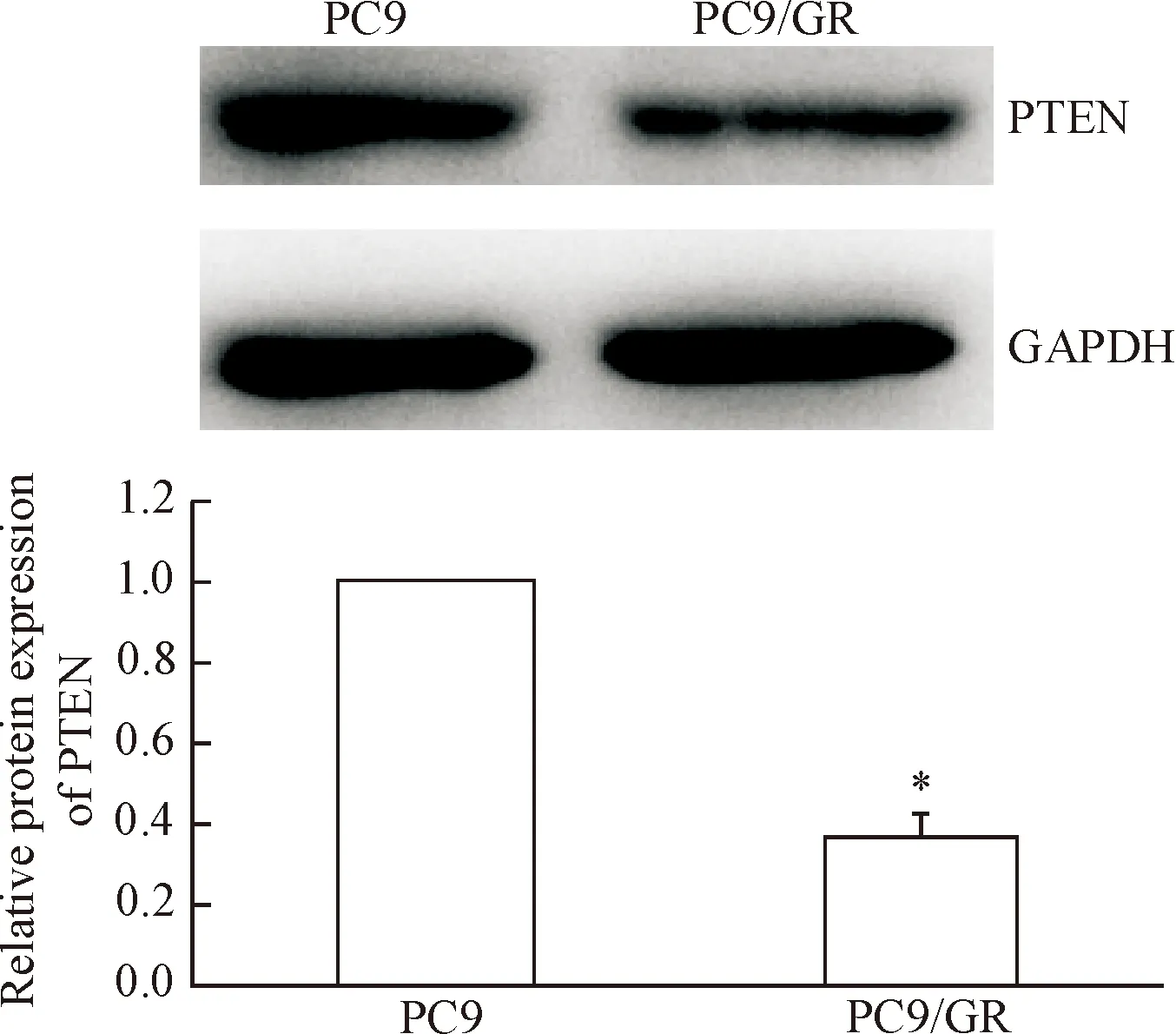
Figure 5.The relative protein expression of PTEN in the lung cancer PC9 cells and PC9/GR cells. Mean±SD.n=3.*P<0.05vsPC9 cells.
图5肺癌PC9和PC9/GR细胞中PTEN的表达
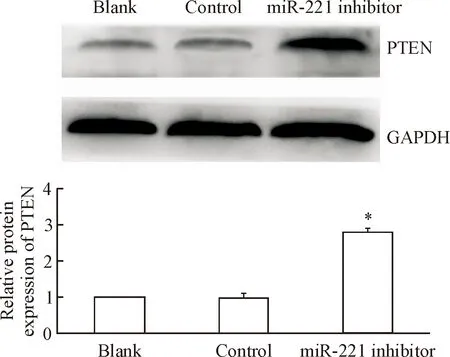
Figure 6.The relative protein expression of PTEN in the lung cancer PC9/GR cells transfected with miR-221 inhibitor. Mean±SD.n=3.*P<0.05vsblank group.
图6转染miR-221inhibitor后PC9/GR细胞的PTEN表达
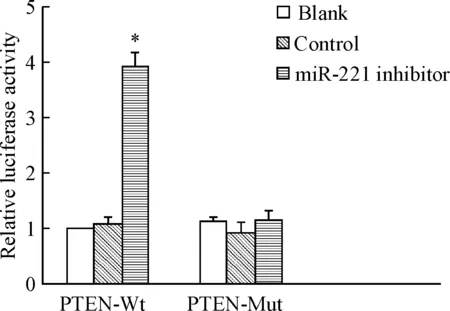
Figure 7.The role of miR-221 in the targeting sequence of PTEN evaluated by detecting the activity of luciferase. Mean±SD.n=3.*P<0.05vsblank group.
图7萤光素酶活性检测miR-221对PTEN靶序列的作用
讨 论
我国以及亚裔人群肺腺癌患者的EGFR基因敏感突变阳性率可高达40%~50%左右[7]。国内外多个已发表的研究证实EGFR-TKI药物极大地改善和延长携带这些驱动基因的NSCLC患者的预后以及生存[8-9],但患者最终会出现TKI耐药,导致疾病进展,这无疑限制了TKI药物的进一步发展。获得性耐药的部分机制已清楚,包括EGFR激酶第二位点突变(T790M突变等)、组织转化(上皮间质转化、小细胞转化)等,但还有很多的机制需要进一步研究。
miRNA是一类长约19~25个核苷酸的非编码小RNA,其广泛存在于真核生物体内。miRNA通过与靶基因信使RNA特异性结合进而诱导其降解或抑制其翻译,引起靶蛋白的表达水平发生变化,从而调控下游的信号通路,在肿瘤的发生、发展和耐药等方面发挥了重要作用[4-5, 10]。miR-221定位于X染色体P11.3区约1 kb的区域内,属于成簇分布的miRNA。miR-221 在前列腺癌、结直肠癌和肝癌等多种肿瘤中表达上调,扮演了“癌基因”的角色[11-13]。最近许多研究发现miR-221能影响肿瘤对抗癌药物的耐药性。在脑胶质瘤中,miR-221通过调控PI3K/Akt信号通路增强了癌细胞对卡莫司汀的耐药性[14]。在乳腺癌MCF7细胞中转染miR-221后,会增加肿瘤细胞对氟维司群的耐药程度[15]。
本课题组前期研究证实,miR-221在肺癌组织中高表达,转染miR-221 mimics后能促进肺癌A549细胞增殖[6]。RT-qPCR结果显示,PC9/GR细胞中的miR-221表达量是PC9细胞的7.15倍,说明miR-221对肺癌细胞吉非替尼耐药可能起到重要作用。在PC9/GR细胞中转染miR-221 inhibitor能降低肺癌细胞对吉非替尼的耐药程度。通过使用TargetScan靶基因预测软件及结合发表的文献,我们发现PTEN可能是miR-221的直接靶标。研究发现在人脑胶质瘤中PTEN表达的下降会增强癌细胞对卡莫司汀的耐药性[16]。Kim等[17]对129例胃癌患者进行分析发现使用曲妥珠治疗4个月内就出现进展的患者,其PTEN的表达水平较那些疗效很好的患者明显减少,多变量分析证实PTEN表达缺失是曲妥珠耐药的独立预测因子。本研究发现PC9/GR细胞中PTEN表达较PC9明显减少;抑制PC9/GR细胞中miR-221表达后PTEN的表达会显著升高;而且双萤光素酶报告基因进一步确定了PTEN为miR-221的下游靶基因。
综上所述,miR-221可能通过靶基因PTEN来调控肺腺癌PC9/GR细胞对吉非替尼的耐药性,有望为肺癌的治疗提供可能的作用靶点。

