p75神经营养素受体在胃癌组织中的表达及其对胃癌细胞侵袭的影响
董胜肖,靳海峰#,陈连刚,刘爽,刘惠敏,刘文格,刘贞
解放军白求恩国际和平医院1消化内科,2呼吸科,3肿瘤科,4病理科,石家庄 0500820
p75神经营养素受体(neurotrophin receptor,NTR)是由399个氨基酸组成的I型细胞跨膜糖蛋白,其分布较为广泛,表达于多种细胞的表面,如中枢神经系统的神经元和免疫系统的中性粒细胞、T淋巴细胞、B淋巴细胞等[1]。目前,关于p75NTR在肿瘤细胞恶性生物学行为中的作用尚存在争议。国外有研究显示,p75NTR具有类抑癌基因的活性,可以通过抑制肿瘤细胞的增殖和诱导肿瘤细胞的凋亡,从而抑制膀胱癌和前列腺癌的生长[2-3]。但是,国内也有研究认为,p75NTR可以促进喉癌细胞的增殖活性,并且与喉癌的发生、发展、转移、分化等密切相关[4]。本研究探讨了p75NTR在胃癌组织中的表达情况及其对胃癌细胞侵袭能力的影响,并分析其在胃癌转移中的作用,旨在为临床胃癌靶向治疗药物的研发提供新的思路,现报道如下。
1 材料与方法
1.1 标本收集
收集2015年10月至2016年8月于解放军白求恩国际和平医院行手术切除的胃癌患者的胃癌组织标本及其相应的癌旁(距肿瘤组织边缘≥5 cm)正常组织标本。纳入标准:①均经病理组织学检查确诊为胃癌;②胃癌组织及癌旁正常组织标本均来源于手术后;③术前均未行放化疗;④临床资料完整;⑤存在明确的TNM分期和组织分化程度。排除标准:①转移性胃癌;②有肿瘤相关治疗史。根据纳入、排除标准,本研究共选取80例胃癌患者的胃癌组织(每例患者仅取一份病理组织)标本和相应的80例癌旁正常组织标本。80例胃癌患者中,男49例,女31例;年龄为22~78岁,平均年龄为(59.18±10.64)岁;组织分化程度:中+高分化56例,低+未分化24例;TNM分期按照国际抗癌联盟(Union for International Cancer Control,UICC)和美国癌症联合委员会(American Joint Committee on Cancer,AJCC)颁布的第7版胃癌分期标准[5]进行分期:I期11例,Ⅱ期27例,Ⅲ期34例,Ⅳ期8例。
1.2 细胞、试剂与仪器
利用胃癌患者的活检组织进行体外细胞培养,获得胃癌细胞株。免疫组化SP试剂盒和二氨基联苯胺(diaminobenzidine,DAB)显色试剂盒均购自北京中杉金桥生物技术有限公司,胎牛血清、RPMI1640培养基、0.25%胰蛋白酶、脂质体LipofectamineTM2000转染试剂盒均购自美国Invitrogen公司,ECL Western blot检测试剂盒购自美国Amersham公司,超净工作台购自赛默飞世尔科技(中国)有限公司,CO2培养箱购自上海乔跃电子科技有限公司,核酸蛋白检测仪购自上海嘉鹏科技有限公司,光学显微镜购自日本Nikon公司,电转移仪购自美国Bio-Rad公司,质粒抽提试剂盒购自美国Promega公司,总RNA提取试剂、逆转录试剂盒、实时荧光聚合酶链反应(real time-polymerase chain reaction,RT-PCR)特异性定量引物、内参均购自大连Takara公司。
1.3 实验方法
1.3.1 细胞培养 在无菌条件下,取新鲜的胃癌组织标本放入离心管,保存于4℃温度下。将切成碎块的胃癌组织置于无菌培养皿中,加入2 ml 0.25%胰蛋白酶,孵育30 min,经200目筛网过滤后获得单细胞悬液,加入红细胞裂解液,裂解细胞;1000 r/min离心5 min,离心半径为19 cm,弃除上清液,加入含10%胎牛血清的完全培养基重悬,将细胞置于37℃、5%CO2的细胞培养箱中培养。24~48 h更换培养液,48 h传代1次。
1.3.2 免疫组织化学染色法 取石蜡包埋组织进行切片,切片厚度为1~2 μm,严格按照免疫组化SP试剂盒说明书的步骤进行操作。每个切片随机选择10个视野,观察p75NTR的阳性表达情况。p75NTR阳性判断标准:以细胞膜和细胞质呈棕黄色颗粒判定为p75NTR阳性表达。①染色强度评分标准:无着色为0分,浅黄色为1分,棕黄色为2分,棕褐色为3分;计算10个视野下的染色平均分值。②阳性细胞所占百分比评分标准:0分,阳性细胞所占百分比为0;1分,阳性细胞所占百分比为1%~10%;2分,阳性细胞所占百分比为11%~50%;3分,阳性细胞所占百分比为51%~75%;4分,阳性细胞所占百分比>75%。根据染色指数判定染色结果,染色指数=阳性细胞所占百分比评分×细胞染色强度评分;其中,染色指数为0~1分为p75NTR阴性表达,染色指数≥2分为p75NTR阳性表达[6]。
1.3.3 细胞转染及分组 ①构建慢病毒干扰载体:从GenBank中获得编码人p75NTR基因(NM-003483)的序列;选择pGMLV-绿色荧光蛋白基因(green fluorescence protein gene,GFP)慢病毒载体,构建慢病毒重组质粒,并转染至感受态细胞DH5α中。采用质粒抽提试剂盒提取慢病毒重组质粒和包装质粒,并转染至293T细胞中,测定慢病毒滴度。②建立p75NTR基因过表达稳定细胞系:提前1天在相应备行转染的6孔板上接种5×105个细胞,培养24 h后,待细胞融合度达50%~60%时,严格按照脂质体转染说明书的步骤将p75NTR序列或无序序列转染至细胞,置于37℃、5%CO2的细胞培养箱中培养24~48 h。提取细胞RNA及蛋白,验证目的基因的表达情况及转染效率。将胃癌细胞分为两组:阴性对照(NC)组(转染无序序列)和p75NTR转染组(转染p75NTR序列)。
1.3.4 RT-PCR检测细胞中p75NTRmRNA的表达情况 按照总RNA提取试剂操作说明提取胃癌细胞的总RNA。以上述提取的总RNA中的mRNA作为模板,按照mRNA逆转录说明书将所提取的mRNA逆转录为cDNA,保存于-20℃的条件中备用。将25 μl反应体系(Taq Mix22 μl+cDNA模板1 μl+上下游引物各1 μl)按程序扩增:95 ℃ 3 min预变性;95℃ 30 s变性,60℃ 30 s退火(U6、p75NTR退火温度分别为60℃、57.8℃),72℃5 min延伸,共40个循环。以U6作为内参,进行RT-PCR检测。U6上游引物为5'-TGGCGATGGCAGTGTCTTAG-3',下游引物为5'-GTGCAGGGTCCGAGGT-3';p75NTR上游引物为5'-CAGCTTTGAGGTTCGTGTTTGT-3', 下 游 引 物 为 5'-ATGCTCTTCTTTTTTGCGGAAA-3'。实验重复3次。根据荧光定量PCR仪的使用说明调整基线,将阈值设定在荧光值对数图的线性部分,从软件中读取Ct值。ΔCt=样品Ct均值-内参Ct均值,ΔΔCt=ΔCt-(随机阴性对照样品Ct均值-内参Ct均值),应用2-ΔΔCt法计算目的基因mRNA的相对表达量。
1.3.5 Transwell小室检测细胞的侵袭能力 将诱导分化后的胃癌原代细胞(每孔1×105个细胞)100 μl单层接种至Transwell上层小室内,加入不含血清的RPMI1640培养基;下室加入600 μl含10%胎牛血清的RPMI1640培养液;将Transwell小室置于37℃、5%CO2的培养箱中培养48 h。于下室中加入足量的甲醛固定液,结晶紫染色,采用磷酸盐缓冲液(phosphate buffer saline,PBS)冲洗3次,置于倒置光学显微镜下计数。显微镜下随机选取5个视野观察侵袭细胞数目,每个视野计数3次,取平均值。实验重复3次。
1.3.6 细胞黏附实验 在96孔培养板中每孔加入100 μl Matrigel胶,4℃预冷过夜。加入含5%胎牛血清的PBS室温孵育30 min,调整细胞浓度,以每孔1×105个细胞接种至96孔板中,加入含0.1%胎牛血清的RPMI1640培养基。置于37℃、5%CO2的细胞培养箱中孵育45 min后,弃上清,每孔加入100 μl含0.2%Cristal viole(t75%乙醇配制),室温染色15 min后,PBS冲洗细胞2次,干燥。每孔加入100 μl含5%十二烷基硫酸钠(sodium dodecyl sulfate,SDS)的50%乙醇裂解细胞,静置30 min后,测定540 nm波长处的吸光度值。实验重复3次。
1.3.7 蛋白质印迹法(Western blot)检测细胞中p75NTR蛋白的表达情况 将细胞培养瓶中的培养液倒掉,加入苯甲基磺酰氟(phenylmethylsulfonyl fluoride,PMSF)细胞裂解液,提取细胞总蛋白。加入SDS上样缓冲液充分混匀,置于95℃水浴箱中10 min,使蛋白变性。进行十二烷基硫酸钠聚丙烯酰胺凝胶(sodium dodecyl sulfate polyacrylamide gelelectrophoresis,SDS-PAGE)电泳分离,将蛋白条带转移至聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜上。浸入密封液中,室温密闭1 h。加入p75NTR抗体(1∶1000稀释)孵育过夜。采用TBST液冲洗3次,加入二抗,37℃孵育1 h,取适量的ECL试剂显影5 min,采用凝胶成像分析系统测定凝胶光密度值。采用Western blot检测p75NTR蛋白表达水平的变化。实验重复3次。
1.4 统计学方法
采用SPSS 18.0软件对-数据进行统计分析。计量资料以均数±标准差(±s)表示,组间比较采用t检验;计数资料以例数和率(%)表示,组间比较采用χ2检验。以P<0.05为差异有统计学意义。
2 结果
2.1 p75NTR蛋白在胃癌组织中的表达情况
免疫组化染色结果显示:胃癌组织中p75NTR蛋白的阳性表达率为26.25%(21/80),明显低于癌旁正常组织的73.75%(59/80),差异有统计学意义(χ2=36.100,P<0.01)。
2.2 不同临床特征的胃癌患者p75NTR蛋白表达情况
肿瘤直径<5 cm、TNM分期为I~Ⅱ期、无淋巴结转移胃癌患者胃癌组织中的p75NTR蛋白阳性表达率均高于肿瘤直径≥5 cm、TNM分期为Ⅲ~Ⅳ期、有淋巴结转移的胃癌患者,差异均有统计学意义(P<0.05)。不同年龄、性别、分化程度胃癌患者胃癌组织中的p75NTR蛋白的阳性表达情况比较,差异均无统计学意义(P>0.05)。(表1)
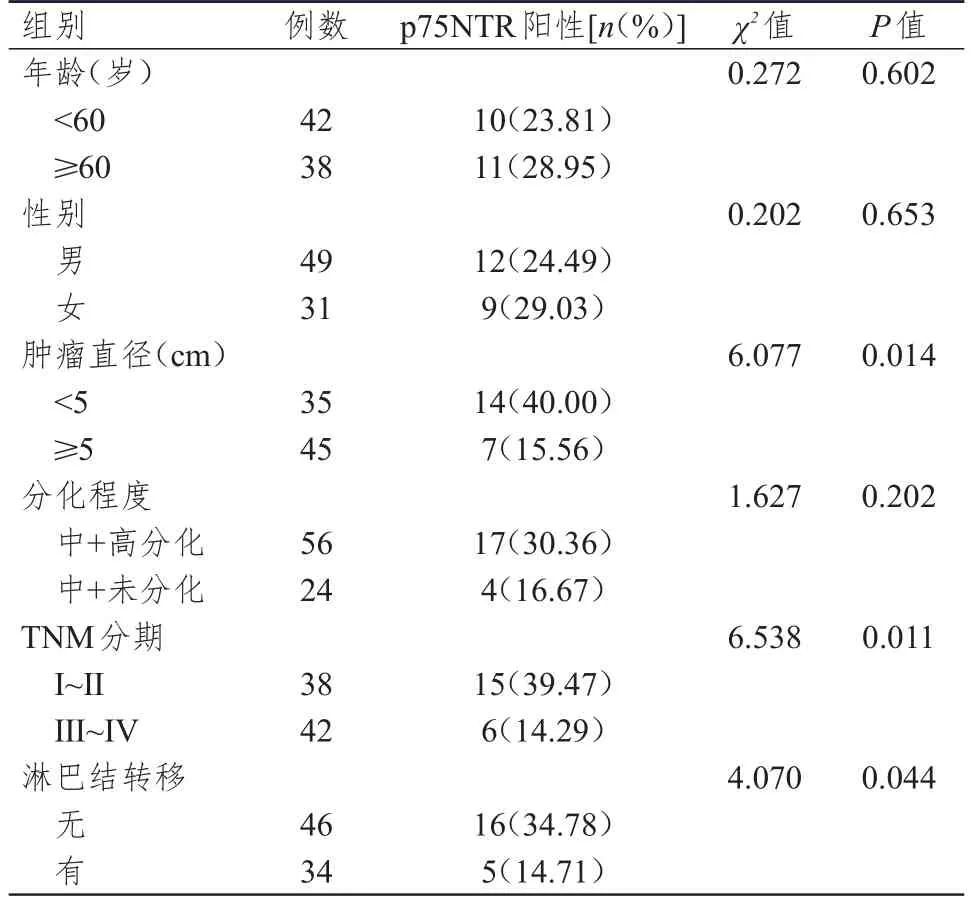
表1 不同临床特征的胃癌患者p75NTR阳性表达情况比较
2.3 转染后胃癌细胞中p75NTR蛋白和p75NTR mRNA相对表达量的比较
经RT-PCR和Western blot检测,结果显示,p75NTR转染后,NC组胃癌细胞中p75NTRmRNA的相对表达量为(0.42±0.10),低于p75NTR转染组胃癌细胞中的(1.39±0.11),差异有统计学意义(t=17.972,P<0.05)。NC组胃癌细胞中p75NTR蛋白的相对表达量为(0.37±0.09),低于p75NTR转染组胃癌细胞中的(2.25±0.14),差异有统计学意义(t=32.594,P<0.05)。
2.4 p75NTR过表达对胃癌细胞黏附能力和侵袭能力的比较
p75NTR转染组胃癌细胞的黏附率为(27.85±6.114)%,低于NC组的(100.0±10.35)%,差异有统计学意义(t=16.976,P<0.05)。p75NTR转染组胃癌细胞的侵袭率为(20.98±4.33)%,低于NC组的(100.0±6.79)%,差异有统计学意义(t=27.754,P<0.05)。
3 讨论
胃癌发展至一定程度后便会发生转移,多数早期胃癌患者的临床症状缺乏特异性,且胃癌的病程较短,恶化程度较高,大部分胃癌患者确诊时已表现出明显的胃癌转移的症状,并很快出现恶病质[7]。胃癌的转移途径较多,胃癌患者的情况不同,胃癌的转移途径亦不同。左锁骨上淋巴结、肝脏、腹腔转移均是胃癌的最常见转移途径;胃癌发生腹腔广泛转移时患者可出现腹腔积液的症状,发生肝脏转移时患者可出现肝肿大及相关症状。研究显示,淋巴结转移是胃癌转移的重要途径,而且发生较早[8]。淋巴结转移占胃癌转移的70%;胃下部肿瘤常转移至幽门下淋巴结、胃下淋巴结、腹腔动脉旁淋巴结等,而胃上部肿瘤常转移至胰旁淋巴结、贲门旁淋巴结、胃上淋巴结等[9]。晚期胃癌可转移至主动脉周围和膈上淋巴结,甚至可转移至左锁骨上淋巴结。随着肿瘤的生长,肿瘤侵犯胃壁越深、越广,发生转移的风险就越大。根据转移的先后顺序将胃癌转移分为3组:第1组,距离瘤体最近且贴于胃壁上的浅组淋巴结,一般发生于胃癌局限于黏膜下层时[8];第2组,引流浅淋巴结的深组淋巴结,发生于胃癌侵犯黏膜肌层时;第3组,包括腹腔动脉旁、腹主动脉、肝门、肠系膜根部及结肠中动脉周围淋巴结,也可发生远处淋巴结转移,如左锁骨上淋巴结,此组转移多为肿瘤侵犯至浆膜层时发生[10]。发生第3组淋巴结转移时,胃癌患者已经失去了根治的机会。
胃癌的直接转移指的是肿瘤生长并侵入胃壁后,可继续向纵深方向生长,突破浆膜层,直接侵犯相邻器官和组织(以大网膜、肝、胰、横结肠为常见,其次为空肠、膈肌甚至腹壁)[11]。胃癌转移直接关系到手术方式的选择及是否能够行根治性切除。一般仅存在邻近脏器局限性转移时,可行手术切除,但是若转移范围较大,则难以行根治性手术切除。浸润型胃癌可沿黏膜或浆膜直接向食管或十二指肠发展。肿瘤一旦侵及浆膜,极容易向周围邻近器官或组织如肝、胰、脾、横结肠、空肠、膈肌大网膜及腹壁等浸润。肿瘤细胞脱落时,也可种植于腹腔、盆腔、卵巢与直肠膀胱陷凹等位置[11]。
近年来,研究证实,p75NTR对于部分肿瘤的发展具有抑制作用,被认为是一种潜在的肿瘤抑制剂[12]。研究显示,p75NTR对前列腺癌的生长具有明显的抑制作用[13];但是,也有研究发现,p75NTR对黑色素瘤细胞的脑转移具有促进作用[14]。两项研究的结论存在矛盾,提示p75NTR发挥的作用并不是固定的,可能会因环境与肿瘤的不同而发挥不同的作用[15]。本研究先通过Western blot检测p75NTR在胃癌组织和癌旁正常组织中的表达情况,探讨了不同临床特征胃癌患者p75NTR的阳性表达情况,又观察了p75NTR表达对胃癌细胞侵袭细胞外基质的能力和黏附能力的影响,结果显示,p75NTR蛋白在胃癌组织中的阳性表达率为26.25%,明显低于癌旁正常组织的73.75%(P<0.01),而且上调p75NTR的表达后,胃癌细胞的黏附率和侵袭率均降低,表明过表达p75NTR对胃癌细胞的侵袭和黏附能力均具有抑制作用,提示p75NTR可能在胃癌的发生过程中起着重要作用。
综上所述,p75NTR在胃癌组织中的阳性表达率明显低于癌旁正常组织,肿瘤直径≥5 cm、TNM分期为I~Ⅱ期、无淋巴结转移胃癌患者胃癌组织中的p75NTR阳性表达率均较高,且能够抑制胃癌细胞的侵袭能力和黏附能力,对于临床上靶向治疗胃癌具有一定的参考意义。

