多黏菌素B发酵过程中组分与杂质的调节
, ,,
(浙江省抗真菌药物重点实验室,浙江海正药业股份有限公司,浙江 台州 318000)
多黏菌素B(Polymyxin B,简称PMB)是一种由多黏类芽孢杆菌(Paenibacilluspolymyxa)产生的氨基酸和脂肪组成的碱性多肽类抗生素。多黏菌素B为抗革兰氏阴性菌的抗生素,对大多数革兰氏阴性菌均有较强的抑制或杀菌作用,尤其是对绿脓杆菌效果极为显著,对副大肠杆菌、肺炎克雷白杆菌、大肠杆菌、绿脓杆菌、嗜酸杆菌、百日咳杆菌及痢疾杆菌等有较好的杀菌效果。多黏菌素自20世纪50年代用于临床治疗细菌感染,由于其存在一定的肾毒性和神经毒性,20世纪70年代后临床使用逐渐减少。在多黏菌素的不良反应中,以肾毒性表现得比较突出。最近的研究中,多黏菌素诱导的临床患者急性肾损伤发生率高达40%~60%,严重影响其在临床中的使用[1]。近年来对多黏菌素潜在的肺细胞毒性的研究也是其临床使用的参考依据[2]。作为治疗多药耐药革兰阴性菌引起严重感染的“最后一道防线”,多黏菌素重新引起了临床的关注。
多黏菌素B由B1,B2,B3和B1-I四个主要组分组成[3],临床使用的多黏菌素主要组分的比例在不同品牌中存在差异,在同一品牌的不同批次中也存在差异,造成临床疗效的不稳定[4-5]。研究表明:多黏菌素B不同组分及杂质的存在会在一定程度上影响药效,因此获得单一组分的多黏菌素B1,更便于医生在临床上的监测[6-7]。笔者考察了发酵培养基不同的氨基酸添加策略,期望可有效控制多黏菌素B的组分和杂质的比例,在不影响发酵产量的前提下获得发酵液中多黏菌素B1组分质量分数达到80%以上的方法,并研究了补加发酵前体氨基酸对发酵产物的影响[8-10]。
1 材料与方法
1.1 菌 种
多黏类芽孢杆菌(Paenibacilluspolymyxa)ATCC10401,购自美国菌种保藏中心。
1.2 培养基
1.2.1 斜面培养基
葡萄糖5 g/L,蛋白胨8 g/L,氯化钠5 g/L,牛肉膏5 g/L,琼脂20 g/L,pH 6.8~7.0。
1.2.2 种子培养基
面粉50 g/L,葡萄糖15 g/L,酵母抽提物3 g/L,三水磷酸氢二钾0.15 g/L,硫酸铵4.5 g/L,碳酸钙3 g/L,消泡剂0.1 mL/L,pH 6.8~7.0。
1.2.3 发酵基础培养基
面粉100 g/L,酵母抽提物1 g/L,三水磷酸氢二钾0.2 g/L,硫酸铵5 g/L,碳酸钙4 g/L,消泡剂0.1 mL/L,pH 6.8~7.0。
1.3 试验方法
1.3.1 发酵培养方法
将生长新鲜斜面接入种子培养基中,取20 mL种子液装于250 mL三角摇瓶,摇床转速250 r/min,28 ℃培养16~18 h,种子OD600为18~25。按2.5%的体积分数接种量接入到发酵培养基,取20 mL发酵液装于250 mL三角摇瓶。摇床转速250 r/min,25 ℃培养72 h。
1.3.2 发酵罐培养方法
50 L发酵罐装液量30 L,按体积分数2.5%接种,培养温度25 ℃,搅拌转速150~300 r/min,溶氧20%~60%,培养周期72 h。
1.3.3 多黏菌素B检测及计算方法
多黏菌素B组分高效液相检测方法:色谱柱采用C18硅胶柱(5 μm,4.6 mm×250 mm); 4.46 g的无水硫酸钠溶解到900 mL的水中,用稀磷酸调节pH至2.3,用水稀释至1 000 mL,制成缓冲液;以V(乙腈)∶V(缓冲液)=20∶80为流动相进行分离,流速1.0 mL/min,紫外波长215 nm,进样量20 μL,柱温30 ℃,多黏菌素B1峰的保留时间为40 min左右,运行时间约为56 min(多黏菌素B1保留时间的1.4倍)。
发酵液HPLC检测方法:发酵液用稀盐酸或稀硫酸调节pH至4.0左右,取发酵液,用水稀释5 倍,摇匀,超声30 min,离心机4 000 r/min离心15 min,取上层水相,以0.22 μm水相针式滤膜过滤,过滤后液体通过高效液相色谱仪进行组分检测。
多黏菌素B标准品为USP REFERENCE STANDARD,标准品用配比为V(乙腈)∶V(水)=80∶20的溶液溶解稀释,采用高效液相色谱检测,图谱如图1所示。图谱中的峰分别编号为1~22;B1组分的质量分数是指样品20峰面积与1~22峰面积之和的比值,B2,B3,B1-I及所有杂质计算方法相同;B1组分质量分数相对值是指样品与对照组20峰面积占比的比值,B2,B3,B1-I及所有杂质计算方法相同;B1组分的效价=(样品20峰面积÷标准20峰面积)×标准品B1质量分数×标准品B1配制浓度×稀释倍数,B2,B3,B1-I及总效价计算方式相同。
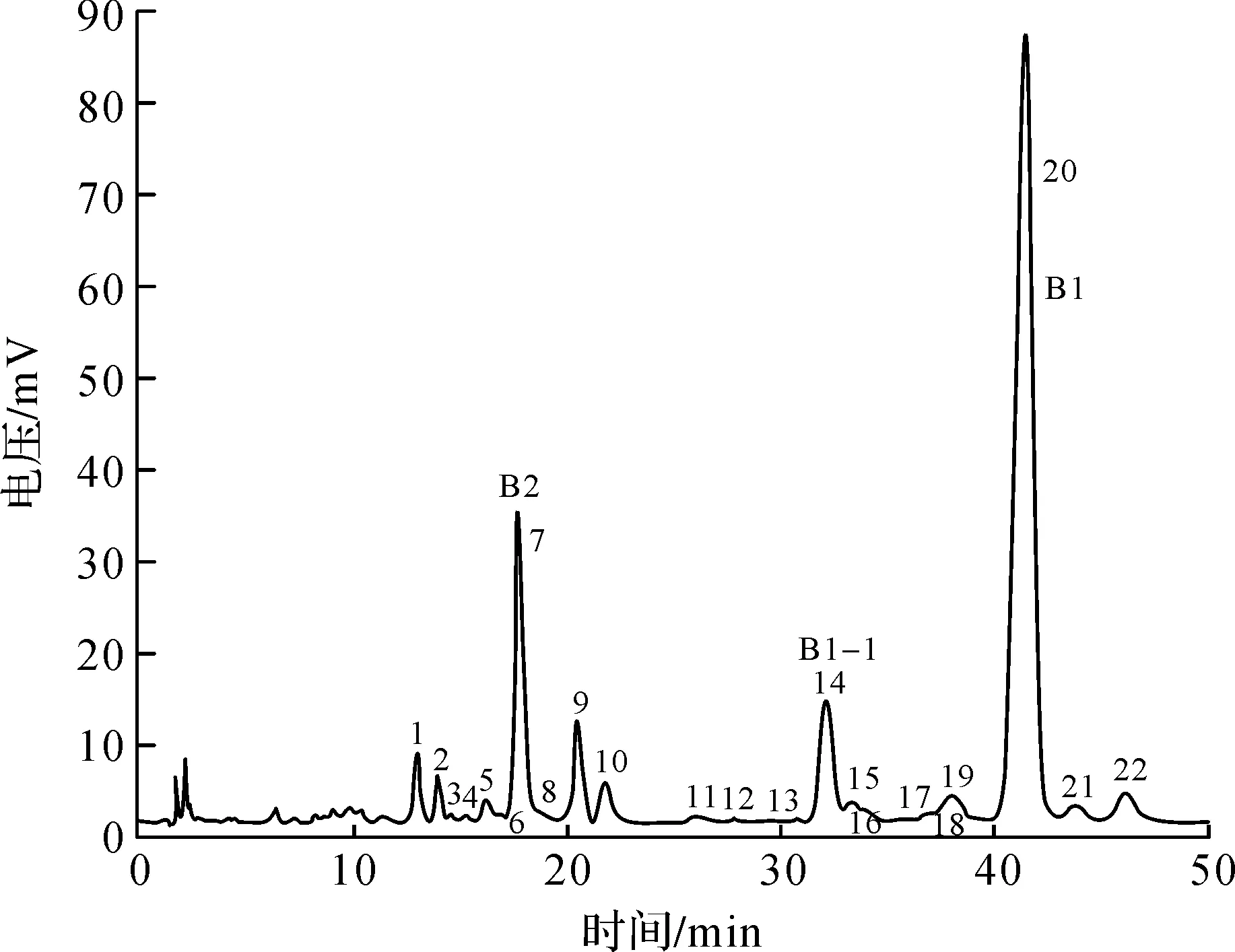
图1 多黏菌素B标准品图谱Fig.1 HPLC chromatogram of Polymyxin B standard
2 结果与讨论
2.1 不同前体氨基酸组合与多黏菌素B组分的关系
以1.2.3的发酵培养基为基础发酵配方,添加前体氨基酸L-亮氨酸(L-Leu)和L-异亮氨酸(L-Ile)分别进行单因素和双因素变量试验,比较前体氨基酸对发酵产物组分的影响,得到两种前体氨基酸与组分之间存在的关系,结果如图2~4所示。

1—0.50 g/L L-Leu+0.00 g/L L-Ile;2—0.50 g/L L-Leu+0.15 g/L L-Ile;3—0.50 g/L L-Leu+0.25 g/L L-Ile;4—0.50 g/L L-Leu+0.35 g/L L-Ile;5—0.50 g/L L-Leu+0.50 g/L L-Ile;6—0.50 g/L L-Leu+0.75 g/L L-Ile图2 发酵中L-Leu质量浓度与PMB组分质量分数的关系Fig.2 The relation of L-Leu mass concentration with PMB mass fraction in the fermentation
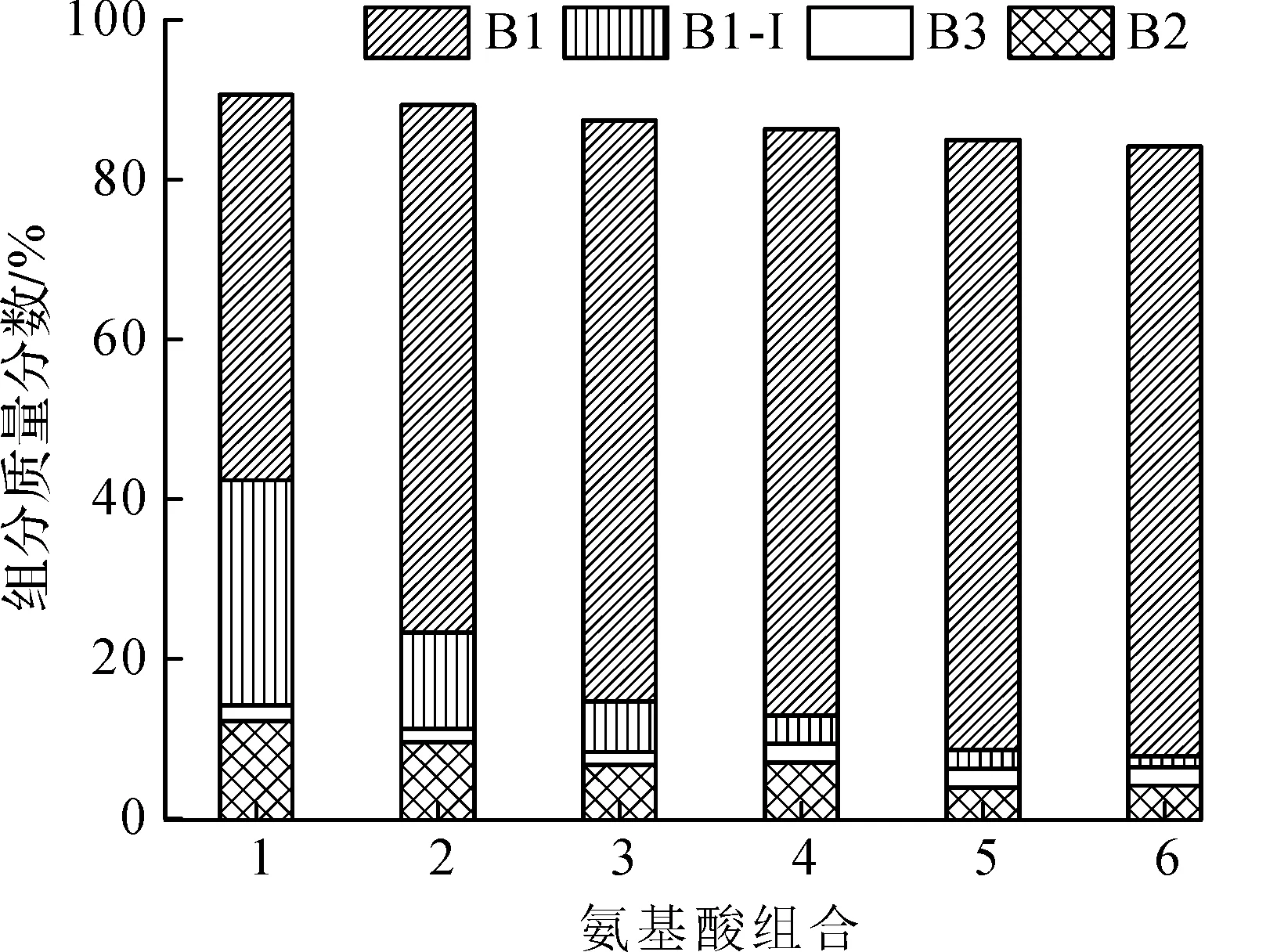
1—0.00 g/L L-Leu+ 0.50 g/L L-Ile;2—0.15 g/L L-Leu+0.50 g/L L-Ile;3—0.25 g/L L-Leu+0.50 g/L L-Ile;4—0.35 g/L L-Leu+0.50 g/L L-Ile;5—0.5 g/L L-Leu+0.50 g/L L-Ile;6—0.75 g/L L-Leu+0.50 g/L L-Ile图3 发酵中L-Ile质量浓度与PMB组分质量分数的关系 Fig.3 The relation of L-Ile mass concentration with PMB mass fraction in the fermentation
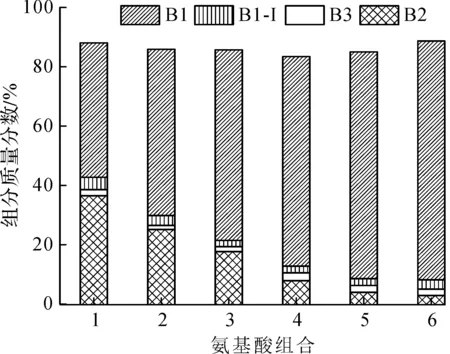
1—0.00 g/L L-Leu+0.00 g/L L-Ile;2—0.15 g/L L-Leu+0.15 g/L L-Ile;3—0.25 g/L L-Leu+0.25 g/L L-Ile;4—0.35 g/L L-Leu+0.35 g/L L-Ile;5—0.50 g/L L-Leu+0.50 g/L L-Ile;6—0.75 g/L L-Leu+0.75 g/L L-Ile图4 发酵中L-Leu和L-Ile质量浓度与PMB组分质量分数的关系Fig.4 The relation of L-Ile and L-Leu mass concentration with PMB mass fraction in the fermentation
由图2~4可知:发酵罐中添加不同质量浓度的L-leu和L-Ile时会影响多黏菌素组分的质量分数,当L-leu的添加量增加时,B1-I和B2组分的质量分数降低,B1组分质量分数增加;当L-Ile的质量浓度增加时,B2组分质量分数降低,B1和B1-I组分的质量分数增加,其中B1-I与L-Ile的正相关性很大;当L-Ile和L-leu的质量浓度同时增加时,B2组分质量分数降低,B1组分质量分数增加,因此,当发酵中同时添加质量浓度为0~0.75 g/L的前体氨基酸L-Ile和L-leu时,多黏菌素B1组分随前体氨基酸浓度增加而增加,且两种氨基酸加量相同时,多黏菌素B1组分增加幅度最高,B2组分随前体氨基酸增加而减少,B1-I组分受L-Ile和L-leu的共同控制,B3组分受前体氨基酸的影响规律不明显。
2.2 相同前体氨基酸(L-Leu和L-Ile)添加量与B1组分质量分数、B1效价和PMB效价的关系
由图4可知:在一定的范围内,当发酵基础配方中同时添加等量的L-Leu和L-Ile时,发酵产物中多黏菌素B1组分的质量分数呈现上升趋势,当发酵基础配方中添加等量的L-Ile和L-Leu时(分别为0~2.0 g/L),多黏菌素B1组分质量分数、多黏菌素B1效价、PMB效价与前体氨基酸加量的关系如图5所示。

图5 前体氨基酸添加量与B1组分质量分数、B1效价、PMB效价的关系曲线Fig.5 The relation curve of addition of the same mass concentration precursor amino acid (L-Leu & L-Ile) with polymyxin B1 mass fraction and polymyxin B1 titer,PMB titer
由图5可知:B1组分质量分数先上升后趋于平稳,添加前体氨基酸组合后B1组分较对照数据最高提升66.8%,B1效价先大幅度上升后趋于平稳,添加前体氨基酸组合后B1效价最高提升105.8%,趋势与B1组分质量分数保持一致,添加前体氨基酸对发酵水平的影响较小。
2.3 不同氨基酸组合与多黏菌素B杂质质量分数的关系
通过HPLC对发酵液中PMB杂质进行分析,结果表明:杂质质量分数与前体氨基酸的添加量存在关联,各杂质的相对保留时间以B1为参考,通过对杂质质量分数与单一种前体氨基酸的添加量的比较,确定了前体氨基酸与杂质之间的关系,结果如表1所示。

表1 前体氨基酸与杂质质量分数关系表1)Table 1 The relation of precursor amino acid on mass fraction of impurity
注:1) +越多表示杂质与氨基酸的正相关性越大;-越多表示杂质与氨基酸的负相关性越大。
单一氨基酸对杂质的相关性很大,添加单一前体氨基酸不能提高多黏菌素B组分的质量分数和B1效价,且使得杂质超过限度,而添加氨基酸组合则很好地减弱了这种相关性,对于多黏菌素B的组分改变和B1效价提升更有利。
2.4 前体氨基酸组合获得高含量多黏菌素B1
在基础发酵配方中,添加等量的前体氨基酸(L-Leu和L-Ile)时,B1组分的质量分数达到最大。以发酵中添加1 g/L的前体氨基酸组合为例,当添加L-Leu 0.5 g/L,L-Ile 0.5 g/L时,多黏菌素B1组分的质量分数高于其他组合,研究结果如图6所示。
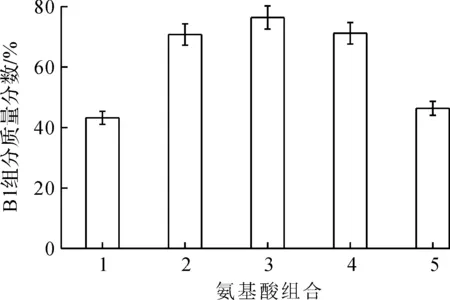
1—0.00 g/L L-Leu+1.00 g/L L-Ile;2—0.75 g/L L-Leu+0.25 g/L L-Ile;3—0.50 g/L L-Leu+0.50 g/L L-Ile;4—0.25 g/L L-Leu+0.75 g/L L-Ile;5—1.00 g/L L-Leu+0.00 g/L L-Ile图6 相同前体氨基酸(L-Leu和L-Ile)加量不同组合方式对B1组分质量分数的影响Fig.6 The effect of precursor amino acid (L-Leu & L-Ile) different combination on mass fraction of polymyxin B1
由图6可知:发酵中添加等量前体氨基酸(L-Leu & L-Ile)时,多黏菌素B1组分质量分数最高,因此,为了获得高含量多黏菌素B1,选择相同含量的氨基酸。
多黏菌素B的结构里,除了上述试验的两种前体氨基酸,L-Thr和D-Phe也作为前体氨基酸进行添加。在添加了L-Leu 0.3 g/L和L-Ile 0.3 g/L的发酵基础培养基中,分别添加0,0.25和0.50 g/L的L-Thr和D-Phe,结果见表2。
表2不同前体氨基酸组合与多黏菌素B1组分的质量分数的关系
Table2TherelationofprecursoraminoacidcombinationwithmassfractionofPolymyxinB1
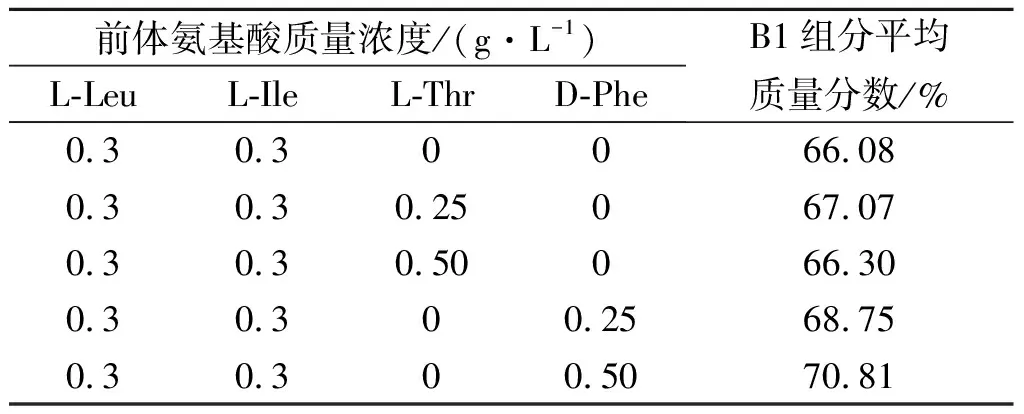
前体氨基酸质量浓度/(g·L-1)L-LeuL-IleL-ThrD-PheB1组分平均质量分数/%0.30.30066.080.30.30.25067.070.30.30.50066.300.30.300.2568.750.30.300.5070.81
由表2可知:发酵中添加适量的前体氨基酸D-Phe可增加发酵液中多黏菌素B1组分质量分数。结合2.2的实验结果,通过验证,前体氨基酸组合为L-Ile 0.8 g/L,L-Leu 0.8 g/L和D-Phe 0.5 g/L时,多黏菌素B1的质量分数可达到83.01%。
2.5 不同氨基酸组合在不同周期对多黏菌素B组分的影响
发酵过程中添加不同氨基酸组合,分别在24,48,72 h检测多黏菌素B1和B2组分的质量分数,结果如图7,8所示。
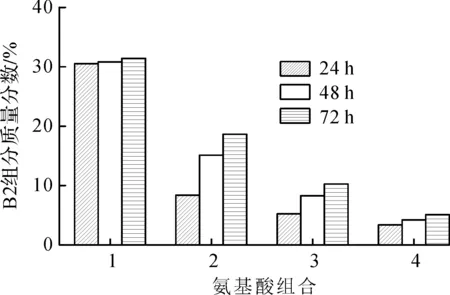
1—0.00 g/L L-Leu+0.00 g/L L-Ile;2—0.30 g/L L-Leu+0.30 g/L L-Ile;3—0.50 g/L L-Leu+0.50 g/L L-Ile;4—0.80 g/L L-Leu+0.80 g/L L-Ile图7 不同前体氨基酸(L-Leu和L-Ile)组合在不同发酵周期对多黏菌素B2组分质量分数的影响Fig.7 The effect of different precursor amino acid(L-Leu &L-Ile)combination on mass fraction of polymyxin B2 in the different fermentation period
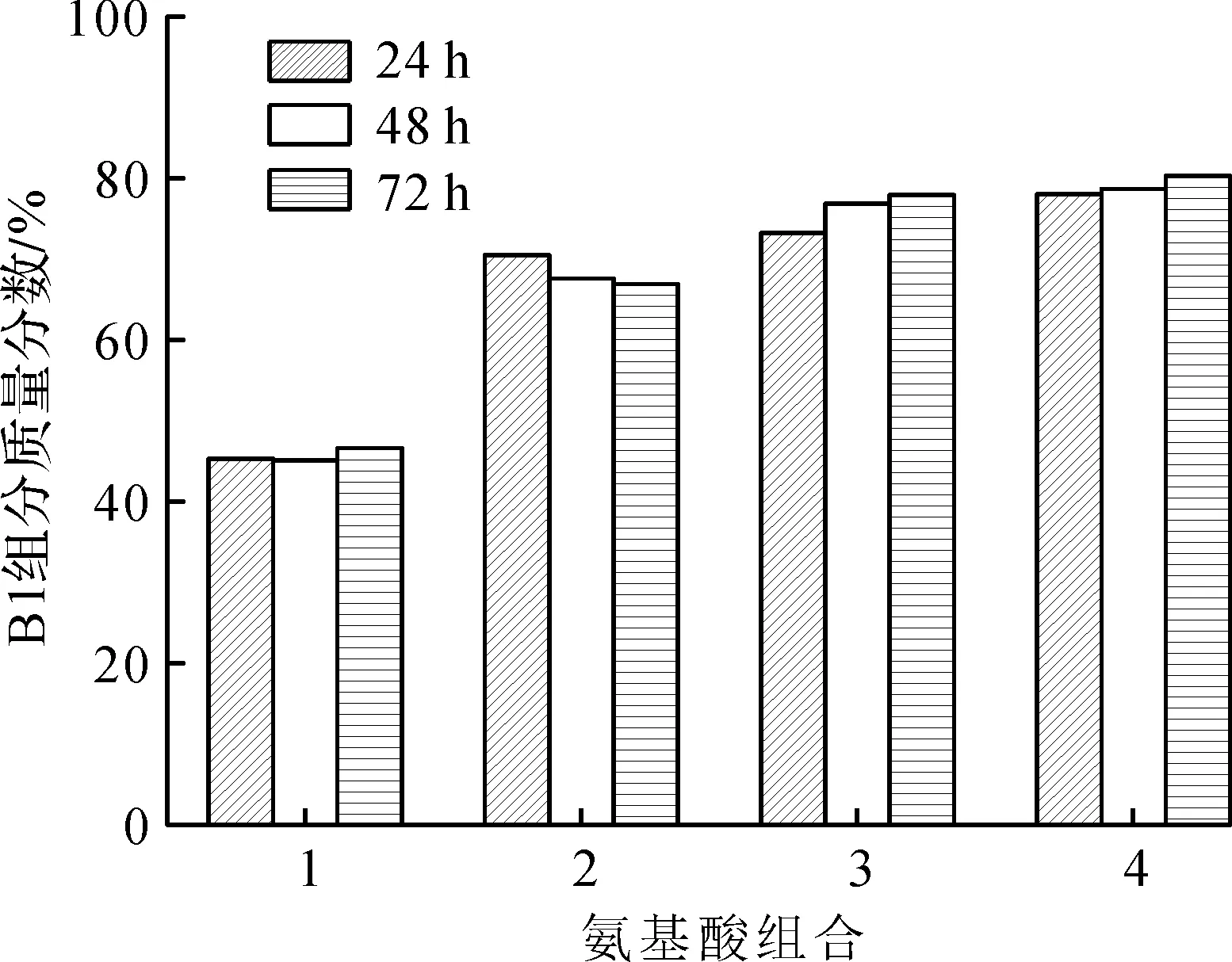
1—0.00 g/L L-Leu+0.00 g/L L-Ile;2—0.30 g/L L-Leu+0.30 g/L L-Ile;3—0.50 g/L L-Leu+0.50 g/L L-Ile;4—0.80 g/L L-Leu+0.80 g/L L-Ile图8 不同前体氨基酸(L-Leu和L-Ile)组合在不同发酵周期对多黏菌素B1组分的质量分数的影响Fig.8 The effect of different precursor amino acid(L-Leu & L-Ile)combination on mass fraction of polymyxin B1 in the different fermentation period
由图7,8可知:在不同的发酵周期添加不同质量浓度的氨基酸组合时,多黏菌素B1组分的质量分数随周期的变化幅度较小,不呈现规律性变化;B2组分的质量分数随周期呈现上升趋势,但是不同前体氨基酸组合条件下,B2的增长幅度不一致。
2.6 不同周期添加前体氨基酸对多黏菌素B组分的影响
以发酵未添加前体氨基酸,与分别在0,24 h添加L-Leu 0.3 g/L+L-Ile 0.3 g/L的氨基酸组合方式,分别在24,48,72 h检测B1和B2组分的质量分数。以发酵周期72 h未添加前体氨基酸组为参照,所得B1和B2的质量分数相对值与发酵周期的关系曲线如图9,10所示。
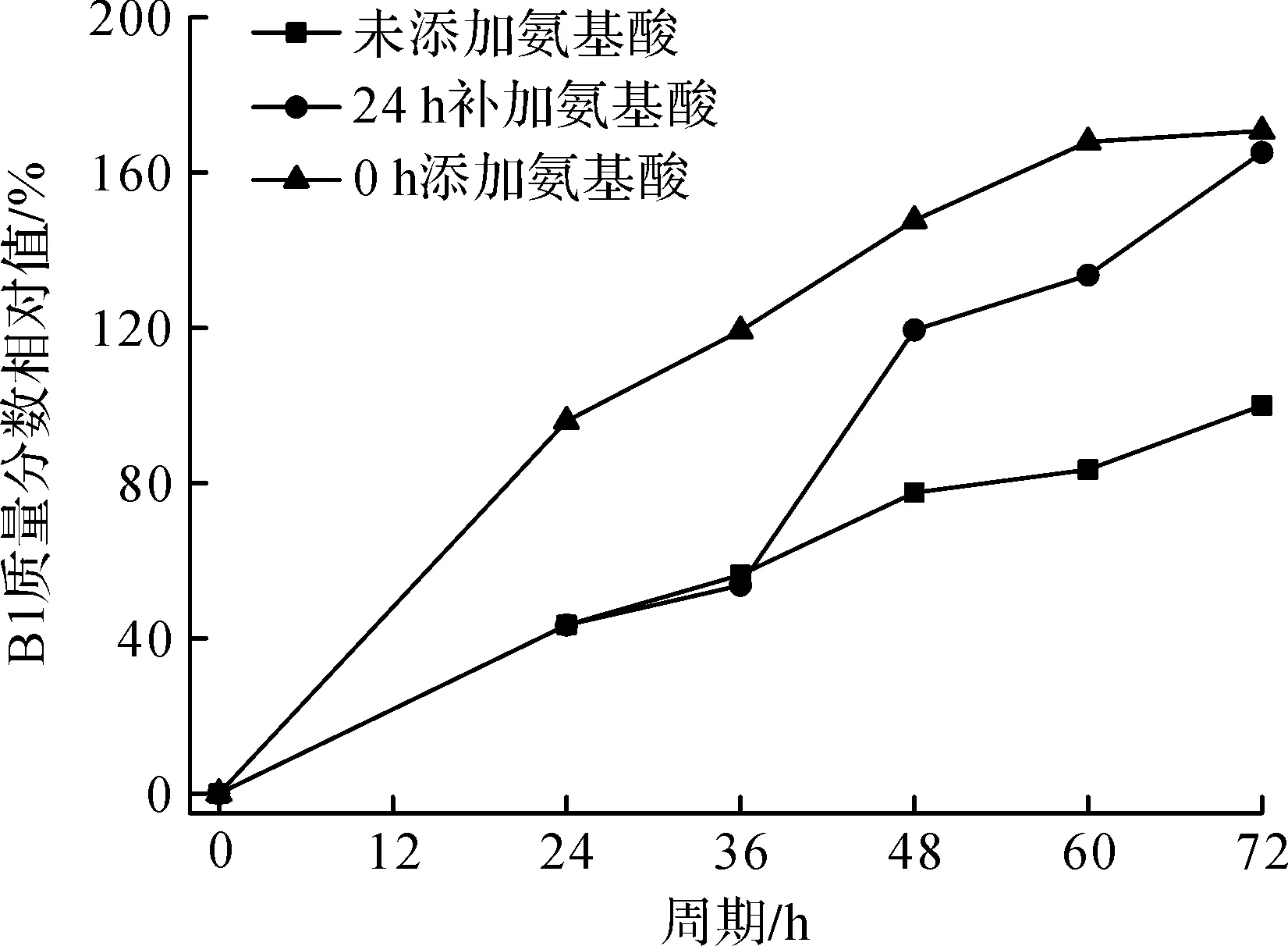
图9 发酵过程补加前体氨基酸组合与多黏菌素B1质量分数相对值的关系曲线Fig.9 The relation curve of supplement precursor amino acid combination and relatively mass fraction of polymyxin B2
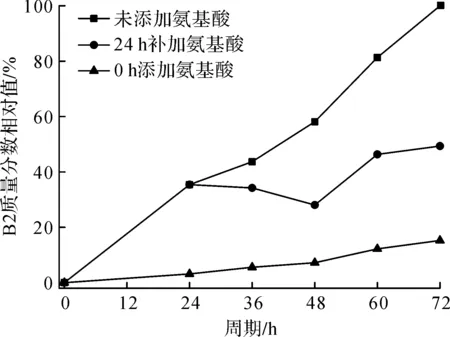
图10 发酵过程补加前体氨基酸组合与多黏菌素B2质量分数相对值的关系曲线Fig.10 The relation curve of supplement precursor amino acid combination and relatively mass fraction of polymyxin B2
由图9,10可知:多黏菌素B1和B2两个主要组分在生物合成过程中受前体氨基酸L-Leu和L-Ile的控制,发酵过程中补加前体氨基酸可重构产物中多黏菌素B组分的质量分数。生产中,发酵过程可通过调节添加氨基酸的量进行控制,当发酵液中部分杂质和组分超标时,通过补加氨基酸,调整发酵料液组分及杂质质量分数,以达到质量要求,也可通过连续补加氨基酸提高B1的质量分数,从而提高发酵水平。
2.7 在发酵罐中添加前体氨基酸对多黏菌素B组分的影响
在50 L发酵罐中分别进行未添加前体氨基酸与0 h添加L-Leu 0.5 g/L+L-Ile 0.5 g/L两种方式的发酵,所得B1和B2组分的质量分数变化曲线如图11,12所示。
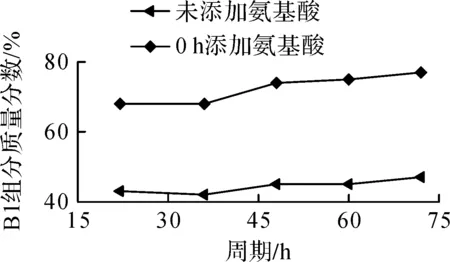
图11 50 L发酵罐中添加前体氨基酸组合时多黏菌素B1组分质量分数变化曲线Fig.11 The change curve of mass fraction of polymyxin B2 and precursor amino acid combination in 50 L fermentator
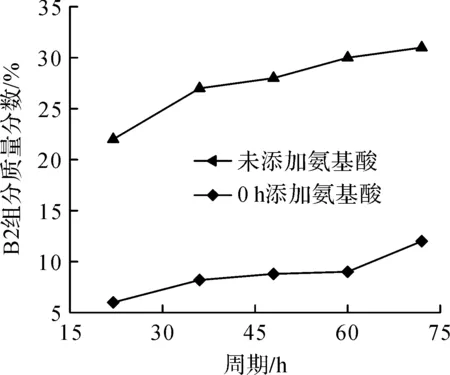
图12 50 L发酵罐中添加前体氨基酸组合时多黏菌素B2组分质量分数变化曲线Fig.12 The change curve of mass fraction of Polymyxin B2 and precursor amino acid combination in 50 L fermentator
由图11,12的结果可知:50 L发酵罐中添加前体氨基酸也会影响多黏菌素B组合组分变化,与2.5节摇瓶发酵结果一致。
3 结 论
多黏菌素B是一种包含4个组分的多组分物质,临床使用的不同品牌、不同批次的多黏菌素B的主要组分差异很大,造成了临床疗效的不稳定[4-5]。多黏菌素B为脂肽类抗生素,L-Leu为B1组分的前体氨基酸,L-Ile与B1组分脂肪酸链有相同的尾部基团,但L-Ile却是B1-I的前体氨基酸,发酵过程中同时添加L-Ile和L-Leu时,两者氨基酸的去向产生竞争,L-Leu主要参与肽链的生物合成,L-Ile则主要参与脂肪酸链的生物合成,而且这种调控与氨基酸的含量有关。D-Phe则只参与肽链的生物合成,所以其对多黏菌素B组分的调节有局限性[11]。笔者在发酵中通过添加氨基酸控制组分含量,不同的氨基酸组合、培养周期和氨基酸的补加时间都是影响组分差异的因素,通过控制相关参数获得达到质量要求的产物。氨基酸也会影响杂质的质量分数,研究获得了不同氨基酸与杂质质量分数的关系。当发酵中同时添加前体氨基酸L-Ile和L-leu时,多黏菌素B1组分随前体氨基酸量增加而增加,且两种氨基酸加量相同时,增加幅度最高,B2组分随前体氨基酸增加而减少,B1-I组分受L-Ile和L-leu的共同控制,L-Ile促进B1-I的生成,L-Leu抑制B1-I的产生,B3组分受前体氨基酸的影响规律不明显,并且前体氨基酸L-Ile和L-Leu会影响杂质的组成和总杂质质量分数的变化。其他前体氨基酸如D-Phe对多黏菌素B的生成亦有促进作用,当实验中前体氨基酸组合为L-Ile 0.8 g/L+L-Leu 0.8 g/L+D-Phe 0.5 g/L时,多黏菌素B1质量分数可达到83.01%。利用氨基酸与发酵组分质量分数的关系,得出了获得高质量分数多黏菌素B1的方法,对于生产单组分多黏菌素B具有重要价值,氨基酸对于多黏菌素B组分调控机制有待进一步研究。

