CD36在宫颈癌组织中的表达及临床意义
李珍,宋玉兰,傅桥妹,曾超
(1.广东医科大学 病理学系,广东 东莞 523808;2.广东药科大学附属第一医院 病理科,广东 广州 510006)
宫颈癌是最常见女性恶性肿瘤之一,约83%病例发生于发展中国家,宫颈癌确诊为早期的5年生存率为90%,晚期伴侵袭转移的宫颈癌患者预后较差,Ⅳ期患者5年生存率<20%,尽管外科手术、放化疗等治疗方式日趋完善,但复发、转移仍是宫颈癌治疗失败的主要原因[1-2]。宫颈癌发病相关分子较为繁多且复杂,因此,探索与发病相关的新的分子标志物对于宫颈癌的预防及靶向治疗尤为重要。
CD36又称为GP88、GPⅢb,是一种蛋白分子量为88 kD的多功能跨膜糖蛋白受体,染色体定位7q11.2,最初发现于单核细胞及血小板,亦可表达于包括巨噬细胞、微血管内皮细胞(ECs)等多种类型的血细胞,可作为长链脂肪酸受体、氧化低密度脂蛋白(OxLDLs)受体、血小板1(TSP1)受体、Ⅰ型胶原受体及内皮细胞受体[3-4]参与机体生理或病理状态下的不同生物学功能,包括血管生成、动脉粥样硬化、吞噬作用、炎症、脂质代谢及凋亡细胞的去除[5]。目前为止,CD36与宫颈癌的关系尚未见报道,因此,本研究旨在探讨CD36在宫颈癌中的表达,分析其表达与宫颈癌临床病理特点的相关性。
1 资料与方法
1.1 一般资料
选取2011年1月—2016年12月广东药科大学附属第一医院宫颈癌患者102例。年龄25~76岁,中位年龄47岁;按病理分化程度:高分化29例,中分化37例,低分化36例;临床TNM分期:Ⅰ期67例,Ⅱ、Ⅳ期35例;T分期:T1期75例,T2~T4期27例;淋巴结转移59例,无淋巴结转移43例;所有病例均无远处器官转移,临床资料完整,病理诊断明确,术前均未接受放化疗,且无其他基础性疾病或急慢性病。同时选取46例癌旁正常组织为对照。
1.2 试剂与方法
1.2.1 免疫组织化学检测 一抗(鼠抗人单克隆抗体,1∶50)购于美国Santa Cruz公司,免疫组织化学试剂盒(含二抗,羊抗鼠,即用型)、DAB显色试剂盒均购于福州迈新生物技术公司,改进型柠檬酸钠抗原修复液购于碧云天生物技术公司。操作严格遵守试剂盒说明书操作规程,采用已知阳性组织作为阳性对照,PBS代替一抗作作阴性对照。具体操作步骤如下:烤片2 h,二甲苯脱蜡,梯度酒精水化,抗原修复液高压修复,内源性过氧化物酶阻断15 min,动物非免疫血清室温封闭1 h,滴加一抗4℃过夜,37℃孵生物素标记的二抗1 h,之后滴加链酶抗生物素蛋白-过氧化物酶,DAB显色,苏木素复染,水冲返蓝,1%盐酸酒精分化,梯度酒精脱水,二甲苯透明,中性树胶封片,镜下观察。
1.2.2 蛋白提取及 Western blotting 筛选 一抗(鼠抗人单克隆抗体,1∶50)购于美国Santa Cruz公司,内参(兔抗GAPDH多克隆抗体,1∶1 000)购于杭州贤至生物科技有限公司,二抗(辣根过氧化物酶标记的羊抗鼠、羊抗兔,1∶1 000)、RIPA、PMSF、5×SDS-PAGE蛋白上样缓冲液、ECL化学发光试剂盒均购于上海碧云天生物科学技术有限公司,蛋白磷酸酶抑制剂混合物购于北京普利莱基因技术有限公司。3株宫颈癌细胞株(Hela、HCE1、C33a)细胞均来源于本课题组所在实验室细胞库冷冻保存细胞。具体操作步骤:取细胞培养箱中呈对数生长期细胞,预冷PBS洗3次,加入现配裂解液(RIPA∶PMSF∶蛋白磷酸酶抑制剂为100∶1∶1),冰上迅速刮取蛋白,将混合液移至新的EP管,冰浴30 min,4℃12 000 r/min 离心 30 min,取上清液,蛋白定量后加入蛋白上样缓冲液100℃ 变性,行SDS-PAGE电泳,转膜,1×TBST配置5%脱脂奶粉室温封闭1 h,一抗4℃孵育过夜,1×TBST洗膜5 min×4次,二抗室温孵育1 h,1×TBST洗膜5 min×4次,ECL 显影,结果采用Image J软件测定蛋白条带灰度值。
1.3 结果判定
免疫组织化学染色结果均至少由2位病理诊断医生进行双盲判定,判定标准:包膜或胞浆中出现棕黄色颗粒物质可视为阳性,依据阳性细胞率和染色强度进行免疫组织化学染色评分:无着色0分,淡黄染色1分,棕黄色2分,棕褐色3分;每个高倍镜视野计数100个细胞,随机选取10个视野观察进行计数,取其平均值作为阳性细胞数,以阳性细胞数百分比计分:<5%为0分,≤10%为1分,11%~50%为2分,51%~75%为3分,≥75%为4分;再将染色强度与阳性细胞率计分作乘积分级:>3分为弱阳性(+),6~9分为中阳性(++),9~12分为强阳性(+++),凡(+)或(+)以上者均为阳性表达。
1.4 统计学方法
数据分析采用SPSS 17.0统计软件,计量资料以均数±标准差(±s)表示,比较采用t检验,计数资料以例(%)表示,比较采用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 宫颈癌细胞株中CD36蛋白表达水平
3株宫颈癌细胞株(C33a、HCE1、Hela)中CD36/GAPDH蛋白灰度比值分别为(4.6±1.3)、(43.3±2.6)、(45.8±3.4)%,比较 C33a细胞,CD36在 Hela、HCE1细胞中呈高表达,差异有统计学意义(t=25.724和 22.054,P=0.002 和 0.002)。见图1。

图1 CD36在宫颈癌细胞株中的表达
2.2 CD36在宫颈癌组织中的表达
CD36蛋白阳性表达产物主要定位于胞质或胞膜,免疫染色呈淡黄、棕黄或棕褐色(见图2、3)。宫颈癌组织中CD36阳性表达率为72.5%(74/102),癌旁正常组织中CD36阳性表达率为21.7%(10/46),差异有统计学意义(χ2=33.347,P=0.000)(见表1)。同时分析CD36在宫颈癌组织的表达与临床病理特征之间的关系,发现CD36在不同年龄、临床分期及T分期的宫颈癌患者之间的表达差异无统计学意义(P>0.05),而与肿瘤病理分化程度、肿瘤淋巴结转移存在一定关联,在高、中、低分化癌组织中CD36表达差异有统计学意义(P<0.05)(见表2)。

图2 CD36在宫颈癌组织中的表达 (SP×400)

图3 CD36在宫颈癌及癌旁正常组织中的表达(SP×400)

表1 CD36在宫颈癌及癌旁正常组织中的表达
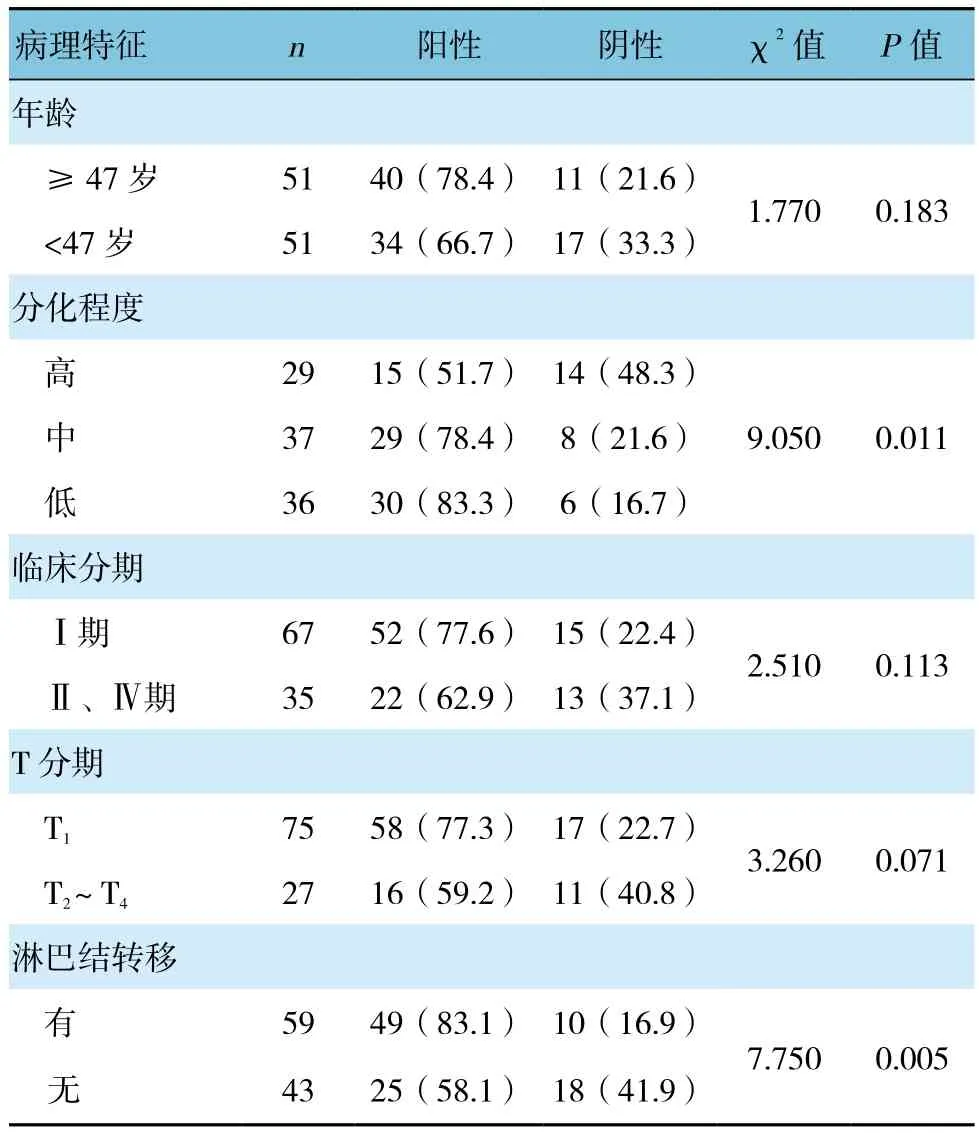
表2 CD36表达与临床病理特征之间的关系 例(%)
3 讨论
研究表明,CD36作为一类多功能蛋白,通过结合不同配体除参与多种正常及异常生物学效应外,还参与肿瘤形成的正反向调控过程。CD36作为血小板1(TSP-1)受体,可与TSP-1紧密结合并相互作用抑制肿瘤血管形成[6],可能对肿瘤发生、发展起负调控作用。然而,多数研究表明,在多种肿瘤进展过程中CD36主要作为促癌基因参与肿瘤的调控。HALE等[7]研究显示,CD36可作为恶性肿瘤的标志物,与患者预后呈负相关,且于胶质母细胞瘤中发现CD36作为氧化磷脂受体与肿瘤干细胞的增殖相关。另一方面,腹膜含丰富的Ⅰ型胶原[8],KENNY等[9]表明CD36作为Ⅰ型胶原受体,其表达抑制可降低Ⅰ型胶原基质黏附力,对肿瘤盆腔或腹腔转移尤为重要。有研究表明,CD36亦可作为脂肪酸受体结合游离脂肪酸(FFA)后通过激活Wnt/β-catenin和TGF-β信号途径介导肝癌细胞的上皮-间质转化(EMT),从而更有利于肝癌细胞的侵袭转移[10],同时有研究发现,在肾小管上皮细胞中,CD36的表达抑制可通过调节TGF-β1的表达,激活Smad 2和ERK 1/2信号途径,抑制Fibronectin合成,从而减缓EMT[11]。LADANYI等[12]在卵巢癌中发现肿瘤周围网膜脂肪细胞可上调CD36表达,而CD36可降低卵巢癌细胞葡萄糖氧化过程形成低氧肿瘤细胞,低氧肿瘤细胞通过清除血清磷脂内游离脂肪酸(FFA),使外源性脂肪酸通过CD36转运至肿瘤细胞,引起脂肪细胞介导的肿瘤生长、侵袭与转移。PASCUAL等[13]研究表明,CD36作为脂肪酸受体可表达于人口腔癌细胞,该细胞在小鼠体内具较高转移潜能,且通过CD36抗体阻断该受体后,小鼠体内的肿瘤转移情况明显改善,原发肿瘤明显萎缩甚至消失,表明CD36具有作为肿瘤靶向治疗的潜能。
本实验研究采用Western blotting、免疫组织化学分别检测CD36在宫颈癌细胞株、宫颈癌组织及癌旁正常宫颈上皮中的表达情况,并分析其与临床病理因素的关系。实验结果表明,CD36在宫颈癌组织中呈高表达,阳性率高达72.5%,而癌旁正常组织中CD36阳性率为仅为21.7%,两者比较差异有统计学意义。Western blotting结果亦证实宫颈癌细胞株亦可表达CD36蛋白。免疫组织化学结果提示,与癌旁正常组织相比,宫颈癌组织中CD36表达明显增高,进一步统计分析发现,CD36在宫颈癌中的表达与分化程度、肿瘤淋巴结转移相关关,初步证实CD36的表达与宫颈癌密切相关,这可能与CD36作为脂肪酸受体,通过不同信号途径参与肿瘤的EMT,亦或作为其他受体参与肿瘤的发生、发展,具体作用机制有待进一步研究。

