基于均匀设计法的附子与甘草配伍减毒研究
贾真 刘艳彦


摘要:目的 觀察附子、甘草不同配伍比例对附子毒性的影响,探索甘草与附子配伍减毒的最佳比例。方法 使用均匀设计表确定附子、甘草的配伍比例;以小鼠死亡率为指标进行附子、甘草不同配伍比例急性毒性评价;多元线性回归分析得到多元函数模型,针对函数模型求偏导数,得到附子、甘草最佳配比;比较附子及最佳配比附子、甘草的急性毒性,验证其减毒效果。结果 随着甘草剂量增加,小鼠死亡率整体呈下降趋势。针对多元回归分析得到的多元函数模型求偏导数得附子、甘草最佳配比为0.42∶1。附子半数致死剂量为30.9 g/kg,附子、甘草最佳配比最大耐受量为100 g/kg,小鼠死亡率为20%,附子毒性明显减小。结论 附子、甘草配伍比例对附子毒性有一定影响,从整体趋势来看,随着甘草剂量的增加,附子的毒性逐渐越小。
关键词:附子;甘草;配伍;均匀设计法;小鼠
中图分类号:R284.1;R285.5 文献标识码:A 文章编号:1005-5304(2019)02-0069-05
DOI:10.3969/j.issn.1005-5304.2019.02.015
开放科学(资源服务)标识码(OSID):
Abstract: Objective To observe the effects of different compatibility ratios of Aconiti Lateralis Radix Praeparata and Glycyrrhizae Radix et Rhizoma on toxicity of Aconiti Lateralis Radix Praeparata; To explore the best compatibility ratio of Aconiti Lateralis Radix Praeparata and Glycyrrhizae Radix et Rhizoma. Methods The compatibility ratios of Aconiti Lateralis Radix Praeparata and Glycyrrhizae Radix et Rhizoma were confirmed with uniform design method. Based on the mortality rate of mice, the acute toxicity of different compatibility ratios of Aconiti Lateralis Radix Praeparata and Glycyrrhizae Radix et Rhizoma was evaluated; Multiple linear regression analysis was used to obtain multivariate function model. Partial derivative for function model was used to obtain the best compatibility of Aconiti Lateralis Radix Praeparata and Glycyrrhizae Radix et Rhizoma; acute toxicity of Aconiti Lateralis Radix Praeparata and best compatibility of Aconiti Lateralis Radix Praeparata and Glycyrrhizae Radix et Rhizoma were compared, and its attenuation was verified. Results With the increase of Glycyrrhizae Radix et Rhizoma dosage, the mortality rate of mice was decreasing as a whole. The best ratio of Aconiti Lateralis Radix Praeparata and Glycyrrhizae Radix et Rhizoma obtained through partial derivative of multiple function model was 0.42:1. The lethal dosage of half Aconiti Lateralis Radix Praeparata was 30.9 g/kg. The maximal tolerable dose of best compatibility of Aconiti Lateralis Radix Praeparata and Glycyrrhizae Radix et Rhizoma was 100 g/kg. The mortality rate of mice was 20%. The toxicity of Aconiti Lateralis Radix Praeparata decreased significantly. Conclusion The compatibility of Aconiti Lateralis Radix Praeparata and Glycyrrhizae Radix et Rhizoma has certain effects on the toxicity of Aconiti Lateralis Radix Praeparata. From the overall trend, as the dosage of Glycyrrhizae Radix et Rhizoma increases, the toxicity of Aconiti Lateralis Radix Praeparata is smaller.
Keywords: Aconiti Lateralis Radix Praeparata; Glycyrrhizae Radix et Rhizoma; compatibility; uniform design; mice
附子为毛茛科植物乌头Aconitum carmichaelii Debx.子根的加工品,有回阳救逆、补火助阳、散寒止痛功效[1],是中医治疗急症重症的代表药。但附子有大毒[2],通过炮制、久煎等方法可降低其毒性。现代药理研究表明,附子化学成分中乌头类生物碱是附子产生毒性作用的主要成分,同时也是发挥药效的主要成分,炮制和久煎都会不同程度损失附子有效成分[3-6],从而影响疗效。通过查阅古今文献,我们发现附子常与甘草配伍使用,且甘草可使附子减毒存效。近年来,附子、甘草配伍的作用机制也成为研究热点,包括对附子配伍甘草前后的化学成分、毒性、药效、相态、代谢等研究[7-15],但关于附子、甘草配伍的作用机制仍未有定论。研究显示,附子、甘草不同配伍比例对药效有一定影响,从而推断附子、甘草配伍的作用机制与用药剂量和二药配伍比例有关。关于附子、甘草配伍比例对附子毒性影响的研究表明,随着甘草比例的增加,附子的毒性越来越低[9,14],但这些研究的配伍比例都是根据历代医家经验设计。均匀设计是基于试验点在整个试验范围内均匀散布、从均匀性角度出发的一种试验设计方法,该方法试验次数少且均有代表性,因素的水平可多设,且实验结果可用计算机处理,在寻找最佳实验条件、最佳配比等方面是选择优化条件的有力工具[16]。在中药方面的应用包括药理研究和优化中药的提取工艺、制剂的成型工艺、组方配伍等[17]。如王英豪等[18]采用均匀设计法得出钩吻和玉叶金花的最低毒性配伍比例。因此,本研究结合临床用药经验,以及附子、甘草的急性毒性评价结果,确定附子和甘草的剂量范围,使用均匀设计表确定附子、甘草不同配伍比例,以小鼠灌服药液后的死亡率为指标,观察附子、甘草不同配伍比例对附子毒性的影响,并采用多元线性回归分析探索附子与甘草的最佳配比。
1 仪器、试药和动物
FA2204B电子天平(上海精科天美科学仪器有限公司),RV10 basic 旋转蒸发仪(德国IKAIKA公司),DLSB-5L/10低温循环冷却泵(巩义市予华仪器有限责任公司)。白附片(广州市药材公司中药饮片厂,批号YPA7H0001),甘草(广州至信中药饮片有限公司,批号17080),甲醇(色谱纯,广州飞恩新材料科技有限公司),三乙胺(分析纯),水为蒸馏水。
ICR小鼠210只,SPF级,18~22 g,雌雄各半,购自广州中医药大学实验动物中心,动物许可证号SCXK(粤)2013-0034。饲养于清洁级动物房,室温20 ℃,自由摄食饮水,隔日换垫料。
2 方法与结果
2.1 干浸膏制备
取药物饮片适量,置于圆底烧瓶中,加入10倍量水,浸泡30 min,加热回流提取2次合并。用旋转蒸发仪(水浴锅温度为70 ℃)浓缩至一定程度,转至蒸发皿,水浴(70 ℃)加热蒸干,得干浸膏,称重,置于4 ℃冰箱保存备用。
2.2 附子、甘草急性毒性评价
2.2.1 附子半数致死剂量测定
2.2.1.1 预试验
ICR小鼠16只,雌雄各半,随机分为4组,每组4只,按0.4 mL/10 g体质量计算灌胃体积。附子干浸膏加水溶解至所需浓度,各组按设定的剂量分别灌胃给药,给药后立刻观察小鼠出现的毒性反应并记录死亡数,找出引起0%死亡率和100%死亡率剂量的所在范围。预试验结果表明,附子组无死亡剂量为10 g/kg,全致死剂量为80 g/kg。
2.2.1.2 正式試验
ICR小鼠36只,雌雄各半,适应性观察3 d。实验前禁食不禁水16 h,随机分为6组,每组6只,根据预试验结果确定各组给药剂量,组间距为0.6。按0.4 mL/10 g体质量计算灌胃体积。附子干浸膏加水溶解至所需浓度,各组按设定的剂量分别灌胃给药,给药后立刻开始观察小鼠神经系统、循环系统、消化系统的毒性反应,记录中毒潜伏期、开始出现死亡的时间、各组小鼠死亡数等,及时解剖死亡小鼠,记录观察到的变化。绘制小鼠死亡曲线,采用Bliss法计算半数致死剂量(LD50)。
2.2.1.3 小鼠中毒症状及附子半数致死剂量测定结果
小鼠给药后出现身体颤抖、恶心干呕、行动迟缓的症状,继而精神萎靡、怠动、俯卧不动。死亡前全身颤抖、怠动无力、呼吸急促,部分小鼠出现惊厥。动物死亡多发生在给药后0~4 h内,对死亡动物进行解剖,发现肝脏边缘发黄或发黑,部分小鼠脾脏或者心脏略有发黑。给药24 h后无小鼠死亡,小鼠逐渐恢复正常状态。不同剂量引起小鼠死亡数见表1,附子LD50为30.9 g/kg,95%置信区间为21.4~45.1 g/kg。
2.2.2 甘草最大耐受量测定
2.2.2.1 预试验
ICR小鼠10只,雌雄各半,按0.4 mL/10 g体质量计算灌胃体积。以最大浓度0.75 g/mL甘草灌胃1次,观察7 d,无死亡出现。
2.2.2.2 正式试验
ICR小鼠40只,雌雄各半,随机分为对照组和给药组,每组20只,计算灌胃体积,给药组1 d内给予最大给药量(0.75 g/mL×0.4 mL/10 g),对照组给予等体积水,灌胃3次。观察7 d,测定最大耐受量(MTD)。小鼠给药后未出现异常活动,解剖结果也未见异常情况。实验结果显示,甘草MTD为90 g/kg。
2.3 附子、甘草配伍比例确定
2.3.1 附子、甘草給药剂量确定
按急性毒性评价结果,附子给药量最小值为LD50,最大值为2×LD50;甘草给药量最小值为临床用药的低剂量,最大值为MTD。最终确定附子给药剂量为30~60 g/kg,甘草给药剂量为1~90 g/kg。
2.3.2 因素与水平的确定
根据均匀设计U7*(74)表,将附子、甘草给药剂量分别作为考察因素1、因素2,每个因素分别取7个水平,附子与甘草剂量见表2,剂量配比见表3。
2.4 不同配伍比例附子、甘草毒性评价
2.4.1 不同配伍比例附子、甘草水煎液毒性测定
ICR小鼠70只,雌雄各半,适应性观察3 d。实验前禁食不禁水16 h,随机分为7组,每组10只。各组小鼠灌胃给药2次,按试验方案将配制药液全部灌完。给药后立刻开始观察小鼠神经系统、循环系统、消化系统的毒性反应,中毒症状发生的时间、持续时间、恢复情况,对死亡小鼠及时进行大体解剖观察,记录所观察到的变化,统计各组小鼠死亡数并比较各组死亡率。7 d后将全部小鼠处死并解剖观察,记录所观察到的变化。
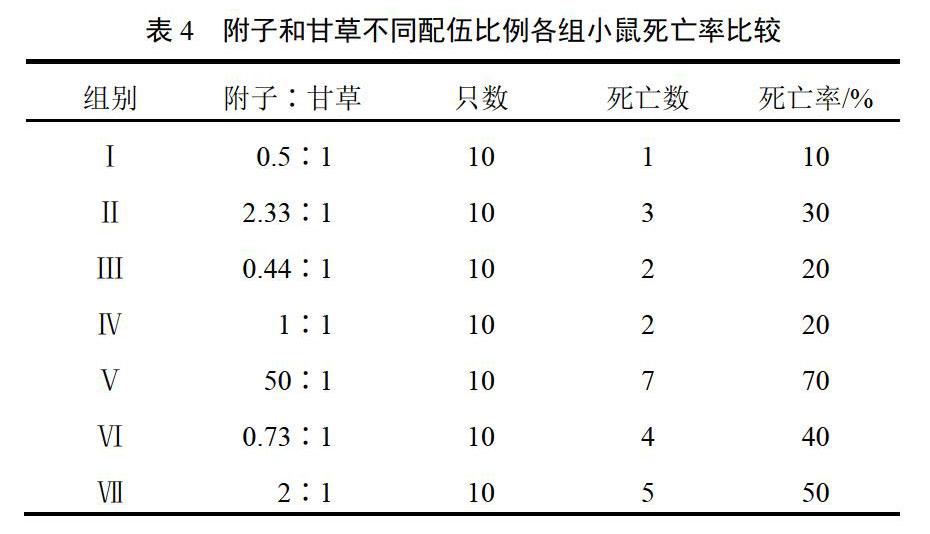
2.4.2 附子、甘草不同配伍比例毒性试验结果
小鼠死亡多发生在给药后0~12 h内,解剖发现肝脏边缘发黄或发黑,部分小鼠脾脏或心脏略有发黑。给药24 h后,无小鼠死亡,小鼠逐渐恢复正常状态。附子、甘草不同配伍比例毒性试验结果见表4,附子、甘草不同配伍比例各组小鼠死亡曲线。结果显示,附子配伍甘草后对小鼠的毒性降低。
2.5 附子、甘草不同配伍比例小鼠死亡率分析
采用SPSS17.0统计软件对均匀试验结果进行多元线性回归分析,建立多元函数及F检验。得多元函数模型Y=70.576-1.635F-1.455G+0.032F2+0.012G2(Y表示死亡率,F表示附子,G表示甘草),应用相关系数R评价函数模型,R=0.985,R2=0.97,调整R2为0.91。该回归方程经F检验,差异有统计学意义(P=0.059),见表5。针对函数模型求偏导数,求得最佳配比为附子∶甘草为0.42∶1。
2.6 附子、甘草最佳配伍比例减毒效果评价
2.6.1 预试验
ICR小鼠16只,雌雄各半,按0.4 mL/10 g体质量计算灌胃体积。各组按设定的剂量分别灌胃给药,找出引起0%死亡率和100%死亡率剂量所在范围。预试验结果表明,附子、甘草最佳配比为0.42∶1,受给药体积和给药浓度限制,无法测出LD50,但小鼠给药后出现毒性反应,故改测MTD。
2.6.2 正式试验
ICR小鼠22只,雌雄各半,适应性观察3 d。实验前禁食不禁水16 h,随机分为2组,对照组7只,给药组15只,按0.4 mL/10 g体质量计算灌胃体积。对照组灌胃给水2次,给药组按附子、甘草最佳配比组灌胃给药2次,给药间隔时间均为6 h。给药后立刻开始观察小鼠神经系统、循环系统、消化系统的毒性反应,记录中毒潜伏期、开始出现死亡的时间、死亡只数等,及时解剖死亡小鼠,记录观察到的变化。14 d后,全部小鼠进行解剖,记录观察到的变化。
2.6.3 附子、甘草最佳配比最大耐受量测定结果
小鼠给药后出现身体颤抖、恶心干呕、行动迟缓的症状,继而精神萎靡、怠动、俯卧不动。小鼠死亡前全身颤抖、怠动无力、呼吸急促。动物死亡发生在第2次给药4 h后,解剖发现肝脏边缘发黄或发黑,部分小鼠脾脏或心脏略有发黑。小鼠第2次给药24 h后渐渐恢复正常。14 d后将所有小鼠处死,解剖,发现部分小鼠胸腔内有瘀血,肝脏、肾脏颜色均较浅。给药组小鼠死亡3只,死亡率为20%。通过计算,得到小鼠日MTD为100 g/kg,MTD倍数相当于体质量60 kg成人临床每日剂量的133.33倍。
3 讨论
附子作为回阳救逆第一要药,在中医临床急危重症的救治中具有非常重要的地位,尤其随着近年“扶阳学派”兴起,附子在临床广泛而大量使用,其剂量的选择常超出药典规定剂量,如何在保持附子药效的同时减少其对机体的毒副作用成为亟待解决的问题。配伍甘草为附子减毒方法之一,关于配伍比例研究在文献中常见的有附子、甘草为1∶1的比例,有部分文献探讨了配伍比例对附子毒性的影响,但仅局限于1∶2、1∶1、2∶1不同比例,而药物比例对复方或药对的药效或毒性的影响作用十分重要。本研究中不同配伍比例的附子、甘草毒性评价结果表明,附子与甘草配伍后,小鼠死亡率降低,且随着甘草配伍比例增加,小鼠死亡率呈现“降升交替”的现象,但整体趋势是下降的。本实验采用均匀设计法对附子、甘草配伍比例对附子毒性进行了优化研究,结果0.42∶1附子与甘草配比为最佳比例;附子与甘草按照0.42∶1配伍使用后,附子毒性大大降低,MTD是附子LD503倍多,且小鼠死亡率低,说明该配比减毒效果好。
本研究发现,附子配伍甘草后小鼠的死亡时间推后,附子单用时,小鼠死亡多集中在给药后4 h内,而配伍甘草后小鼠死亡时间多集中在给药后4~12 h内,说明甘草可缓附子之性急和性毒,符合章津铭[19]从“药理-化学-药代”相结合层面,初步揭示附子配伍甘草“毒减而效不减”作用机制——基于两者煎煮过程,甘草成分与附子毒(效)成分形成复合物而逐渐沉积于汤液底部,在汤液温服条件下游离态和结合态的毒(效)成分均进入机体,结合態成分在胃肠道中缓慢释放,从而实现毒(效)组分的不同步吸收,“缓吸收之急而解其毒,延吸收之时而增其效”。中毒死亡小鼠解剖结果显示,附子对肝脏、心脏、脾脏具有毒性,尤其肝脏。肝脏是体内重要的代谢器官,含有大部分代谢酶,其中CYP3A4为乌头碱、新乌头碱、次乌头碱的主要代谢酶。有研究表明,附子水煎液对大鼠CYP3A4有诱导作用,从而使CYP3A4被酶解,影响肝脏代谢[20],这也可以解释中毒死亡的小鼠为何肝脏边缘发黄发黑。
参考文献:
[1] 国家药典委员会.中华人民共和国药典:一部[M].北京:中国医药科技出版社,2015:191-192.
[2] 张金莲,曾昭君,张冰,等.附子临床不良反应分析[J].中国实验方剂学杂志,2014,20(18):228-230.
[3] 常吉梅,常娟.附子减毒与药效探析[J].中医学报,2012,27(9):1168- 1169.
[4] 考玉萍,张化为.大剂量食用附子安全性和有效性研究[J].陕西中医, 2013,34(4):478-480.
[5] LI S , LI F, LI Y, et al. A review of traditional and current methods used to potentially reduce[J]. Journal of Ethnopharmacology, 2017,207:237-250.
[6] ZHOU G H, TANG L Y, ZHOU X D, et al. A review on phytochemistryand pharmacological activities of the processed lateral root of Aconitum carmichaelii Debeaux[J]. Journal of Ethnopharmacology, 2015,160:173-193.
[7] 章津铭,傅超美,何宇新,等.附子-甘草配伍前后汤液中沉积物的化学组分对比研究[J].中草药,2013,44(2):165-169.
[8] 陈秋薇,章津铭,季宁平,等.附子-甘草药对配伍前后汤液相态对比研究[J].中国实验方剂学杂志,2014,20(2):92-95.
[9] 缪萍,裘福荣,曾金,等.甘草诱导CYP3A促进附子代谢的减毒配伍机制[J].中华中医药杂志,2014,29(9):2813-2817.
[10] 王芳.附子与干姜、甘草配伍使用后乌头碱含量的变化研究[J].中医临床研究,2014,6(25):22-25.
[11] 王云.黑附子及配伍甘草、干姜对小鼠致死毒性随机平行对照研究[J].实用中医内科杂志,2014,29(4):68-70.
[12] 李莹,傅超美,彭伟,等.四逆汤中甘草减附子之毒的代谢组学研究[J].中国中药杂志,2016,41(8):1523-1529.
[13] 李莹,傅超美,任波,等.基于MI-RI大鼠心肌细胞代谢组学研究四逆汤中附子配伍甘草解毒增效机制[J].中国中药杂志,2014,39(16):3166-3171.
[14] 王利勤,张宇燕,何昱,等.附子、甘草有效成分不同配伍比例对H9c2心肌细胞缺氧缺糖损伤的影响[J].中医杂志,2016,57(15):1327-1330.
[15] 周天梅,杨洁红,万海同,等.附子甘草主要成分配伍对乌头碱致大鼠传代细胞损伤的保护作用[J].北京中医药大学学报,2014,37(1):22-26.
[16] 解素花,张广平,孙桂波,等.附子与甘草不同配伍比例配伍减毒的实验研究[J].中国中药杂志,2012,37(15):2210-2213.
[17] 张丹,叶强.附子配伍不同甘草炮制品及其比例的研究[J].中国医院药学杂志,2013,33(11):1102-1104.
[18] 王英豪,吴水生,李德森,等.基于均匀设计法的钩吻配伍玉叶金花的毒性作用规律研究[J].中国现代应用药学,2016,33(2):150-154.
[19] 章津铭.基于毒(效)组分“体外沉积、体内缓释”环节的附子-甘草配伍减毒作用机制研究[D].成都:成都中医药大学,2012.
[20] 张广平,朱丽君,周娟,等.附子配伍甘草对CYP3A4体内活性的影响研究[J].中国中药杂志,2012,37(15):2206-2209.

