内镜活检Crohn病的临床病理分析
黄薇杨通关晓颖
1广州医科大学附属第二医院病理科(广州 510260)
2广州医科大学基础医学院生物医学工程(广州 511436)
Crohn病(Crohn disease,CD)是一种炎症性肠病,临床相对较少见,临床主要表现为发热、右下腹部包块、腹痛、腹泻、便血伴右下腹压痛及肠梗阻等,表现不具有特异性,故误诊率较高,患者病情反复,多次间断性急性发作,有些患者忍受疾病多年的折磨和困扰,故早期诊断及治疗尤为重要[1-2]。
本课题收集12例CD的临床资料、肠镜、病理组织学检查和免疫组化进行回顾性分析,以探讨内镜下活检标本CD的临床病理特征,为CD正确诊断和鉴别诊断提供可靠依据。
1 资料与方法
1.1 临床资料
收集广州医科大学附属第二医院番禺院区病理科2012年1月—2018年9月CD标本12例,患者中男10例,女2例;年龄:32~67岁,中位年龄60岁。发生部位:回盲部6例,回肠末段受累6例,乙状结肠受累2例,右半结肠1例,直肠1例。临床主要表现反复腹泻、血便、腹胀腹痛,伴头晕、乏力、心慌等。肠镜表现不规则黏膜充血水肿,见糜烂,多个散在不规则分布的溃疡灶,覆白苔,个别病例伴肠管狭窄,肠腔内见脓血性分泌物,质脆,易出血及肛瘘,类似于溃疡性结肠炎的表现。
1.2 试剂与方法
标本经质量浓度为100 g/L的中性福尔马林固定,石蜡包埋,4μm切片,HE染色,光学显微下观察,并对石蜡切片采用EnVision免疫组化二步法染色。抗体CD68、D2-40、S100均购自神州迈新生物技术开发公司,使用已知阳性切片作阳性对照,PBS代替一抗作阴性对照,具体检测步骤按抗体产品说明书上进行。
1.3 结果判断
以细胞浆、细胞膜或和细胞核上出现棕黄色颗粒且染色强度高于背景的非特异性着色者为阳性细胞。CD68定位于胞浆、D2-40定位于浆/膜,S100定位于胞核/浆。
2 结果
2.1 肉眼观
组织为灰白灰红破碎组织数粒,直径0.2~0.3 cm。
2.2 镜检
组织学特征:黏膜层至黏膜下层均为重度炎症,且分布不均匀,淋巴组织高度增生,黏膜面见裂隙样溃疡(图1),溃疡内壁为炎性渗出物及肉芽组织,黏膜上皮局灶脱失,非干酪样坏死性肉芽肿(图2),黏膜固有层及黏膜下层见较多扩张的淋巴管,黏膜下层神经纤维增生(图3),所有组织的病理切片均经两位具有高级职称医生阅片。

图1 黏膜裂隙性溃疡(黄色箭头所指)、黏膜层重度炎症(蓝色线跨越区域)(HE×50)
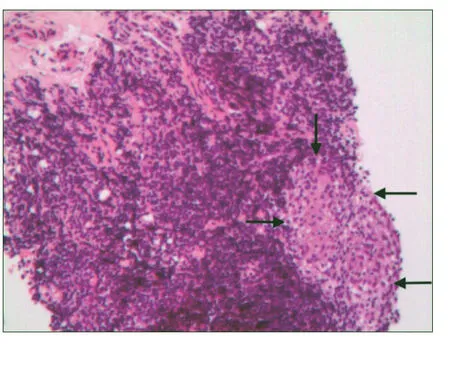
图2 黏膜下层非干酪样坏死性肉芽肿(黑色箭头所指),伴于生发中心中,周围重度炎症(HE×50)

图3 黏膜下层扩张的淋巴管(黑色箭头所在位置),神经纤维增生(黄色箭头所指)(HE×200)
2.3 免疫组化结果
12例CD均表达CD68(图4),D2-40(图5)及S100(图6)。
2.4 内镜所见
多灶性溃疡,呈跳跃式分布,水肿,息肉,狭窄,典型的鹅卵石样改变现在很少能见到。
3 讨论
3.1 发病状况
CD是一种进展缓慢的亚急性与慢性肠道全层肉芽肿性炎症性疾病,病变呈节段性分布,可侵犯胃肠道任何部位[3-4],常同时侵犯多个部位,最常累及回盲部,然后依次为回肠末端,弥漫性小肠受累和孤立性结肠病变[5],临床表现多样化,病情反复,多次间断性急性发作。近年来有研究显示CD发病率在亚洲呈逐年上升趋势。
3.2 病因与机制
CD病因未明,根据最新ECCO专家评议[6],认为吸烟[7]、维生素D缺乏[8]、口服避孕药[9]、剖妇产[10]、阑尾和扁桃体切除术[11]、季节变化[12]等可能是CD发病的危险因素,持续吸烟会加重疾病、影响治疗,戒烟会改善预后;维生素D缺乏会影响疾病的发生及发展过程,但机制不明;而对于已患CD的患者,避孕药并不会增加疾病恶化的风险等。

图4 CD68示黏膜下层非干酪样坏死性肉芽肿(黑色箭头所指的棕黄色区域),伴于生发中心中(IHC×50)

图5 D2-40示黏膜下层扩张的淋巴管(箭头所指处的棕黄色区域)(IHC×50)

图6 S-100示黏膜下层增生的神经纤维(箭头所指处的棕黄色区域)(IHC×50)
3.3 临床表现
患者病灶部位、范围和胃肠道受累的严重程度不同,临床症状也不同,CD患者最常累及的病变部位是回盲部,症状类似于阑尾炎的症状,右下腹部疼痛;其次为末段回肠,表现为反复腹泻、血便;当孤立性小肠受累时,表现为食欲不振、早饱感,餐后腹部绞痛,腹泻,体重减轻等;当结肠受累时,表现为腹泻、痉挛、里急后重及便血和(或)黏液等症状,须与溃疡性结肠炎、肠结核、急性阑尾炎等疾病相鉴别。因患者症状和体征通常不明显,临床症状又没有特异性,常常从症状出现后数月甚至数年才确诊,有研究显示[13],932例CD患者从症状出现到确诊的中位延迟时间为9个月,75%的患者在2年内确诊,年龄<40岁、病变只累及回肠的患者诊断时间往往延误时间更长。由此可见,早期诊断减少诊断延误时间,早期治疗对于患者至关重要。
3.4 诊断
对于切除标本,光学显微镜下显示:①全层炎,②局灶深裂隙样溃疡,③黏膜层尤其黏膜下层淋巴组织增生、淋巴滤泡形成,④黏膜下层水肿增宽,淋巴管扩张,神经组织增生,⑤浆膜炎,⑥部分病例可见肉芽肿及淋巴小结形成。然而这种全切标本并不常见,对于早期的患者常常会因不适就医,常常只做活检。因此,在日常诊断工作中,接触到的绝大多数是活检标本,因取材较局限,一般只能取到黏膜层及黏膜下层,缺乏肠壁肌层及外膜,或未能取到特征性病变或只取到溃疡处没有黏膜组织,所以给诊断带来一定的困难。本研究8个病例均为活检标本,最深的取至黏膜下层(如图1~3),其在光学显微镜下通常显示:炎症分布不均匀性,炎症以基底部及黏膜下层炎症为重,中性粒细胞主要浸润固有膜,隐窝累及不明显,可见裂隙样溃疡,尤其是黏膜下层淋巴组织增生,伴淋巴滤泡形成;黏膜下层高度水肿增宽,淋巴管扩张,神经组织增生,局灶纤维化,可见血管炎;其中非干酪样坏死性肉芽肿(结节病样)对CD具有重要诊断价值。而非干酪样坏死性肉芽肿(结节病样):一定是在不太可能发生异物肉芽肿的、远离溃疡的组织中发现,才具有诊断意义,此种肉芽肿小而独立,为非干酪样坏死,常常位于淋巴滤泡的生发中心中,本研究病例如图4显示CD68标记的棕黄色区域,周围伴有重度炎症,炎症不均匀且多位于黏膜固有层深层。在内镜活检标本中不易检出,我们通过连续切片提高了肉芽肿的检出率,我们研究的病例均可见肉芽肿,当然这要与黏液肉芽肿等其他肉芽肿区分开来。肉芽肿大约只见于60%病例[5],对于不出现肉芽肿的病例,要认真寻找其它特征,如淋巴管扩张及神经组织增生、黏膜下层的水肿、增宽,杯状细胞和腺体和杯状细胞的保留等,对于可疑淋巴管及神经组织增生的也可以通过免疫组化D2-40(图5)及S-100(图6)标记,这些都是提示可疑CD的线索,对病理医师提供有价值的信息,当然作诊断同时要结合临床症状如上消化道累及和肛门周围病变、瘘管等临床表现、内镜所见、影像和/是或生化检查及病原学等综合信息。
因CD是一种长期慢性疾病,会导致广泛腺体隐窝结构的破坏及大量炎症细胞浸润,及一些不典型的结构特征,如正常黏膜、不连续炎症和直肠缺乏病变这种多形态的特征,而显微镜下又找不到肉芽肿时,为了避免误诊,2012年ECCO-ESP声明提出组织学正确评估诊断,需要内镜进行标准多次多点活检[14]。2016年ECCO对CD诊断和治疗共识意见[15]:对于初步诊断,不是一处活检就能得出最可靠地诊断,而是通过全结肠镜检的多处活检,较好的活检样本既包括CD累及部分也包含未累及部位,为可靠地诊断CD,应在整个结肠(包括直肠)和回肠5个部位,每个部位至少取2次活检,内镜下未见异常的黏膜也应取活检,且要避免只取溃疡处;而在随访检查中,少量的活检样本即有助于确立诊断。
因此,对于内镜活检的小标本,在光学显微镜下对CD做出正确可靠的诊断非常困难,这不仅要求病理医师在诊断方面有较高的专业水平,丰富的诊断经验,更需要多方面良好合作,如临床内镜医师及技术人员对标本的处理都是至关重要的,这就要求临床内镜医师活检后,将标本平铺在滤纸上,使标本正确定位,病理医师取材时也保持黏膜的正确方向,技术人员进行组织包埋时,建议每个蜡块最多包埋2块组织,并将黏膜下层向下定向包埋,这样切片中的黏膜隐窝腺体呈直管平行排列,垂直于黏膜肌层之上,即保持肠黏膜正常的组织学关系,且推荐在切片时对每个蜡块做标本最大面的多个切面的连续性切片,这种多方面的合作,才能保证最后的高正确诊断率。当然病理诊断医师在做病理诊断前,要详细了解患者的临床信息,包括患者年龄、病程、治疗情况、并发疾病、旅行信息、内镜活检术前有无使用泻药灌肠等。
3.5 鉴别诊断
内镜下活检诊断时要与其他疾病相鉴别:①溃疡性结肠炎(UC):UC和CD患者虽然有许多相似之处,但同样存在显著的不同点,UC是一种从直肠开始,连续性、弥漫性疾病,显微镜下炎症主要位于黏膜层和黏膜下层,炎症分布均匀,黏膜固有层内淋巴细胞及浆细胞较多见,活动期常见特征性改变如隐窝炎,隐窝脓肿,黏膜表面糜烂、表浅溃疡形成及肉芽组织增生,隐窝结构改变,包括隐窝大小、形态和排列均发生改变,黏膜上皮常见绒毛状改变及Paneth细胞化生,腺体杯状细胞减少,最重要的是常缺乏结节病样肉芽肿,黏膜充血显著,但淋巴组织增生罕见,不伴黏膜下层水肿、纤维化和神经瘤样增生,裂隙和窦道缺乏,通常不存在黏膜下层局灶淋巴组织聚集,位置较深时更不考虑此病,罕见阿弗他溃疡[16-17]。②肠结核:内镜下结核性溃疡多为环形狭窄或“跳跃式”损害,酷似CD,虽其长径与肠长轴垂直,但实际内镜下很难看到典型的病变,只有在光镜下发现结核杆菌或干酪样坏死方是诊断此种病变的金标准[18]。当然做出正确可靠的诊断不仅仅只依靠病理光镜下所见,同时需结合病史、临床症状、内镜、影像学及病原学等检查,如肠结核时,结合抗酸染色、TB-DNA分子检测、PPD试验等检查,虽然其敏感性有限,但不应忽视,即使结果阴性,也不能排除结核,应注意积极询问病史,临床有无使用激素及免疫调节剂等药物干扰其检查结果。当然还有许多疾病要与之相鉴别,相较于这两种疾病,通过临床症状、影像及其它实验室检查,很容易区分开来。
总之,要对CD做出正确诊断,仅凭一次活检就做出病理诊断是不可靠、也是不可取的,要对不同部位多次活检,包括病变部位及未受累部位,且要病理结合内镜、临床、影像、生化、病原微生物等其他实验室检查,通过多方面合作,综合对内镜活检标本做出诊断才是最可靠的[19-20]。

