遮光对香果树幼苗光合特性及叶片解剖结构的影响
李冬林,王 火,江 浩,祝亚云,金雅琴,崔梦凡
1 江苏省林业科学研究院, 南京 211153 2 金陵科技学院园艺学院, 南京 210038
植物在长期的进化过程中,由于不同植物接收的太阳辐射量存在着明显差异,因此形成了自身特有的需光特性[1]。强光直射和夏季高温、高湿是许多阴性植物幼苗期生长的主要限制因子,并成为幼苗能否顺利越夏、完成自我更新的关键。研究表明,高等树木生命周期中的幼年期对光照和高温的忍耐和需求程度有很大的差别,并直接影响到树木生命周期的延续和正常的更新演替[2]。对于绝大多数喜光树种而言,如枫香(Liquidambarformosana)[3]、灯台树(Bothrocaryumcontroversum)[4]、栓皮栎(Quercusvariabilis)[5]等,幼年期生长对强光具有一定的需求和喜好,弱光下不利于其正常的生长发育;而另一部分树种则较为耐阴,如中华蚊母树(Distyliumchinense)[6]等,遮光可促使其自身形态结构的调整,如增加株高、叶长和叶宽和降低比叶质量等,以及叶片光合生理的调整来适应低光量子密度的小环境,适度遮光反而有利于自身的生长和繁衍。因此,研究树木幼年期对光照的需求和适应性,特别是一些珍贵濒危树种的光合特性,将有助于濒危物种保育过程中采取合理的经营措施提高幼苗的竞争力和保存率,对促进种群完成自然更新具有重要意义。
香果树(EmmenopteryshenryiOliv.)是茜草科(Rubiaceae)香果树属植物,我国特有单种属。由于其自然更新能力差,加上环境恶化和人为破坏等因素的影响,该物种已濒临灭绝,被列为国家Ⅱ级重点保护珍贵稀有野生植物[7]。在我国,香果树广泛分布于西北、华北、华东、华中及华南、西南等省[8],但多零星分布,成片资源很少。由于大规模的旅游开发和人为干扰的影响,资源趋于枯竭,濒临灭绝,急需采取人为措施予以保护和拯救。特别是近几年原本认为当地已经灭绝的香果树野生种群在江苏溧阳深溪岕再次被发现[9],但林下幼苗很少,更新不良,引起当地政府和植物专家的极大关注。目前对香果树的研究主要集中在种群结构与群落特征[10-13]、开花及繁育生理[14-16]、种子萌发生理学[17]等方面,而对其幼苗培育和更新紧密相关的光环境适应性生理文献较少。郭连金等[18]研究了不同生境(冠下、冠缘、林窗和林缘)中2年生香果树实生苗的光合速率、水分利用效率、叶绿素、幼苗生长及生物量等因子的变化及其与生态因子的关系,但林内透光率稳定性差,据此推测香果树的耐荫性具有一定的局限性。本文以2年生实生幼苗为研究对象,通过人工遮光创造了不同梯度的光环境,对叶片光合作用指标进行了动态研究,分析了遮光环境下香果树幼苗的光合作用特征和叶片解剖结构的适应性变化,旨在深刻认识香果树的光适应机制,为香果树的幼苗繁育和苗期管理提供一定的科学性建议和指导。
1 材料与方法
1.1 试验地自然条件
试验地位于江苏省林业科学研究院实验林场(南京市江宁区东善桥,东经118° 46′ 37′,北纬31° 51′ 25′)。地处北亚热带的边缘,季风气候,年均气温16.1℃,极端最高气温43.0℃,极端最低气温-14.0℃,年相对湿度78%—80%,年均降雨量1116.3 mm,年均日照时数1912.8 h,无霜期224 d。土壤类型为山地黄棕壤,pH值6.8。
1.2 试验材料与设计
供试材料来自湖北省宜昌市五峰县,为生长健壮、规格一致的2年生香果树实生苗(平均苗高75 cm,平均地径11.8 mm)。试验苗圃经全垦、整平后作高床,南北走向,床面宽120 cm,长45 m,步道宽25—30 cm,床面高出步道25 cm。幼苗于2018年3月定植于苗床,株距30—35 cm,行距40—45 cm。幼苗经过3个月的缓苗生长后,当年6月20日用黑色遮阳网进行遮光处理。遮荫棚南北设置,棚高2.0 m,两边覆盖苗床并延伸到地面,南北敞开,便于通风透气。试验设4个处理:一层遮荫(L1,辐射强度相当于全光照60%)、二层遮荫(L2,辐射强度相当于全光照25%)、三层遮荫(L3,辐射强度相当于全光照10%),全光照(L0,辐射强度100%)为对照处理。采用单因素随机区组设计,选择30株植株作为试验小区,重复3次,挂牌标记。不同处理间留有1.5 m的保护行,以免交叉遮光。苗期正常抚育,确保不同处理间栽培技术措施一致。
1.3 测定指标与方法
1.3.1光合作用指标测定
8月份选取连续晴朗的白天进行光合作用日变化测定,连续测定3天。不同处理选择发育完好的幼苗植株各3株,每株选择3片位置相当、发育成熟的功能叶(顶端第4片)作为测定叶(叶柄涂标)。测定期最高气温36.8℃,最低气温27.8℃,最高辐射光强1740 μmol m-2s-1。测定时间7:00—18:00,每隔1 h用LI—6400型便携式光合仪测定1次,每次测定20—30 s。采用自然光源,标准叶室(2×3 cm2),测定指标有:净光合速率(Pn)、蒸腾速率(Tr)、气孔导度(Gs)、气孔限制值(Ls)、胞间CO2浓度(Ci)、蒸汽压亏缺(Vpdl)。其中气孔限制值Ls= 1-Ci/Ca。同时记录瞬时环境参数:光合有效辐射(PAR)、气温(Ta)、大气相对湿度(RH)、CO2浓度(Ca)等。
光响应(Pn-PAR)曲线的测定参考文献[19],利用LI-6400光合仪配备LED红蓝光源。测定时间为上午9:00—11:30。选取预先标记的叶片,测定前对其进行30—45 min的光诱导(1000 μmol m-2s-1)。使用CO2注入系统控制CO2的浓度(400 μmol/mol),叶室温度28℃,相对湿度65%。光强梯度设定为2000、1500、1200、800、600、400、200、150、100、50、0 μmol m-2s-1。Pn-PAR曲线拟合采用非直角双曲线模型[20-21],获得不同遮光处理下的暗呼吸速率(Rd)、最大净光合速率(Pmax)和表观量子效率(AQY)。光补偿点(LCP)和光饱和点(LSP)利用低光条件下(PAR≤200 μmol m-2s-1)的Pn与PAR构建线性方程进行估算,Pn=m×PAR+n,LCP =-n/m,LSP = (Pmax-n)/m[22-23]。式中,m、n为拟合线性方程中的待定系数。
1.3.2叶片解剖结构的观察
叶片解剖实验于9月下旬进行,参照李正理(1987)的方法制作石蜡切片[24]。摘取叶片后沿中脉横切,切块约5 mm×5 mm,用FAA固定,乙醇和二甲苯系列脱水,石蜡包埋,番红-固绿染色,中性树胶封片。切片在OLYMPUS-BX61光学显微镜下观测并拍照,借助图形分析软件Image-Pro Plus 6.0测量各微观参数。测定指标有:上表皮细胞厚度(UET)、下表皮细胞厚度(LET)、叶片厚度(LT)、栅栏组织厚度(PT)、海绵组织厚度(ST)、栅栏组织和海绵组织厚度比(PT/ST)、栅栏组织密度(PD)、导管数目(VN)、导管直径(VD)等。取30个视野测定统计各指标参数。
1.3.3叶片气孔结构的观察
采用指甲油印膜法取叶片中间部分(避开叶脉),用镊子撕取表皮制成临时装片,在生物显微镜下观察,并用数码显微摄影系统拍照。应用Image-Pro Plus6.0测量气孔密度(SD)、气孔器长度(SL)、气孔器宽度(SW)。SD=视野内气孔个数/视野面积。单个气孔器的面积(AS)依据以下公式推算:AS=π×SL×SW/4,π=3.14;气孔器面积百分比At(%)=AS×SD×100[25]。每个处理取30个视野统计指标值。
1.4 数据处理
所有测定数据均采用平均值±标准差(Mean ± SD)的形式表示,应用Excel 2003作图,SPSS17.0进行方差分析,多重比较采用最小显著极差法(LSD法)。
2 结果与分析
2.1 遮光条件下试验区环境参数的差异
图1可见,不同遮光条件下的环境参数均存在显著差异(P<0.05),并形成一定的梯度变化。从PAR的变化来看,对照区在中午11:00—13:00时PAR最为强烈,最高值达1694 μmol m-2s-1,而遮光条件下PAR则显著下降,尤以中午前后差距最大。不同处理下的Ta呈现与之相似的动态变化,但有一定的波动,并且遮光处理下的Ta显著低于对照。Ca和大气中RH的日变化相反,有一定波动,但总体呈现先降后升的态势,并在14:00—16:00时降至最低。L3处理的Ca和RH显著高于L1、L2和对照(P<0.05)。可见,遮光影响了幼苗生长的小环境,有利于维持地表大气中的CO2浓度和水分含量,进而影响幼苗的正常生长、生理活动。

图1 不同遮光条件下的环境参数变化Fig.1 Change of environment alparameters under different shading treatments
2.2 遮光对香果树幼苗光合作用参数的影响
2.2.1遮光对净光合速率(Pn)的影响
不同光环境下香果树叶片Pn的日变化趋势显著不同(图2)。全光和L1处理下Pn呈明显的双峰曲线,中午12:00时出现了明显的“午休”现象。L2处理在9:00时Pn最高,随后开始缓慢下降,而L3处理的Pn变化曲线相对平缓,没有出现“午休”,Pn极值出现在中午12:00时(3.38 μmol m-1s-1)。从不同处理Pn相比较而言,全光下7:00—9:00时间内Pn高于其他处理,但9:00时以后Pn下降;而L1处理下Pn在上午一直保持增高的趋势,并逐渐超过全光照和其他处理的测定值,这种趋势一直持续到中午11:00时。13:00—15:00时间内,L1处理下Pn一直高于其他处理。下午15:00时以后,所有处理的Pn均明显下降,尤其是在18:00时,L3处理下Pn出现了负值,为试验Pn最低值。就Pn日均值比较,其大小排序为L1>L0>L2>L3(表1)。方差分析表明,不同遮光处理下Pn日均值有显著差异(P<0.05)。
2.2.2遮光对气孔导度(Gs)的影响
一般而言,气孔导度(Gs)反映了大气CO2和水汽与植物叶片传导、交换能力的高低。据研究,气孔导度对环境因子的变化十分敏感,凡是影响植物光合作用和叶片水分状况的各种因素都有可能对气孔导度造成影响[26-27]。由图2可见,不同处理下Gs日变化规律基本一致。11:00时之前不同处理叶片Gs较高,后期基本趋于下降,这种趋势与Pn的日变化基本相似,说明香果树光合作用中Gs与Pn具有一定相关性。从整个Gs日变化进程来看,除了中午12:00和18:00时之外,其他时间段里L1处理的Gs一直高于其他处理,说明一层遮光的光强有利于香果树气孔的调节,并有利于光合作用效率的提高。L0处理的Gs在9:00时之前都是逐渐升高的,但之后明显下降,13:00时以后一直处于低位变化。L2处理的Gs中午之前出现了2次高峰期(10:00、12:00时),12:00时后Gs一直很低;L3处理的Gs在10:00时之前上升,但之后开始缓慢下降。Gs的日均大小排序为L1>L0>L2>L3。方差分析表明,不同处理间Gs日均值有显著差异(P<0.05),但L1、L2与L0之间差异不显著(表1)。
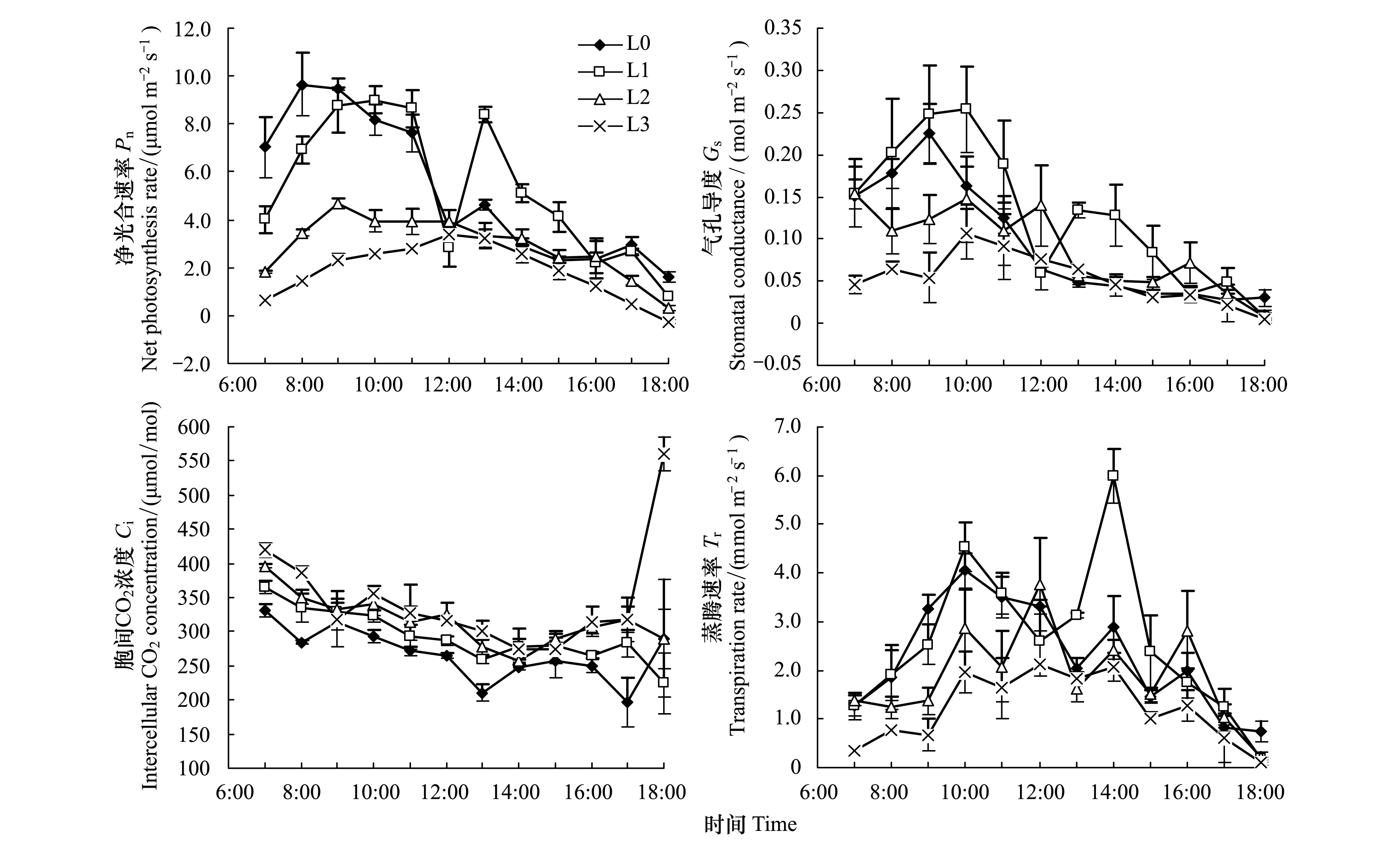
图2 不同遮光处理下香果树幼苗净光合作用速率(Pn)气孔导度(Gs)、胞间CO2浓度(Ci)、蒸腾速率(Tr)的日变化Fig.2 Diurnal variation of net photosynthesisrate (Pn),stomatal conductance (Gs), intercellular CO2 concentration (Ci) and transpiration rate (Tr) of E. henryi seedlings under different shading treatments
2.2.3遮光对胞间CO2浓度(Ci)的影响
不同光环境下Ci的日变化趋势相似,尽管存在一定的波动,但基本上呈缓慢降低、后期抬升的趋势(图2)。不同处理Ci的日均大小顺序为L3>L1>L0>L2(表1)。方差分析表明,不同处理间Ci日均值差异显著(P<0.05)。由于L3处理为强度遮光,17:00时以后光照强度已经很低,并出现负值,而Gs很低,CO2同化率低,致使较多CO2积聚在细胞间,导致Ci后期的急剧上升。
2.2.4遮光对蒸腾速率(Tr)的影响
不同光环境下幼苗的Tr的日变化见图2。就日均Tr的比较而言,L1>L0>L2>L3(表1),但L1与L0间差异不显著,L0与L2、L3处理有显著差异(P<0.05)。与Pn的日变化相似,Tr的日变化也呈现出双峰波动。由于光照强度的不同,L0和L1处理双峰出现在10:00和14:00时,而L2处理双峰推迟出现在12:00和16:00时;L3处理双峰趋势不明显。
2.2.5遮光对气孔限制值(Ls)的影响
不同光环境下Ls的日变化见图3。Ls呈现不明显的弧形变化趋势。从各个时间段Ls的比较来看,全光下的Ls一直大于遮光条件下的Ls测定值;尽管Ls一直处于波动变化之中,但从其日均变化而言,L0>L1>L2>L3(表1)。方差分析表明,不同处理间Ls日均值有显著差异(P<0.05)。L3处理在18:00时,外界光照强度的严重不足导致了Ls迅速下降。
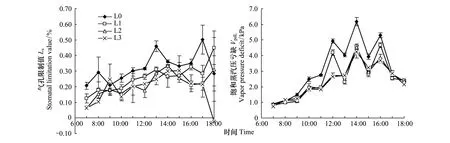
图3 不同遮光条件下香果树幼苗气孔限制值(Ls)与饱和蒸气压亏缺(VpdL)的日变化Fig.3 Diurnal variation of stomata limitation value (Ls) and saturated vapor pressure deficiency (Vpdl) of E. henryi seedlings under different shading treatments
2.2.6遮光对蒸汽压亏缺(Vpdl)的影响
图3可见,不同光环境下幼苗的蒸汽压亏缺(Vpdl)的日变化呈现先升后降的弧形变化,即下午14:00时之前,各处理Vpdl基本上都是上升的,14:00时后,各处理Vpdl基本上都是下降的,但有明显的波动。方差分析表明,不同处理间日均Vpdl有显著差异(P<0.05)(表1)。全光下气温快速升高,Tr迅速增大,致使叶片内Vpdl急剧上升,使得全光下Vpdl高于遮光下的Vpdl。遮光降低了林内光强,缓和了水分蒸腾,降低了Vpdl。

表1 不同遮光条件下香果树幼苗光合作用参数的日均值
不同小写字母表示两种处理间差异达显著水平(P<0.05)
2.3 遮光对香果树幼苗光响应参数的影响

图4 不同遮光条件下香果树幼苗Pn-PAR光响应曲线 Fig.4 Photosynthesis-light response curve of E. henryi seedlings under different shading treatments
不同光环境下香果树幼苗的光合-光响应(Pn-PAR)曲线见图4。可见,当光合有效辐射(PAR)≤200 μmol m-2s-1时,各处理Pn均随PAR的增加而迅速增加;当PAR>200 μmol m-2s-1时,Pn随PAR的增加变幅逐渐减缓;当PAR>400 μmol m-2s-1后,Pn趋于稳定,呈现光饱和。所以,不同处理香果树幼苗的Pn-PAR曲线的趋势一致,但变动幅度显著不同。Pn-PAR曲线的拟合参数见表2。
从表2可以看出,不同光环境下香果树幼苗的Pmax、LCP、LSP、Rd和AQY均存在显著差异(P<0.05)。遮光处理显著降低了幼苗的LCP和LSP,L1、L2、L3处理下LCP分别为全光下LCP的0.94、0.78、0.12倍;而L1、L2、L3处理的LSP分别为全光下的0.92、0.90、0.62倍,说明遮光使得幼苗能充分利用弱光,维持自身光合作用的需要。从Pmax的变化来看,L1处理的Pmax显著大于L0、L2、L3(P<0.05)。另外,与全光照(L0)相比,L1提高了Rd(3.56 μmol m-2s-1),但L2和L3则降低了Rd(分别为0.91、0.67 μmol m-2s-1),不同处理间差异显著(P<0.05)。AQY的变化与Rd相似,L1处理下AQY最大(0.09 μmol/μmol),其次为L0,而L2处理下的AQY最低(0.03 μmol/μmol)。以上分析表明,香果树幼苗的光合作用效率在轻度遮光(L1)下得到一定促进,但在中度(L2)和重度遮光(L3)条件下受到明显抑制。
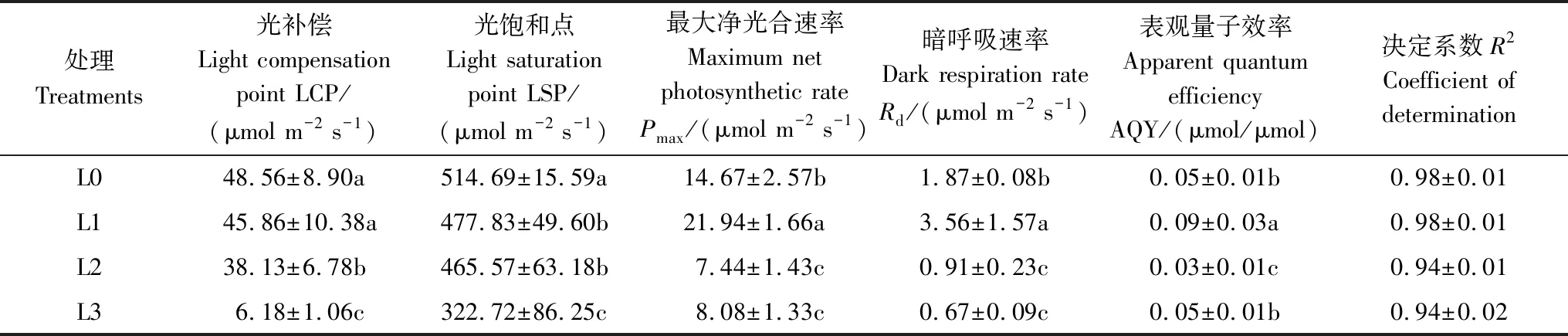
表2 不同遮光条件下香果树幼苗Pn-PAR光响应曲线的特征参数
2.4 遮光对香果树叶片解剖结构的影响
2.4.1遮光对香果树叶片气孔特征参数的影响
表皮切片观察发现,香果树上表皮未发现有气孔分布,而下表皮气孔分布明显(图5),统计其微观参数见表3。结果显示,遮光对叶片气孔密度(SD)、气孔器长度(SL)、气孔器宽度(SW)、单个气孔器面积(AS)、单个气孔器面积百分比(At)均有显著影响。从SD的变化来看,全光下SD最大(53.57个·mm-2),并显著高于遮光处理(P<0.05),但L2与L3处理间无显著差异;SL、SW与AS三者的变化趋势一致,即遮光下的测定值显著低于对照(P<0.05),而以L1处理的指标值最大,L1与L3处理均存在显著差异(P<0.05),但L1与L2,以及L2与L3之间差异不显著。At也是以全光下的指标最高(9.53%),并显著高于遮光下的测定值(P<0.05),说明遮光引起了香果树叶片气孔器的分布、密度与单个气孔器面积的适应性变化。
2.4.2遮光对香果树叶片显微结构的影响
香果树为典型的两面叶植物,叶片有明显的上表面和下表面之分(图6)。上下表面均分布有表皮细胞(EP),上表皮下分布有栅栏组织(PT)和海绵组织(ST),ST中分布有维管束。由图6可见,遮光改变了香果树叶片的组织结构及比例。全光下,香果树叶片较厚,上表皮细胞厚度(UET)小,PT分布紧密且厚度大;遮光处理后,UET略有增加,细胞变的松散,下表皮细胞厚度(LET)和叶片厚度(LT)均明显变小,PT高度降低,ST欠发达,PT/ST相应增加(表4)。
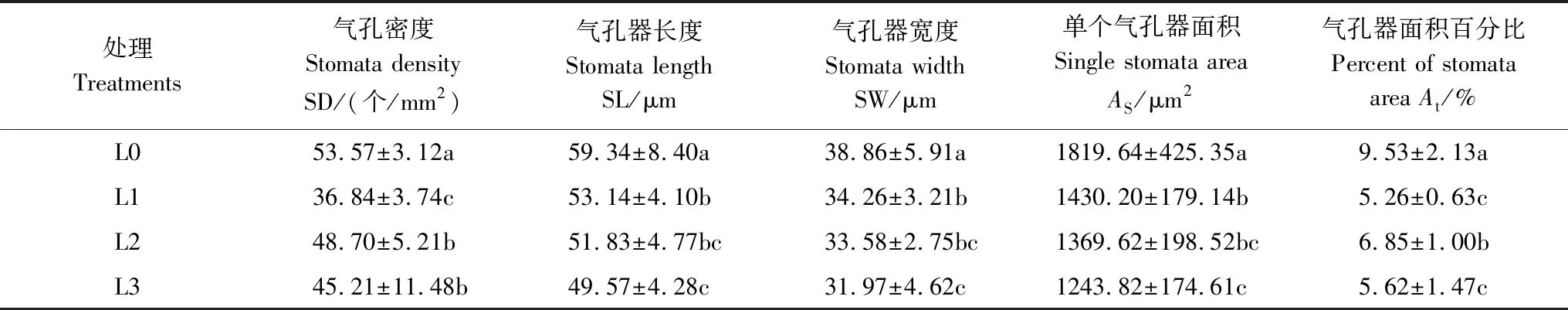
表3 不同遮光条件下香果树叶片的气孔特征
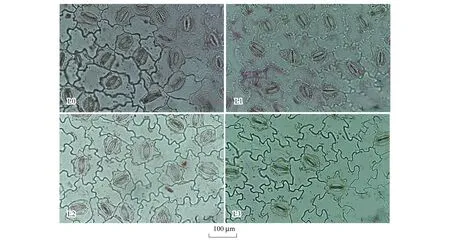
图5 不同遮光条件下香果树幼苗叶表面气孔分布Fig.5 Stomatal distribution on leaves of E. henryi seedlings under different shading treatments
表4 不同遮光条件下香果树叶片横切面结构特征参数
Table 4 The cross section structure parameters ofE.henryileaves under different shading treatments

处理TreatmentsL0L1L2L3叶片厚度Leaf thickness (LT)/μm359.93±17.73a295.35±37.00b252.10±18.67c256.02±19.94c上表皮厚度Upper epidermal thickness(UET)/μm38.29±3.60b41.79±7.28a47.03±3.86a39.37±7.40a下表皮厚度Lower epidermal thickness(LET)/μm28.63±3.43a14.81±3.87b16.39±4.86b16.08±5.11b栅栏组织厚度Thickness of palisade tissue(PT)/μm65.37±9.82a74.48±7.57a55.77±3.94b52.98±5.34b栅栏细胞密度Palisade cell density(PD)/(个/1000μm)46.38±5.62a34.63±2.26b34.52±2.81b32.37±3.13b海绵组织厚度Thickness of sponge tissue(ST)/μm227.62±21.31a164.25±29.87b132.90±17.37c147.58±19.22c栅栏组织和海绵组织厚度比PT/ST0.29±0.06b0.46±0.07a0.42±0.04a0.36±0.08a单列导管数目Number of vessel per row(VN)/个5.50±0.86c8.25±0.50a6.75±0.95b6.25±0.50b导管直径Vessel diameter(VD)/μm40.34±1.62ab38.88±3.73b43.56±3.11a43.49±1.03a
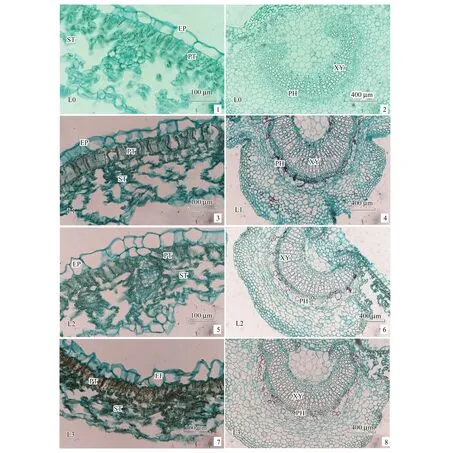
图6 不同遮光条件下香果树叶片横切面结构Fig.6 The cross section structure of E. henryi leaves under different shading treatments1、3、5、7:不同处理叶片横切面The cross section of leaves under different shading treatments(×40); 2、4、6、8:不同处理叶片主脉横切面 The cross section of main vein of leaves under different shading treatments(×10). EP表皮细胞Epddemal cell; PT栅栏组织Palisade tissue; ST海绵组织Sponsy tissue; XY木质部Xylem; PH韧皮部Phloem
从叶脉结构来看,遮光后香果树叶脉髓心空腔变小(图6),木质部(XY)宽度加大,单列导管数目(VN)增多,导管直径(VD)增粗增大,不同处理间的参数值均存在显著差异(P<0.05)。多重比较表明,遮光下的指标值显著高于对照(P<0.05),而且L2和L3的VN显著小于L1(P<0.05),但VD则明显大于L1(P<0.05),说明遮光促进了香果树叶脉中XY的发育,尤其是重度遮光(L2、L3)下叶片中XY显著增粗增强,提高了叶片的水分传导能力(表4)。
3 结论与讨论
不同光环境下香果树幼苗的光合响应特征明显不同。全光照下,香果树幼苗的光补偿点(LCP)为48.56 μmol m-2s-1,光饱和点(LSP)为514.69 μmol m-2s-1。而外界的光合有效辐射长时间高于全光下的LSP,但是香果树幼苗仍能够维持较高的Pn。过剩的强光并未对幼苗的组织器官造成明显灼伤,也未呈现明显的光抑制,说明香果树对强光具有一定的忍耐性和喜光性。一般说,表观量子效率(AQY)反映植物对弱光的利用能力[28],而LCP和LSP则反映了植物对光照条件的需求[29]。一层遮光(L1)下幼苗表现出最高的Pmax、Rd、AQY和相对较低的LSP和LCP,日均Pn最大,这意味着香果树幼苗的光合作用对外界光强的变化有较强的可塑性,能较好地适应轻度遮光条件下的低量子通量密度,进行最大限度的光合作用,从而有利于自身营养物质的积累,以满足低光环境下植株的正常生长。同时,遮光又可以降低地温,并有利于维持地表大气湿度和CO2浓度,从这一点来说,特别是处于天气酷热的夏季,适度遮光对香果树幼龄期的生长和田间管理是十分有利的。而二层遮光(L2)和三层遮光(L3)下,幼苗的LSP和LCP显著下降,尽管植物自身能够充分利用弱光进行光合作用,但由于弱光下Pmax、Rd、AQY明显降低,Pn日均值显著下降,说明过低的光强已经成为幼苗光合作用的主要限制因子,形成弱光胁迫,不利于幼苗的营养积累和健康生长。
植物光合作用受到的限制主要是由气孔或者叶肉细胞变化引起,而导致植物Pn下降的原因主要有气孔限制和非气孔限制两类[30]。本试验中,全光和一层遮光(L1)下Pn和Tr的日变化呈现明显的双峰曲线,说明香果树幼苗光合作用存在“午休”现象,这与青榨槭(Acerdavidii)[31]、无患子(Sapindusmukorossi)[32]、金莲花(Trolliuschinensis)[33]等植物的研究结果一致。而此刻叶片Pn明显下降,同时也伴随着Tr的下降,说明此时的Pn下降可能与气孔限制有关。已有文献表明,胞间CO2浓度(Ci)和气孔限制值(Ls)的变化往往是判断气孔限制或非气孔限制的主要依据[34]。其中Ci是关键指标,若Ci降低和Ls增大,则以气孔限制为主,若Ci增大和Ls减小,则以非气孔限制为主[35];高光强、高温、干旱胁迫等不利环境条件下,植物本身气孔关闭一般是引发“午休”的主要原因[36]。本试验中,不同光环境下香果树叶片的Ci和Ls日动态有显著不同。全光(L0)下幼苗的Pn在12:00时明显下降,同时伴随着Ci持续下降和Ls的缓慢上升。因此,依据气孔限制理论可以断定,强光伴随着高温带来的气孔限制可能是导致全光(L0)和一层遮光(L1)条件下香果树幼苗“午休”的主要因素。
气孔是植物与外界环境进行H2O和CO2等气体交换的重要通道,其分布密度、面积大小直接决定着植物蒸腾和光合作用效率[37-38]。遮光条件下,植物长期处于弱光环境中导致植物叶表面的气孔特征发生了适应性变化,一般表现为气孔密度减小、气孔开张度显著降低[25]。本研究表明,全光下香果树气孔密度(SD)较大,并显著高于遮光条件下的SD(P<0.05),气孔器长度(SL)、宽度(SW)、单个气孔器面积(AS)与气孔器面积百分比(At)也呈现类似的变化,这与油用牡丹(Paeoniaostii)[25]、薯蓣(Dioscoreaopposita)和木薯(Manihotesculenta)[39]、生姜(Zingiberofficinale)[40]等植物的研究结果基本一致,说明遮光引起了香果树叶片气孔器的适应性变化,相应影响幼苗细胞内外的水分和气体传递。但从气孔器的形态来看,香果树叶片的SL、SW及AS要明显高于油用牡丹和其他草本植物,这可能是由于香果树为阔叶乔木植物,光合作用效率较高,蒸腾速率比灌木及草本植物更强。
光是影响植物生长的最重要生态因子之一,植物长期适应不同光照条件,导致其形态和生理发生相应的改变,以最大程度地维持光合能力,适应不同的光环境。因此,叶片结构的可塑性已成为衡量植物应对光胁迫的重要指标[41]。叶肉是叶片进行光合作用的主要部位,栅栏组织(PT)与海绵组织(ST)厚度、细胞层数及栅栏细胞的形态变化必然影响到叶片的光合效率。因此,分析遮光条件下植物叶片组织结构的变化可以为光合作用特征的改变提供解释。一般来说,叶片厚度增加、表皮结构发达和栅栏组织发达是适应强光和旱生叶片的典型特征,而叶片变薄、表皮结构发达、海绵组织疏松通气则是叶片适应弱光和水分供给充足环境的一种适应特性[42]。从本试验结果来看,随着光照强度的减弱,香果树叶片明显变薄,上表皮细胞厚度(UET)增加,下表皮细胞厚度(LET)减少,PT高度降低,排列变得疏松,这被认为是趋于阴生叶的主要特征,并与王荣[3]、杨文权等[43]的研究结果基本一致,说明香果树幼苗从内部结构上对弱光环境出现了适应性调节。目前,遮光对维管束导管结构的影响国内文献报道较少。遮光条件下香果树的维管束髓心空腔变小,木质部导管数目(VN)增多,导管直径(VD)同时增大,叶片水分传导运输能力相应增强,说明遮光促进了幼苗木质部的发育,这可能是香果树叶脉维管束对外界光环境改变所作出的反应机制,从而增强其对逆性胁迫的抗性,维持其正常的生理功能。
叶片是植物对外环境变化较为敏感且可塑性较大的器官,其形态结构和生理变化反映了环境因子对植物的影响和植物对环境的适应[44]。一般认为,全光下有利于PT的发育,遮光则有利于PT向ST细胞的转化,但本研究遮光处理下香果树叶片PT明显变薄,但同时伴随着ST的发育不强,PT/ST有所增加,这与诸多研究结果不一致,说明不同植物在逆境中所作出的生理反应具有复杂性和可变性,这也许是香果树遭受外界环境因素的综合影响的结果,其机制有待于进一步研究探讨。
综合来看,香果树自身具有较好的生理调节机制来应对外界不利的光环境,苗期具有一定的喜光性,同时对适度遮光又具有一定的适应性。但是,严重遮荫会制约幼苗的健康成长和发育,因此在人工育苗生产中,为了满足香果树幼苗生长发育的需求,建议有效辐射强度保持在自然光强的60%以上。

