小麦 TaSABP2基因的克隆及表达分析
李梦达,左 宁,杜红旭,靳海洋,贺德先,牛洪斌
(河南农业大学农学院/国家小麦工程技术研究中心/小麦玉米作物学国家重点实验室/河南粮食作物协同创新中心,河南郑州 450002)
作为植物内源激素之一,水杨酸(salicylic acid,SA)普遍存在于植物体内,并在植物抗病、抗低温、抗旱和抗盐等过程中发挥重要作用[1-3]。水杨酸防御反应是植物能持续抵抗胁迫的一种防御机制[4-5],水杨酸结合蛋白(SA binding protein,SABP)与水杨酸活性位点具有高度的亲和力,在激活植物系统获得性抗性中起着至关重要的作用[6]。逆境胁迫下,SABP与水杨酸结合抑制过氧化氢酶活性,使细胞内过氧化氢含量升高,过氧化氢则作为第二信使诱导植物体内抗性基因的表达,从而产生一系列系统抗性反应[7]。研究发现,SABP2也有可能在SA的信号传导中起作用[8-9]。SABP2具有较强的酯酶活性,能以水杨酸甲酯作为底物发生催化反应,还可以将甲基水杨酸催化成水杨酸,继而诱导抗性防御反应[2,10-12]。
研究表明,转入大豆GmSABP2基因的拟南芥植株的抗盐和抗干旱能力得到显著提升[4]。将本生烟草中的NbSABP2基因沉默后,会出现植株矮小、叶片向下塌陷等一系列不利于抵抗逆境胁迫的特征[5]。在番茄中,盐胁迫可诱导LeSABP2基因大量表达[13]。国内外关于植物SABP2的化学结构及其与SA作用的信号转导途径和作用机理的研究较多[8,14-16],但主要集中在拟南芥和烟草等植物上,在小麦中研究较少。本研究以河南省小麦旱作地区种植范围较广、抗旱能力较强的小麦品种洛旱8号为材料,采用RT-PCR方法克隆得到小麦TaSABP2基因,对其进行生物信息学分析,并对其在小麦各组织及干旱和盐胁迫下的表达量进行初步分析,以期为小麦抗逆育种提供理论依据。
1 材料与方法
1.1 材料种植与处理
供试小麦品种洛旱8号由洛阳市农林科学院提供。选取大小一致、籽粒饱满的种子用2%次氯酸钠消毒5 min,经蒸馏水彻底冲洗后转移至湿润滤纸上并置于25 ℃黑暗条件下发芽1 d。将露白的种子播种于直径为30 cm的营养钵内,土壤基质为砂质壤土与营养土1∶1混合,每钵播种30粒,移入光照培养箱中培养(光照强度350 μmol·m-2·s-1,光/暗周期为 12/12 h,昼夜温度为25/18 ℃),待长至两叶一心期进行胁迫处理。包括:(1)叶面喷施浓度为500 μmol·L-1的脱落酸(ABA)溶液;(2)叶面喷施浓度为1.2 mg·L-1的油菜素内酯(BR)溶液;(3)每盆浇 200 mL水后进行断水处理;(4)浇灌浓度为150 mmol·L-1的NaCl溶液。对照为喷施或浇灌等量的蒸馏水。分别于激素处理后0、3、6、12、24、48、72和96 h和胁迫处理后0、1、2、3、4、5、6、7和8 d取倒二叶,液氮迅速冷冻后-80 ℃保存。同时,将未处理的幼苗转移至大田环境中,正常生长至扬花期,分离同一株小麦的旗叶、根、茎、花药、雌蕊和颖壳组织,液氮迅速冷冻后-80 ℃保存。
1.2 总RNA提取及cDNA第一链合成
样品全部获取后采用TRIZOL试剂(天根生化,北京)提取总RNA,测定OD260/280值,同时利用1%琼脂糖凝胶电泳检测总RNA的完整性,按照3′-Full RACE Core Set Ver.2.0(TaKaRa,日本)使用说明合成cDNA第一链。
1.3 小麦 TaSABP2基因全长cDNA扩增
利用小麦转录组数据库拼接获得的小麦TaSABP2基因EST序列,结合NCBI数据库拼接、设计特异引物对TaSABP2-F1和TaSABP2-R1(表1),以合成的cDNA第一链为模板进行PCR扩增。PCR使用Ex Taq酶(TaKaRa,日本),PCR体系与程序参考说明书,其中循环数为35,退火温度为56 ℃,延伸时间为1 min。扩增产物经1%琼脂糖凝胶电泳,回收目的条带并连接、转化至大肠杆菌DH5α,阳性克隆送至宝生物工程(大连)有限公司进行测序。
1.4 小麦 TaSABP2基因的生物信息学分析
采用NCBI-ORF Finder(https://www.ncbi.nlm.nih.gov/orffinder/)寻找开放阅读框;利用NCBI-CDD(https://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)进行编码蛋白的保守结构域分析;用ExPASy-ScanProsite(https://prosite.expasy.org/scanprosite/)预测编码蛋白的功能位点;用CBS-TargetP 1.1(http://www.cbs.dtu.dk/services/TargetP/)预测和分析氨基酸序列导肽;用CBS-SignalP 4.0(http://www.cbs.dtu.dk/services/SignalP-4.0/)预测蛋白的信号肽;用CBS-TMHMM Server v.2.0(http://www.cbs.dtu.dk/services/TMHMM/)预测和分析基因编码的氨基酸跨膜结构域;用Cell-Ploc 2.0(http://www.csbio.sjtu.edu.cn/bioinf/plant-multi//)预测蛋白亚细胞定位;用ExPASy-ProtScale(https://web.expasy.org/protscale/)预测蛋白亲疏水性;用CBS-NetPhos3.1 Server(http://www.cbs.dtu.dk/services/NetPhos/)分析蛋白质序列潜在磷酸化位点;用SOPMA(https://npsa-prabi.ibcp.fr/cgi-bin/secpred_sopma.pl)分析蛋白质的二级结构;用ExPASy-ProtParam Tool(https://web.expasy.org/cgi-bin/protparam/protparam)分析蛋白质的各种理化性质;用DNAStar及在线软件boxshade(http://www.ch.embnet.org/software/BOX_form.html)进行多重序列比对;用DNAStar软件,采用Jotun Hein Method构建系统进化树;用ExPASy-SWISS-MODEL(https://www.swissmodel.expasy.org/)程序预测蛋白质三级结构。
1.5 qRT-PCR分析
根据测序证实的TaSABP2基因cDNA序列设计特异性引物TaSABP2-F2和TaSABP2-R2,以Actin作内参,设计引物ACT-F和ACT-R(表1)。参考上海生工的Green-2-Go qPCR Mastermix说明书进行Real-time PCR 扩增,3次生物学重复。采用2-△△Ct法[17]计算TaSABP2基因的相对表达量。

表1 基因克隆和实时荧光定量PCR引物Table 1 Primers used in gene cloning and real-time PCR
2 结果与分析
2.1 小麦 TaSABP2基因cDNA克隆与序列分析
以洛旱8号小麦叶片总RNA反转录来源cDNA第一链为模板,利用特异性引物TaSABP2-F1和TaSABP2-R1进行PCR扩增,扩增产物经琼脂糖凝胶电泳检测,在800 bp左右出现一个特异条带(图1),回收、克隆和测序发现该片段长度为878 bp。
序列分析显示,TaSABP2基因cDNA全长878 bp,5′端非编码区41 bp,3′端非编码区30 bp,起始密码子ATG位于第42~44位,终止密码子TGA位于第846~848位,开放阅读框为807 bp,编码268个氨基酸,分子量约为29.6 kD,等电点5.91。利用BLAST程序在NCBI进行比较分析,结果表明该序列与其他植物来源的水杨酸结合蛋白基因核苷酸序列相似度介于82%~87%之间,其中与短柄草(XP_003567195)的水杨酸结合蛋白基因核苷酸序列相似性最高,为87%;推导编码氨基酸序列与短柄草(XP_003567195)氨基酸序列相似性达80%,表明所获得的cDNA片段为水杨酸结合蛋白基因。
2.2 小麦 TaSABP2基因生物信息学分析
2.2.1TaSABP2基因编码蛋白理化性质分析
TaSABP2基因编码蛋白的基本理化性质分析结果表明,该蛋白为C1338H2081N353O378S15,原子总数为4 165,理论半衰期30 h,不稳定系数为47.16,脂溶系数为89.51,亲水系数为0.022,无分泌蛋白,具有亲水性,为非跨膜蛋白,亚细胞定位于叶绿体。其氨基酸的组成为酸性氨基酸(天冬氨酸、谷氨酸)33个、碱性氨基酸(精氨酸、赖氨酸)26个。该蛋白中亮氨酸含量最高,为11.6%,天冬酰胺含量最少,为0.7%。
2.2.2TaSABP2基因编码蛋白功能域分析
TaSABP2基因推导的氨基酸序列包含Abhydrolase及PLN02211两个结构域(图2),属于Abhydrolase超家族。Abhydrolase是一种α/β水解酶,含有蛋白酶、脂肪酶、过氧化物酶、酯酶、环氧化物水解酶和脱卤酶的功能多样的超家族。催化装置通常包括三个残基(催化三联体):丝氨酸、谷氨酸或天冬氨酸和组氨酸,并且通常该机制涉及对羰基碳原子的亲核攻击。在该推导氨基酸序列中发现一个丝氨酸残基的脂肪酶活性位点,序列为VVLVGHSLGG,位于第83~92位。
2.2.3TaSABP2基因编码蛋白磷酸化位点
磷酸化是新生蛋白质最普遍和最重要的蛋白翻译后修饰方式。通常来说,多肽链中的氨基酸潜在磷酸化位点越多,发挥更多功能的可能性也就越大[18]。TaSABP2基因编码蛋白磷酸化位点预测结果显示,该蛋白中有12个丝氨酸、5个苏氨酸和3个酪氨酸可能被磷酸化。推测TaSABP2基因可能经过蛋白磷酸化修饰后具有在逆境胁迫下信号传导的功能。

1:cDNA扩增产物;M:Marker 2000。
1:Amplified product from cDNA; M:Marker 2000.
图1小麦TaSABP2基因全长cDNA序列扩增结果
Fig.1ElectrophoresisofamplifiedproductsofTaSABP2genefull-lengthcDNA

图2 小麦 TaSABP2 编码蛋白结构域及活性位点预测结果Fig.2 Domain and active sites prediction of TaSABP2 protein from wheat
2.2.4TaSABP2基因编码蛋白高级结构分析
软件预测显示,TaSABP2的二级结构由四种形式构成(图3左),包括40.3%的α-螺旋、16.42%的延伸链、4.48%的β转角、38.81%的无规则卷曲。其中,α-螺旋为该蛋白二级结构中最主要的结构元件,α-螺旋、β转角和延伸链分散于整个蛋白质中,且N-末端以无规则卷曲形式存在,C-末端以延伸链形式存在。
用SWISS-MODEL对TaSABP2进行三维建模,结果显示该蛋白三级结构以α-螺旋和无规则卷曲为主要结构元件,β转角和延伸链较少(图3右)。结果以1y7h.1.B序列(烟草NbSABP2基因[2])为模板,相似度达53.97%,说明该蛋白结构与烟草SABP2水杨酸甲酯酯酶相似。
2.2.5 小麦TaSABP2基因与其他植物序列比对和树化分析
利用DNAstar及在线boxshade软件,将TaSABP2基因预测的氨基酸序列与来自短柄草、水稻、玉米、花生、谷子、烟草、马铃薯、芝麻和油棕的氨基酸序列进行比对分析,结果(图4)表明,小麦 TaSABP2蛋白的氨基酸序列与水杨酸结合蛋白高度相似,与短柄草(GenBank登录号XP_003567195)相似性最高,达81.7%。与玉米(GenBank登录号XP_008674949)、谷子(GenBank登录号XP_004970219)、玉米(GenBank登录号XP_008657158)、水稻(GenBank登录号XP_006644824)、油棕(GenBank登录号XP_010908450)、烟草(GenBank登录号NP_001312442)、花生(GenBank登录号XP_015968631)、芝麻(GenBank登录号XP_011099228)和马铃薯(GenBank登录号XP_006363634)的相似性依次为73.7%、73.4%、72.1%、71.1%、57.6%、51.9%、50.0%、50.0%和50.0%。
氨基酸序列聚类分析结果(图5)同样显示,TaSABP2与与短柄草(GenBank登录号XP_003567195)亲缘关系最近,并与玉米(GenBank登录号XP_008657158、XP_008674949)、谷子(GenBank登录号XP_004970219)和水稻(GenBank登录号XP_006644824)等单子叶植物聚为一族,而与油棕(GenBank登录号XP_010908450)等双子叶植物关系较远,表明TaSABP2的分化处于单双子叶分化早期阶段。
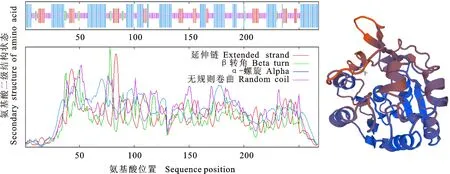
图3 小麦 TaSABP2编码蛋白的二级结构(左)和三级结构(右)Fig.3 Secondary structure(left) tertiary structure(right) of protein encoded by TaSABP2

图4 不同物种SABP2预测氨基酸序列同源性比较Fig.4 Full amino acid sequence alignment of TaSABP2 from different species
2.3 小麦 TaSABP2基因组织特异性表达分析
以洛旱8号的叶片、花药、雌蕊、颖壳、根和茎组织来源总RNA进行荧光定量PCR,结果显示TaSABP2在小麦各组织中均有表达,但表达量存在差异,在花药中表达量最高,茎中最低(图6)。TaSABP2在花药中的表达量分别是雌蕊、颖壳、根、叶和茎组织表达量的3.96、16.11、23.92、41.26 和56.49倍,显示出较强的组织特异性。
2.4 小麦 TaSABP2基因对激素及非生物胁迫的应答分析
2.4.1 ABA和BR对TaSABP2基因表达的影响
TaSABP2转录表达总体上是受ABA和BR诱导上调表达的(图7),96 h内均出现两次峰值。叶面喷施ABA后3 h,TaSABP2的表达量出现第一次峰值,为对照的1.5倍,之后恢复正常水平,在处理后24~72 h,TaSABP2基因表达量又迅速上升,并且在处理后72 h达到最大值,为对照的4.32倍,之后其表达量呈下降趋势。叶面喷施BR后3 h,TaSABP2的表达量出现第一次峰值,为对照的4.29倍,处理后在3~12 h表达量有所下降,但仍保持上调状态,在处理后24 h有第二次明显上调,仅次于处理后3 h,处理后24~96 h,其表达量又呈下降趋势。
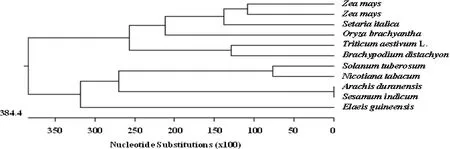
图5 不同物种 SABP2基因的cDNA序列聚类分析Fig.5 Analogy analysis of cDNA sequences of SABP2 genes in different species
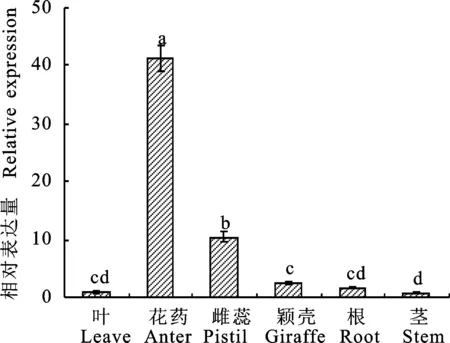
图柱上不同字母表示不同组织间的差异达显著水平(P<0.05)。
Different letters above the columns indicate significant differences among organs at 0.05 level.
图6TaSABP2在不同组织中的相对表达量
Fig.6ExpressionofTaSABP2genesindifferentorgansofwheat

不同小写字母表示ABA不同处理时间之间表达量差异达显著水平(P<0.05);不同大写字母表示BR不同处理时间之间差异达显著水平(P<0.05)。
Different small letters indicate significant differences among ABA treatment time at 0.05 level. Different capital letters indicate significant differences among BR treatment time at 0.05 level.
图7外源ABA与BR对TaSABP2基因表达的影响
Fig.7EffectofexogenousABAandBRontheexpressionofTaSABP2gene
2.4.2 干旱与盐胁迫处理对TaSABP2基因表达的影响
TaSABP2基因转录表达受干旱胁迫和盐胁迫诱导上调,且均在胁迫第2天出现表达量高峰(图8)。干旱胁迫第2天时TaSABP2基因表达量为对照的5.44倍,之后有所下降,在断水后5 d降至最低值,但其表达量仍为对照的1.12倍,之后 虽有少量回升但变化不大。盐胁迫处理2 d,TaSABP2基因表达量有大幅的上升,达到最大值,为对照的6.93倍。盐胁迫后3 d,表达量迅速下降,但仍显著高于对照;处理后3~8 d,其表达量曲折下降。

曲线上的不同小写字母表示不同干旱胁迫时间表达量差异达显著水平(P<0.05),不同大写字母表示不同盐胁迫时间差异达显著水平(P<0.05)。
Different small letters indicate significant differences among drought stress time at 0.05 level. Different capital letters indicate significant differences among salt stress time at 0.05 level.
图8干旱与盐胁迫处理对TaSABP2基因表达量的影响
Fig.8EffectofdroughtandsaltstressontheexpressionofTaSABP2gene
3 讨 论
目前SABP2基因已经在烟草、大豆、丹参等植物中被克隆[4-6,13]。从烟草、大豆和丹参中克隆的SABP2基因的开放阅读框序列长度分别为804、786和780 bp,这与本研究克隆出的小麦SABP2基因cDNA长度(807 bp)高度一致。其中,贾亚军等[4]发现大豆SABP2属于α/β水解酶家族,具有丝氨酸-81、组氨酸-238和天冬氨酸-210三个催化分子。董慧霞[19]和李秀红[6]等在杨树和丹参水杨酸结合蛋白基因研究中也得出了相同结论。本研究在对小麦TaSABP2进行序列分析时发现,TaSABP2基因包含Abhydrolase及PLN02211两个结构域及酶活性中心序列(VVLVGHSLGG),属于Abhydrolase超家族。这与其他植物上的研究结果较为一致,说明TaSABP2基因具有较为保守的结构域。在本研究中,序列比对结果表明TaSABP2基因核苷酸序列及其氨基酸序列与短柄草核苷酸及其氨基酸序列的相似性最高。系统进化树分析表明TaSABP2基因和单子叶植物短柄草水杨酸结合蛋白的亲缘关系最近,与油棕等双子叶植物关系较远,推测TaSABP2基因的分化处于单双子叶分化早期阶段。李秀红等[6]发现,SA能够诱导SABP2基因的大量表达;而在番茄中,盐胁迫处理同样可使LeSABP2基因大量表达[13]。贾亚军等[4]认为,大豆水杨酸结合蛋白基因的表达受干旱和盐的诱导,对提高拟南芥对盐胁迫和干旱胁迫的抗性有重要作用。本研究通过对小麦植株进行ABA、BR、干旱和盐胁迫处理,发现均能诱导小麦TaSABP2基因表达量上调,说明该基因对外界逆境胁迫产生积极响应,推测其在小麦的抗逆过程中起着重要作用。前人研究中检测到拟南芥莲座叶中有SABP2基因转录,而在茎生叶中则无,认为拟南芥SABP2基因在体转录具有组织特异性[11]。本研究采用实时荧光定量PCR分析TaSABP2基因在小麦不同组织部位的表达模式,结果表明,该基因在根、茎、叶、花药、雌蕊、颖壳中均有表达,但其表达量明显不同,这说明TaSABP2基因可能在小麦的各个组织中均能发挥一定的作用,但其表达也具有明显的组织特异性。

