2014-2016年四川盆地小麦白粉病菌毒性分析
徐 志,王 胜,张重梅,张 英,姬红丽,倪健英,周益林,彭云良
(1.四川省农业科学院植物保护研究所/农业部西南作物有害生物综合治理重点实验室,四川成都 610066; 2.四川省农业厅植物保护站,四川成都 610041; 3.中国农业科学院植物保护研究所,北京 100193; 4.四川省甘孜藏族自治州农业科学研究所,四川康定 626000)
小麦白粉病是由禾谷布氏白粉菌小麦专化型(Blumeriagraminisf. sp.tritici)引起的一种气传病害,在全世界各主要麦区广泛分布和危害[1]。自20世纪70年代末以来,该病害在中国的发生范围不断扩大,危害程度不断加重,已成为小麦生产上的最重要病害之一[2]。四川省位于中国大陆西南腹地,东部为川东平行岭谷和川中丘陵,中部为成都平原,西部为川西高原,小麦生长环境差异大,种植结构多样化。小麦白粉病菌既能在川西北盆缘地区越夏,又能在成都平原越冬[3-5]。病菌无性和有性世代交替繁殖,在长期的进化与选择中,形成了其独特的群体结构[6]。选育和利用抗病品种是控制该病害最经济有效的措施。但由于新毒性基因的产生及优势小种的变化,品种抗病性极易丧失。及时监测该地区病菌群体毒性的演化,探索群体遗传变异,对于制定更为有效的病害控制方法具有重要的意义。本研究利用26个单基因鉴别品种(系),对来自四川盆地不同地区189个菌株进行苗期毒性测定和分析,以期为四川省小麦抗白粉病育种和品种布局提供依据。
1 材料与方法
1.1 试验材料
1.1.1 小麦白粉病菌菌株
2014-2016年在四川盆地小麦产区采集小麦白粉病菌闭囊壳标样,采用司权民[7]的方法进行闭囊壳释放和单孢子堆分离纯化,获得试验菌株189个,其中位于盆地西部郫县、新都、广汉和绵阳游仙、盐亭、安县、江油分离的菌株数分别为54、44、19个和6、36、10、5个,位于盆地东部叙永、内江市中区、阆中、苍溪和巴中分离的菌株数分别为2、2、6、1和4个。
1.1.2 小麦白粉病菌鉴别寄主
小麦白粉病菌繁殖品种Chancellor、26个单基因鉴别寄主品种(系)(表1),均由中国农业科学院植物保护研究所提供。
1.2 试验方法
将纯化后的试验菌株分别接种到健康的Chancellor一叶一心盆栽幼苗上,玻璃罩隔离培养,顶端5层纱布封口以防止杂菌污染;18 ℃的恒温室中,16 h光照培养,繁殖菌种。5~7 d后,将26个单基因鉴别品种(系),播种于30 cm×20 cm×5 cm的搪瓷方盘内,以感病小麦品种Chancellor作为对照,套上透明塑料袋,在18 ℃恒温室中隔离培养。当第一叶片完全展开后,采用抖接法接种繁好的白粉菌分生孢子,每个菌株接种一套鉴别寄主[7]。待对照品种Chancellor完全发病后,参照盛宝钦[8]0~4级法,记载第一叶片的反应型。其中,1~2型为抗病反应,菌株表现为无毒性;3~4型为感病反应,菌株表现为有毒性。
1.3 数据统计分析
依据各菌株对各鉴别寄主的毒性谱,确定其毒性类型[9]。其中,特有毒性类型是指检测频率仅为1次的毒性类型,共有毒性类型是指两个及其以上菌株含有的相同毒性类型。
根据毒性测定结果,将无毒性的菌株(0~2型)记为“0”,有毒性的菌株(3~4型)记为“1”,构建“0-1”毒性矩阵,计算毒性基因频率,并统计每个菌株所含有的毒性基因数(即毒性复杂度)。毒力频率=有毒力的菌株数/供试菌株总数×100%。
基于“0-1”毒性矩阵,以Popgene1.32软件[10]在假定哈丁·温伯格平衡条件下,分别计算不同病菌群体多样性参数:观察等位基因数Na(observed number of alleles)、有效等位基因数Ne(effective number of alleles)、基因多样性指数H(Nei’s gene diversity)、信息指数I(Shannon’s information index)、多态性位点数NP(the number of polymorphic loci)和多态位点百分率P(the percentage of polymorphic loci)。根据Nei’s遗传距离,构建UPGMA(unweighted pair-group method with arithmetic means)毒性聚类图。整个数据分析过程,连锁不平衡LD测验(linkage disequilibrium)显著性水平P值为0.05,中性检验采用1 000次随机抽样。

表1 四川盆地小麦白粉病菌毒力频率Table 1 Virulence frequencies of Blumeria graminis f. sp. tritici in Sichuan Basin
2 结果与分析
2.1 四川盆地小麦白粉病菌毒性类型
189个菌株对26个抗病单基因鉴别品种(系)中的6~21个具有毒性,平均14.04个。其中,盆地西部病菌群体对6~21个单基因品种(系)具有毒性,平均为13.97个;盆地东部病菌群体对9~19个单基因品种(系)具有毒性,平均为14.93个(表2)。189个菌株总计检测出183种毒性类型,其中盆地西部171种,盆地东部15种。仅出现1次的毒性类型有178种,占97.27%,盆地西部和盆地东部病菌群体各自占98.25%和80.00%。
盆地西部和东部病菌群体共有毒性类型有3组(表3),分别是毒性类型V1a、2、3a、3b、3c、3d、3e、3f、4a、4b、5a、6、7、8、13、17、19、30,盆地西部检测出2次(盐亭,2014年;盐亭,2015年),东部1次(巴中,2015年);毒性类型V1a、2、3a、3b、3c、3d、3e、3f、4a、4b、5a、6、7、8、17、19、30,盆地西部1次(安县,2015),东部1次(巴中,2015年);毒性类型V1a、2、3b、3c、3d、3e、3f、4a、4b、5a、5b、6、7、8、19、30、Era、XBD,盆地西部1次(郫县,2014年),东部1次(苍溪,2014年)。此外,盆地西部检测到另外2组共有毒性类型,各出现2次,分别是毒性类型V1a、2、3a、3b、3c、3d、3e、3f、4a、4b、5a、5b、6、7、8、19、30、Era(盐亭,2014;郫县,2015年)和V1a、3a、3b、3c、3e、3f、4a、5a、6、7、8、17、19、30(盐亭,2014;郫县,2016年)。

表2 四川省盆地小麦白粉病菌毒性类型Table 2 Virulence types of Blumeria graminis f. sp. tritici
表3 四川盆地小麦白粉病菌毒性类型及其分布Table 3 Virulence types and distribution of Blumeria graminis f. sp. tritici in Sichuan Basin
毒性类型:仅列出含有≥2个以上菌株的类型,括号内容为采集地点及年份。
Virulence types:Containing more than one isolate,and the origin is presented in the brackets.
2.2 四川盆地小麦白粉病菌毒力频率
189份小麦白粉病菌株在26个单基因鉴别品种(系)上的毒力测定结果显示,供试菌株群体对抗病基因Pm1a、Pm2、Pm3b、Pm3c、Pm3e、Pm3f、Pm4a、Pm4b、Pm5a、Pm6、Pm7、Pm8、Pm19、Pm30的毒力频率高于60%,对Pm1c、Pm12、Pm16、Pm21和Pm24的毒力频率低于20%(表1)。其中,对Pm21的毒力频率为0,即未检测到对其表现出有毒性的菌株。
个别基因在东西部间的分布差异较大(表1)。其中,供试菌株群体对Pm3d的毒力频率,在盆地西部和盆地东部分别为47.13%和93.33%;对Pm13的毒力频率,分别为17.24%和40%,盆地西部<盆地东部;而对Pm1c、Pm12、Pm16和Pm24的毒力频率则相反,盆地西部>盆地东部。
2.3 四川盆地小麦白粉病菌毒性多样性
小麦白粉病菌群体毒性多样性结果显示,189份样品的观察等位基因数、有效等位基因数、基因多样性指数、信息指数、多态性位点数和多态位点百分率分别是1.961 5、1.506 3、0.301 4、0.460 1、25和96.15%,说明四川盆地小麦白粉病菌其毒性多样性比较丰富(表4)。
地区间病菌群体存在一定的差异,盆地西部和盆地东部白粉菌群体的基因多样性指数分别为0.300 5和0.273 5,信息指数分别为0.459 2和0.408 2,多态位点百分率分别为96.15%和76.92%。盆地西部病菌群体毒性多态性整体上高于盆地东部。
189个菌株毒性聚类结果发现,当Nei’s遗传距离为25.0时,供试菌株被分为三大类群,来自盆地东部的2个菌株聚为第一个大类群,来自盆地西部的5个菌株聚为第二个大类群,此两类群均为低毒菌株,其毒性谱变化范围为6~11,其余182个菌株聚为第三个大类群。在Nei’s遗传距离取值24时,第三个大类群可分为两个亚类群。第一个亚类群包含13个菌株,低毒,其毒性谱范围为6~13,其中1个来自于盆地东部,12个来自于盆地西部。剩余169菌株为第二个亚类群,包含盆地西部菌株157个和盆地东部菌株12个(图1)。

表4 四川盆地小麦白粉病菌群体毒性多样性指数Table 4 Virulence diversity parameters of Blumeria graminis f. sp. tritici in Sichuan basin
Na:观察等位基因数;Ne:有效等位基因数;H:基因多样性指数;I:信息指数;NP:多态性位点数;P:多态位点百分率。
Na:Observed number of alleles;Ne:Effective number of alleles;H:Nei’s gene diversity;I:Shannon’s information index;NP:The number of polymorphic loci;P:The percentage of polymorphic loci.
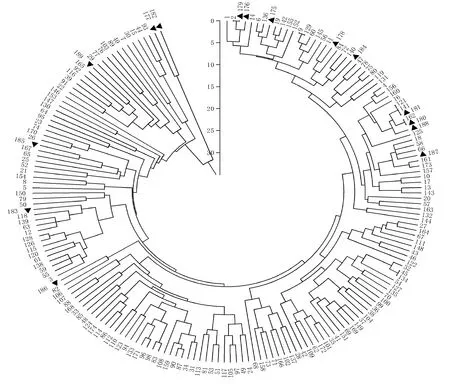
▲:盆地东部菌株,其他为盆地西部菌株
▲:East Sichuan Basin isolates,the others were derived from West Sichuan Basin
图1四川189株小麦白粉病菌毒性聚类图
Fig.1Virulencedendrogramof189wheatpowderymildewisolatesinSichuan
3 讨 论
小麦白粉病是大区流行病害,四川盆地及其西部山区是小麦白粉病的常发区和重发区[11],分析该地区小麦白粉病菌群体的毒性结构及其动态变化,了解四川省小麦白粉病抗性基因的抗性现状,对于整个西南地区乃至东部地区小麦白粉病的流行预测和防治都有至关重要的作用。本研究结果表明,小麦抗白粉病基因Pm1a、Pm2、Pm3b、Pm3c、Pm3e、Pm3f、Pm4a、Pm4b、Pm5a、Pm6、Pm7、Pm8、Pm19、Pm30抗性较差,其毒性频率已超过60%,不适合在四川省抗病育种和生产上继续使用。而携带有Pm1c、Pm12、Pm16、Pm21和Pm24的品种和抗源均可在育种或生产上应用,其毒性频率变化范围为0~20%,这与小麦白粉病全国大区流行趋势基本一致[12-14]。作为我国目前抗白粉病谱最广的基因,Pm21已被成功转入到许多小麦品种中,且在多个省份或区域中表现为免疫[15-17]。近十年对Pm21表现毒性菌株的报道时有发生[11,18-20]。本研究未监测到对Pm21表现出有毒性的菌株,后期应继续关注。
除了受大区流行趋势的影响,小麦白粉病菌还呈现区域流行特点。本研究中,Pm3d、Pm13、Pm1c、Pm12、Pm16和Pm24,在盆地西部和盆地东部的毒力频率差异较大,其原因可能与各地区小麦品种的选择压力有关。特有毒性类型的大量存在,表明各地区的病菌都在以适应当地的方式进行独立的进化,而盆地西部病菌群体毒性类型更多,毒性谱变化范围更广,毒性多样性指数更高,除了与各地区小麦品种的选择压力有关外,还可能与盆地西部、川西北、陇南越夏菌源交流有关,值得进一步的研究。

