小麦 TaWIN1基因的克隆和表达分析
申玉霞,郭利建,马 猛,2,赵惠贤,2,刘香利,2
(1.西北农林科技大学 生命科学学院,陕西杨凌 712100; 2.旱区作物逆境分子生物学国家重点实验室,陕西杨凌 712100)
14-3-3蛋白是在脑组织中首先发现的一种可溶性蛋白,依据该蛋白经二乙氨乙基纤维素(DEAE cellulose)柱层析后所占分离组分的片段数及在淀粉凝胶电泳中的迁移率而命名[1]。14-3-3蛋白广泛存在于植物中,迄今,已在菠菜(Spinaciaoleracea)、大麦(Hordeumvulgare)、拟南芥(Arabidopsisthaliana)、番茄(Lycopersiconesculentum)、水稻(Oryzasativa)和二穗短柄草(Brachypodiumdistachyon)[2]等植物中发现该蛋白。目前,已从二十多种植物中克隆和鉴定到14-3-3蛋白基因,其为多基因家族,不同家族成员在结构上都表现出极大的相似性;对模式植物拟南芥的研究结果表明,14-3-3蛋白有13个成员,中间区域高度保守,但其N-端和C-端均具有较高的变异性,N端的氨基酸残基对14-3-3蛋白二聚体的形成及其与配体的结合具有重要的作用[3]。14-3-3蛋白家族成员具有多种功能,主要表现在参与植物光合作用、基础代谢、生长发育、激素信号途径以及生物和非生物胁迫响应等方面[4-5]。基因芯片试验结果显示,水稻和拟南芥中14-3-3蛋白的表达都受到生物和非生物胁迫的调控[6-7]。大量的研究表明,14-3-3基因在植物非生物胁迫耐受中起重要作用,拟南芥中的14-3-3同源蛋白GRF6能与过氧化氢酶体的抗坏血酸过氧化物酶和锚蛋白复合体互作,在棉花中超表达GRF6基因能提高棉花的抗旱性[8]。从禾本科模式植物二穗短柄草中鉴定出7个14-3-3蛋白,且7个蛋白对高温、重金属、ABA、水杨酸、NaCl和PEG等多种胁迫处理均有响应[9]。在拟南芥中过表达二穗短柄草BdGF14a基因的植株,其抗旱性显著提高[10];在烟草中过表达转二穗短柄草BdGF14d基因的植株,其对盐的耐受性增强。进一步研究发现,ABA信号传导、ROS清除系统和离子转运蛋白都参与了增强BdGF14d基因过表达植株对盐胁迫的耐受性[11]。
非生物逆境胁迫是造成小麦减产的重要因素。因此,对小麦逆境胁迫相关蛋白进行研究具有非常重要的意义。本课题组前期通过分析野生一粒小麦在干旱胁迫下的主要蛋白质,发现14-3-3蛋白在干旱胁迫下显著上调[12],然而关于小麦中14-3-3蛋白的相关研究较少。因此,本研究从普通小麦中克隆小麦14-3-3蛋白家族TaWIN1基因,并对其在不同组织器官和干旱、高温、低温和盐胁迫下的表达模式进行分析,以期为进一步研究小麦14-3-3蛋白基因的功能奠定基础。
1 材料与方法
1.1 试验材料
普通小麦(Triticumaestivum)品种中国春由本实验室保存,选择籽粒饱满的种子,先用75%的乙醇消毒45 s,蒸馏水冲洗3次,再用0.2 %的次氯酸钠消毒5 min,蒸馏水冲洗3次,室温下于100 r·min-1摇床过夜。随后,将种子铺在装有灭菌滤纸的培养皿中,置于22 ℃光照培养箱中培养,光/暗周期为16/8 h,相对湿度为70%,水培至一叶一心期;之后用1/2 Hongland营养液培养至两叶一心期,再分别用0.2 mol·L-1的NaCl和15% 的PEG-6000进行处理,高温胁迫组置于40 ℃环境培养,低温胁迫组置于4 ℃环境培养。分别在处理的0、1、2、6、12、24和48 h取根和叶,用液氮速冻后于-80 ℃保存备用。
1.2 小麦 TaWIN1基因的克隆
根据NCBI中TaWIN1基因(GenBank登录号: AB042193.1)的序列,用primerpremier 5.0软件设计引物TaWIN1-F/TaWIN1-R(表1)。用Plant RNA Kit(OMEGA,美国)提取中国春幼叶RNA,并以总RNA为模板,用PrimeScriptTMⅡ 1st Strand cDNA synthesis Kit (TaKaRa,日本)进行cDNA第一链的合成,以此cDNA为模板进行PCR。PCR体系与程序参考KOD FX(TOYOBO,日本)说明书,其中循环数为35,退火温度为58 ℃,延伸时间为45 s。PCR结束后,利用1%的琼脂糖凝胶电泳检测扩增产物条带大小,将与预期目的条带大小一致的扩增产物进行回收。将回收的目的片段连接至pMD 19-T(TaKaRa,日本),转化至DH5α大肠杆菌感受态细胞,经菌落PCR和酶切鉴定后送西安擎科泽西生物科技有限责任公司进行测序。
1.3 小麦 TaWIN1基因编码蛋白的生物信息学分析
利用NCBI-ORF Finder(https://www.ncbi.nlm.nih.gov/gorf/gorf.html)预测TaWIN1基因的开放阅读框,利用NCBI-CDD(https://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)预测该基因编码蛋白的保守结构域;利用ExPASy-Protparam(https://www.expasy.org/protparam)预测编码蛋白的理化性质,利用ExPASy-Protscale(https://www.expasy.org/protscale)预测编码蛋白的疏水性,利用CBS-TMHMM(http://www.cbs.dtu.dk/services/TMHMM-2.0/)预测编码蛋白的跨膜区,利用CBS-Signal P(http://www.cbs.dtu.dk/services/SignalP/)预测编码蛋白的信号肽,利用ExPASy-COILS(https://embnet.vital-it.ch/software/COILS_form.html)预测编码蛋白的卷曲螺旋,利用Plant-mPLoc(http://www.csbio.sjtu.edu.cn/bioinf/plant-multi/)预测编码蛋白的亚细胞定位;利用NCBI-BLASTP(https://blast.ncbi.nlm.nih.gov/Blast.cgi?PROGRAM=blastp&PAGE_TYPE=BlastSearch&LINK_LOC=blasthome)对编码蛋白进行同源搜索,利用DNAMAN 软件对小麦及其他物种的蛋白质序列进行多重比对分析,利用MEGA 6.0软件的Neighbor-Joining法构建系统发育树。

表1 本研究使用的引物信息Table 1 Primer sequences used in this study
1.4 小麦 TaWIN1基因的表达分析
1.4.1 不同组织及发育阶段的表达分析
为了分析TaWIN1基因在小麦不同组织及发育阶段的表达模式,根据测序结果设计定量引物(表1)。分别提取小麦苗期的根、茎、叶、5 mm幼穗、10 mm幼穗和抽穗期的旗叶以及花后5、10、15和20 d籽粒的总RNA,反转录后以cDNA为模板,以小麦GAPDH基因作为内参基因,使用GoTaq○RGreen Master Mix(Promega,美国)进行qRT-PCR,反应体系与程序参考说明书。每个样品重复三次,qRT-PCR数据用2-△△CT法进行分析,定量结果用Duncan法进行多重比较分析。
1.4.2 不同非生物胁迫处理下的表达分析
分别提取各处理幼苗叶和根的总RNA,反转录后进行qRT-PCR分析。方法同上。
2 结果与分析
2.1 TaWIN1基因克隆结果
以中国春幼叶RNA反转录的cDNA为模板,RT-PCR扩增得到一条与预期的801 bp大小一致的特异性条带(图1),克隆后测序,序列分析正确,说明得到了小麦TaWIN1基因。开放阅读框预测结果表明,该基因含有一个801 bp的完整开放阅读框;保守结构域预测结果表明,该基因编码蛋白含有完整的14-3-3蛋白家族结构域。以上结果初步表明,本研究克隆得到的基因为TaWIN1基因。
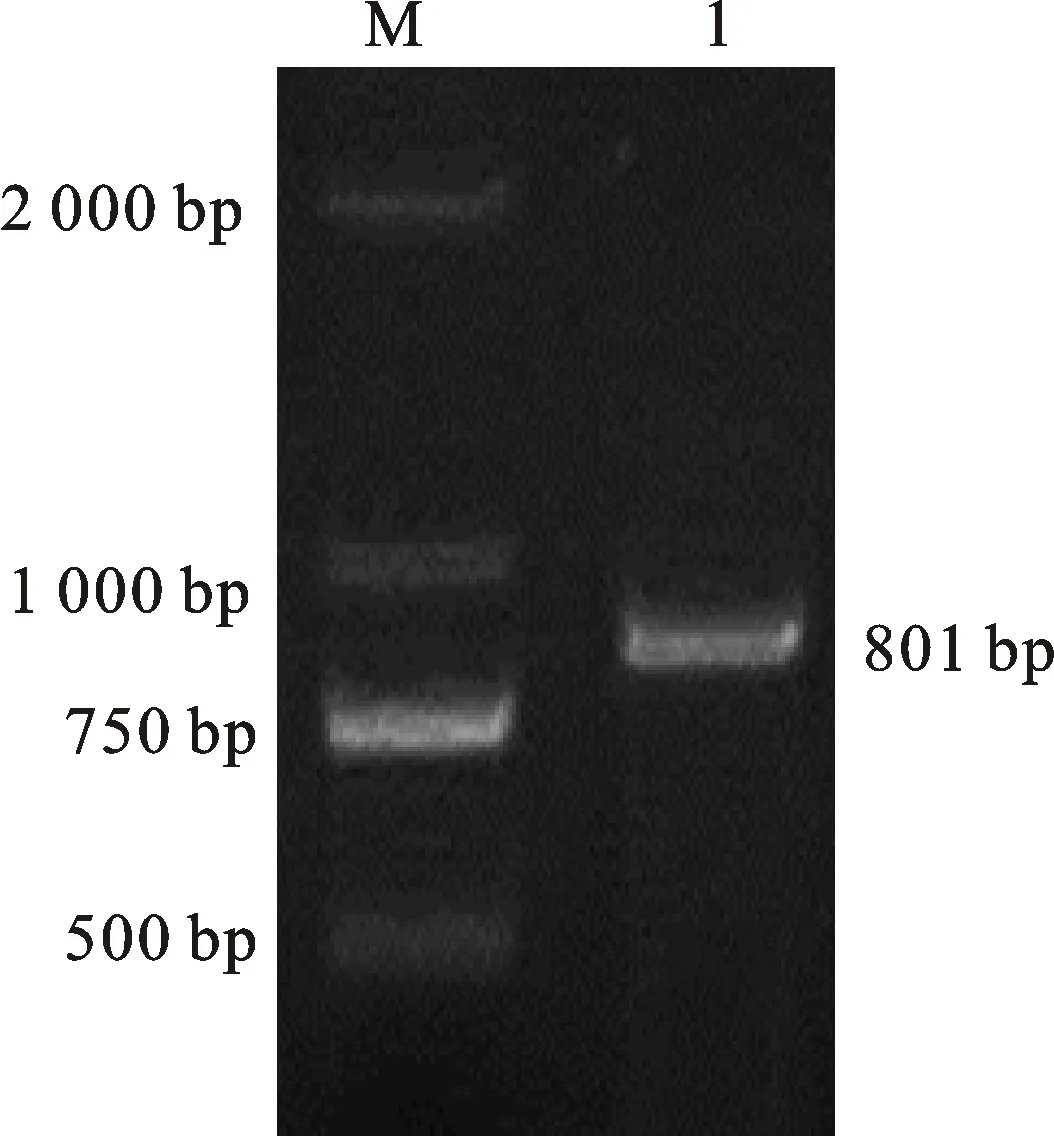
M:D2000; 1:PCR 产物。
M:D2000 DNA maker; 1:PCR product.
图1TaWIN1基因的扩增产物
Fig.1PCRproductofTaWIN1gene
2.2 TaWIN1基因编码蛋白的生物信息学分析
对TaWIN1基因编码蛋白进行预测,发现该蛋白编码266个氨基酸,其分子量为30.22 kDa,理论等电点(pI)为4.75,属于酸性蛋白;氨基酸残基中丝氨酸、苏氨酸和酪氨酸所占的比例分别为8.3%、3.4%和4.1%,说明该蛋白为亲水性蛋白,且没有跨膜区域;亚细胞定位预测结果表明,编码蛋白可能定位于细胞质;该蛋白有两个14-3-3蛋白家族典型的卷曲螺旋结构。
利用TaWIN1蛋白序列在NCBI中在线搜索不同物种中与小麦TaWIN1蛋白序列同源性较高的蛋白,蛋白结构域和序列比对结果如图2所示,小麦TaWIN1氨基酸序列与大麦的14-3-3E氨基酸序列相似性为99%,与二穗短柄草的GF14d同源性为97%,与玉米、水稻和拟南芥的蛋白同源性分别为92.48%、92.48%和77.82%。系统发育分析表明,双子叶植物与单子叶植物的蛋白在进化上明显分成两支,与小麦TaWIN1蛋白亲缘关系近的有大麦、二穗短柄草、水稻等单子叶植物(图3)。
2.3 小麦 TaWIN1基因表达分析
2.3.1 小麦TaWIN1基因在不同组织中的表达
以中国春根、茎、叶、旗叶、5 mm幼穗和10 mm幼穗,以及花后5、10、15和20 d籽粒cDNA为模板,对TaWIN1基因进行表达分析,结果(表2)表明,该基因在小麦各个发育时期和组织中都有表达,在根中表达量最低,在叶、旗叶和幼穗中表达量相对较高,其中在10 mm幼穗中表达量最高,说明该基因可能与小麦籽粒发育有关。
2.3.2 小麦TaWIN1基因在非生物逆境胁迫下的表达
用qRT-PCR对干旱、盐、热和低温处理0、1、2、6、12、24和48 h的根和叶中TaWIN1基因的相对表达量进行分析。结果(表3)表明,TaWIN1基因的表达在不同处理下随时间变化表达模式有差异。在干旱胁迫处理下,该基因在根和叶中的表达量均显著上调,12 h均达到最高,根中表达量是对照的120倍。盐胁迫下,叶片中TaWIN1基因表达量显著上调,1 h达到最高;根中的表达量随着胁迫处理时间的延长先下调后上调,6 h达到最高。高温胁迫处理下,该基因在叶中的表达量均显著下调,而根中的表达量随着胁迫处理时间的延长先下调后上调,24 h达到最高,为对照的10倍。低温胁迫下,根和叶中的表达量先显著上调,而后下调。以上研究结果表明,TaWIN1基因可能参与小麦对干旱、盐、热和低温胁迫的响应。

方框表示14-3-3蛋白家族结构域。Box indicates the 14-3-3 protein family domain.Ta:Triticumaestivum; Zm:Zeamays; Os:Oryzasativa; At:Arabidopsisthaliana; Bd:Brachypodiumdistachyon:Hv:Hordeumvulgare.
图2小麦TaWIN1蛋白与其他植物同源蛋白的氨基酸序列比对
Fig.2MultiplealignmentoftheaminoacidsequenceofwheatTaWIN1withhomologousproteinsofotherspecies

图3 TaWIN1蛋白系统进化分析Fig.3 Phylogenetic analysis of TaWIN1 protein
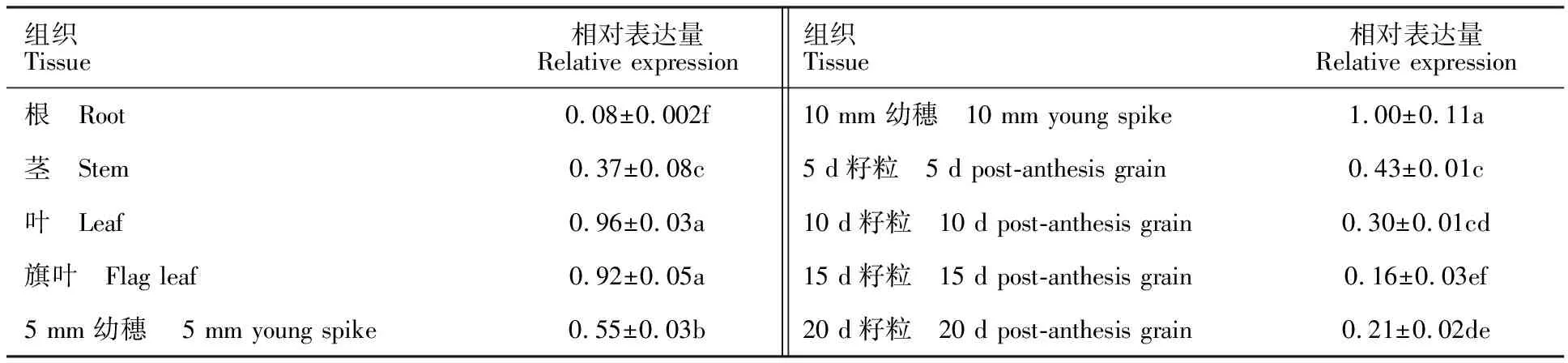
表2 TaWIN1基因在小麦不同组织中的相对表达量Table 2 Relative expression of TaWIN1 gene in different tissues
同列数据后的小写字母不同表示不同组织间差异显著(P<0.05)。
Different lower-case letters in the same column indicate significant differences amang tissues(P<0.05).

表3 小麦 TaWIN1基因在不同非生物逆境胁迫下的相对表达量Table 3 Relative expression of TaWIN1 gene under different abiotic stresses
同列数据后的小写字母不同,表示不同处理时间之间差异显著(P<0.05)。
Different lower-case letters in the same column indicate significant differences amang different time after treatment(P<0.05).
3 讨 论
14-3-3蛋白在真核生物中高度保守,对拟南芥14-3-3蛋白的一级结构的分析结果表明,其N端同源性较低(14%),中间区域同源性高(51%)。对其N端12-30氨基酸残基进行突变后发现14-3-3蛋白不能形成二聚体,同时失去与一些靶蛋白的结合能力,说明N端的氨基酸残基区对14-3-3蛋白二聚体的形成及其与配体的结合具有重要的作用[13]。14-3-3蛋白通过与其他蛋白相结合来发挥作用,可以同时与2个靶蛋白或者1个靶蛋白的2个结构域相互作用。序列比对发现,小麦TaWIN1基因含有14-3-3家族保守结构域,且与大麦Hv14-3-3E和二穗短柄草BdGF14d高度同源。
14-3-3蛋白在植物体内执行着多种多样的功能,并被证实与植物非生物胁迫,如干旱、盐、极端温度和氧化胁迫有关。与TaWIN1同源性最高的大麦Hv14-3-3E的表达量受ABA诱导上调6~8倍,酵母双杂显示其可以与大麦的HVABI5发生互作[14]。多项研究表明,二穗短柄草中BdGF14d基因在高温、低温和ABA处理下均显著上调[9-11]。Ikeda等[15]在研究小麦WPK4蛋白激酶信号转导途径相关蛋白时,利用酵母双杂的方法发现了两个cDNA克隆TaWIN1和TaWIN2,其编码蛋白可通过自身C端的丝氨酸自身磷酸化与WPK4结合。本研究发现,TaWIN1基因在PEG处理和低温以及盐胁迫下根和叶片中的表达量均显著上调,说明TaWIN1基因可能参与小麦非生物逆境胁迫响应,其具体功能有待进一步研究。

