沿“胆囊管”逆行追踪法在预防腹腔镜胆囊切除术肝外胆管损伤中的应用价值
陈晓鹏,程斌,鲍胜华,张卫东,黄晨,王东,丁守勇,俞远林,彭俊璐,张文君,于北北
(皖南医学院弋矶山医院 肝胆外科,安徽 芜湖 241001)
腹腔镜胆囊切除术(laparoscopic cholecystectomy,LC)发生胆管损伤(bile duct injury,BDI)是一种常见而严重的并发症,若不能及时发现并进行有效处理,可导致严重后果。文献及临床预防BDI的措施众多,但LC时BDI发生率仍居高不下,国外报道约为0.4%~0.6%[1-2],国内有报道为0.31%,多在0.2%~0.8%[3],大约较开腹胆囊切除术(open cholecystectomy,OC)增加了2倍,实际可能更高。究其原因,除难以避免的认知错误外[4],还在于现有预防措施可能仍不够完善或不十分可靠。笔者近年在诊治不同类型BDI(横断或切除)的基础上,分析发生各种BDI的原因,并结合LC操作体会,归纳总结一种新的BDI预防概念,即沿“胆囊管”逆行追踪法(简称逆行追踪法),经模拟解剖和临床应用,效果显著,现报告如下。
1 资料与方法
1.1 临床资料
皖南医学院弋矶山医院肝胆一科2018年3月—2018年10月单纯施行LC的胆囊炎患者324例,其中男115例,女209例;年龄11~89岁,平均50.5岁。其中慢性胆囊炎267例(包括慢性萎缩性胆囊炎 7例),急性胆囊炎或胆囊炎急性发作57例(包括急性化脓或坏疽性胆囊炎12例)。324例中,胆囊结石292例(含残余胆囊结石1例),各类胆囊息肉27例,胆囊结石并胆囊息肉3例,既无结石又无息肉2例(含残余胆囊炎1例)。合并高血压病 51例,2型糖尿病21例,急性胰腺炎10例,局限性腹膜炎3例,其他合并症,如肝硬化、冠心病、脑梗塞等共40例次。所有患者均施行LC术,术中均采用逆行追踪法。
1.2 逆行追踪法概念
沿“胆囊管”逆行追踪法基本要点有:⑴ 术者解剖胆囊三角,分离出“胆囊管”后,在没有确认汇入胆囊前,均不宜断夹,而应紧贴该“胆囊管”采取钝性和锐性结合的方法,继续向胆囊和肝门方向逆行追踪分离。⑵ 在此逆行游离过程中,如发现该“胆囊管”发自胆囊,而非发自肝内胆管,且该“胆囊管”与胆囊壶腹之间并无其他胆管,则可靠近胆总管安全断夹之,并切除胆囊。⑶ 如发现该“胆囊管”或其属支发自肝脏或肝内胆管,说明其并非真正的胆囊管或胆囊管的安全部位,而可能是正常或变异胆管,因此不可断夹,否则会致严重BDI。此时,应改变解剖部位或路径,直至安全切除胆囊,必要时中转开放手术。
1.3 逆行追踪法解剖学基础
根据胆囊管汇入角度、胆囊管汇入肝外胆管位置、副肝管汇入胆囊管方式不同,选取8 种临床常见的胆管结构(变异)图[5](图1),利用逆行追踪法在8 种临床常见的胆管结构(变异)图进行模拟解剖。结果显示,不论胆囊三角和胆管结构是否存在变异,如紧贴胆囊管或其安全部位向胆囊体底部逆行游离(实线箭头表示),可发现其发自胆囊、而非发自肝内胆管,胆囊管与胆囊壶腹之间亦无其他胆管或变异胆管(图1A-B),则可安全断夹之,并安全切除胆囊。如沿分离出的假“胆囊管”(实为正常或变异胆管)向肝、向上逆行游离(虚线箭头表示),则会发现其发自肝脏,其可能是正常 (图1A-C)或为变异胆管(图1D-G),也可能为胆囊管的危险部位(图1H)。此时,如继续沿分离出的假“胆囊管”或变异胆管径直向胆囊切除,在其起始和/或近肝处予以断夹,则会导致BDI或严重胆管缺损。故应中止该方向进一步操作(×号表示),并改变解剖路径,以避免BDI。
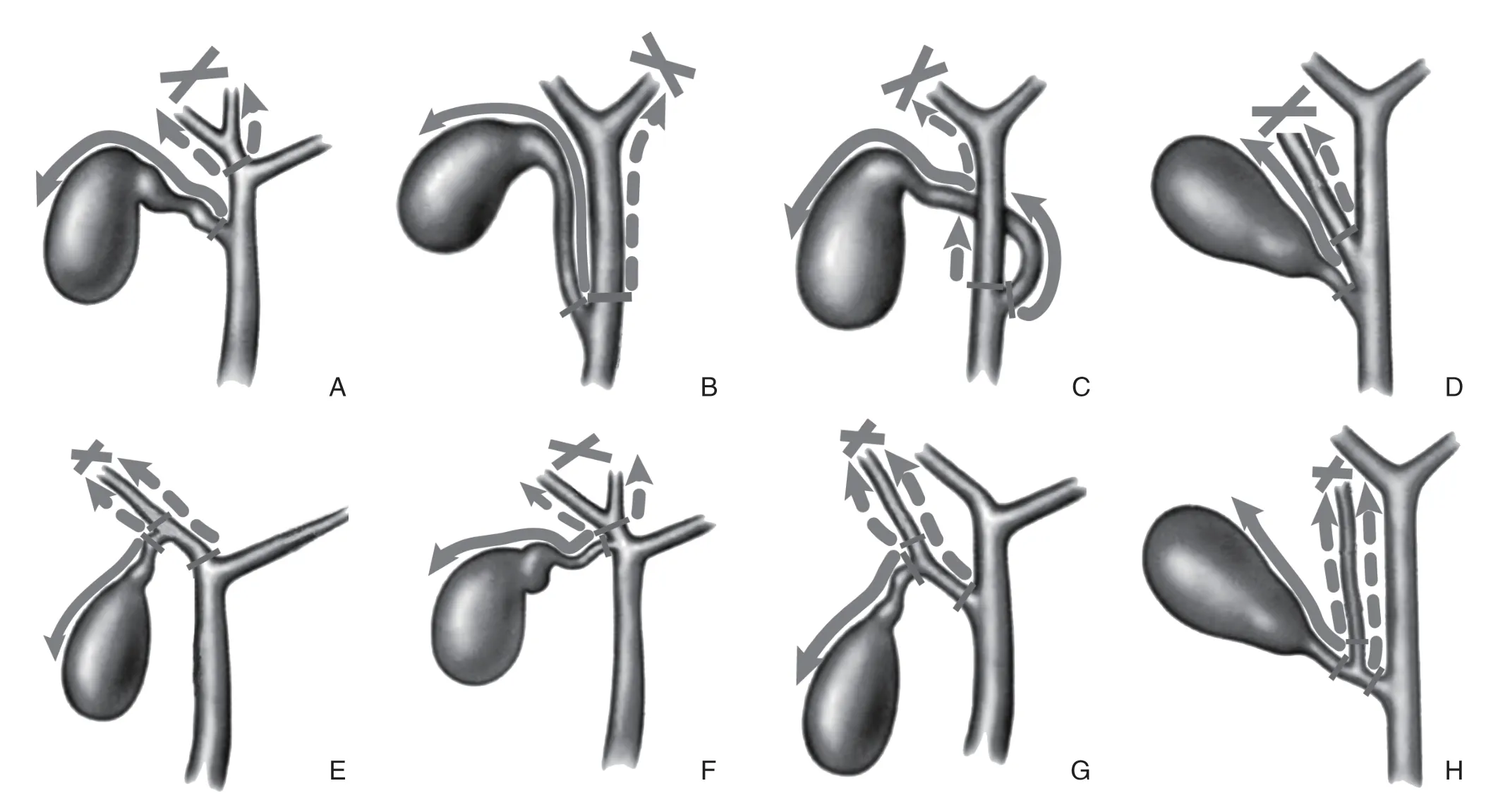
图1 逆行追踪法解剖模拟图 A:经典型胆囊管汇入胆总管;B:胆囊管与肝总管平行(低位汇入胆总管);C:胆囊管经胆总管后方汇入胆总管右侧壁;D:胆囊管与副右肝管并行汇入肝总管;E:胆囊管汇入右肝管;F:胆囊管汇入汇合部;G:胆囊管汇入副右肝管;H:副右肝管汇入胆囊管Figure 1 Simulated diagrams of retrograde tracing method A: Typical fashion of the cystic duct entering into the common bile duct; B: Cystic duct parallel to the common hepatic duct (entering into the common bile duct at a lower site); C: Cystic duct entering into right side of the common bile duct passing though the rear wall of the common bile duct; D: Cystic duct parallel to the right accessory hepatic duct before entering into the common bile duct;; E: Cystic duct entering into the right hepatic duct; F: Cystic duct entering the confluence of left and right hepatic ducts; G: Cystic duct entering into the right accessory hepatic duct; H: Right accessory hepatic duct entering into the cystic duct
1.4 逆行追踪法手术操作
L C 均用气管插管全麻,3 孔或4 孔法。进腹探查后,常规解剖胆囊三角,并尽量掏空其内脂肪和炎性组织,分离出胆囊动脉和“胆囊管” (图2A);如炎症粘连严重,胆囊三角难以解剖,可采用钝性解剖[6-7]、后三角入路[8-9]或胆囊(或壶腹)浆膜下径路[10-11]等方法,以助分离出“胆囊管”。再采用前述沿“胆囊管”逆行追踪法(图2B),向胆囊及肝脏方向解剖,如发现其延自胆囊而非发自肝内,则予以断夹,顺行切除胆囊。如发现其或另有分支延自肝内,且比较粗大(图2C),则终止进一步向上游离。此时,应调整思路、重新解剖,在确认的安全部位断夹胆囊管(图2D),直至完整切除胆囊。术毕视情放置腹腔引流。

图2 逆行追踪法术中操作 A:解剖胆囊三角;B:沿“胆囊管”逆行追踪(钝性或锐性)解剖;C:胆囊管有肝外右后叶胆管支延自肝内(黄色箭头);D:在胆囊管的安全部位断夹胆囊管(绿色箭头)Figure 2 Intraoperative performance of retrograde tracing approach A: Dissection of the Calot's triangle; B: Retrograde dissection along the “cystic duct” (blunt or sharp dissection); C: Right posterior sectoral duct opening into the cystic duct (yellow arrow); D: Clamp of the cystic duct at the safe site (green arrow)
2 结 果
2.1 患者术中情况
术中解剖胆囊三角、分离出“胆囊管”后,沿其向胆囊和肝脏逆行追踪游离,结果证实其319例为实际胆囊管或其安全部位;3例向上追踪解剖后发现为实际为肝(胆)总管,2例为变异的肝外右后叶胆管汇入胆囊管变异(图2C-D,对应于图1H)。 该5例均经改变解剖部位、重新游离确认胆囊管后切除胆囊。324例共发现各种胆管变异4例,2例如上述介绍;1例残余胆囊炎,术前MRCP提示可能存在胆囊管汇入肝外右后叶胆管,经逆行追踪法证实(图3,对应于图1G);另1例为胆囊管与肝总管平行低位汇入胆总管(对应于图1B)。
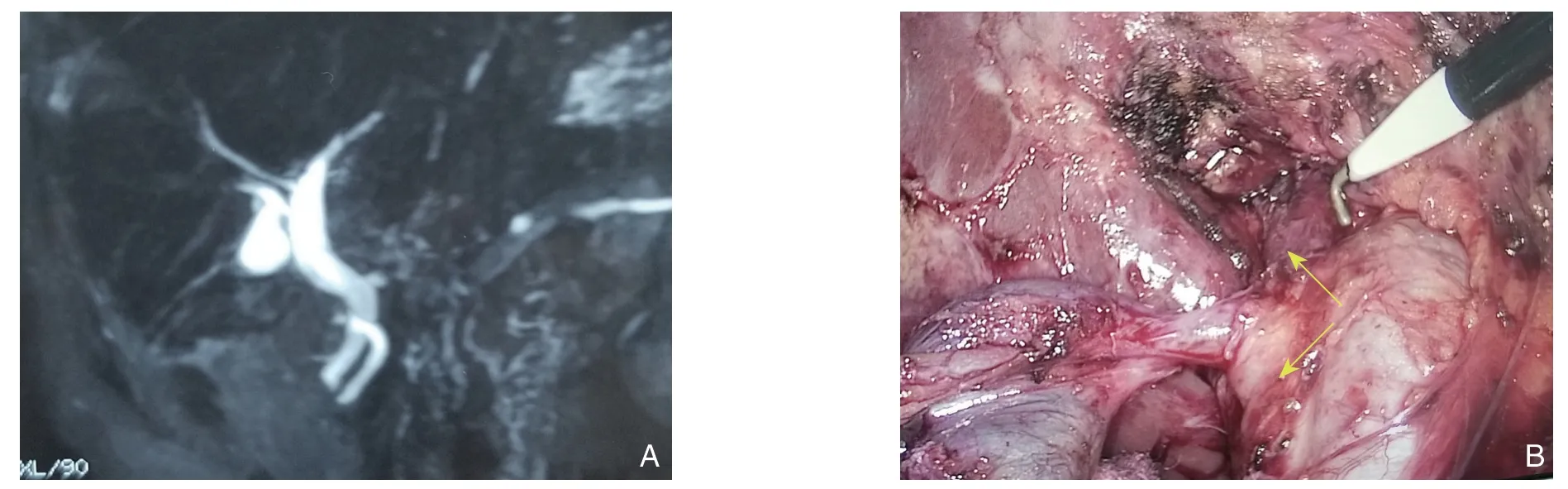
图3 残余胆囊炎患者胆囊管汇入肝外右后叶胆管 A:术前MRCP;B:术中经逆行追踪法解剖证实为胆囊管汇入变异右后叶胆管(黄色箭头)Figure 3 Cystic duct opening into extrahepatic right posterior sectoral duct in one case with Residual cholecystitis A: Preoperative MRCP; B: Cystic duct opening into right posterior sectoral duct (yellow arrow) found by retrograde tracing
2.2 手术结果
324例LC手术全部完成,无中转开腹,LC成功率100%。手术时间25~210 min,平均64.3 min;术中出血量2~150 mL,平均7.3 mL 。所有手术仅 1例术后出现轻微胆汁漏、胆囊区少量积液,穿刺孔感染2例,经穿刺引流、伤口换药而愈;其余患者未发现BDI[12],均恢复顺利。术后住院时间1~13 d,平均 2.6 d。1个月后复诊未见黄疸、腹痛和发热等异常。
3 讨 论
预防BDI的主要策略与方法有:术前必要的影像学检查、加强训练、提高术者BDI的警觉性[4,13]、 安全规范的手术操作、钝性分离[6-7]、术中导航 定 位[14]、以Rouviere沟[9,15-17]、Hartmann袋或前哨淋巴结作为解剖标志[18-19]、对分离出的管道反复多次辨认、或应用术中超声检查(intraoperative ultrasound,IUS)[20-21]、术中胆道造影(intraoperative cholangiography,IOC)[22-24]、术中注射吲哚菁绿荧光造影[25-27]、后三角入路[8-9]、胆囊(或壶腹)浆膜下径路[10-11]、胆囊动脉入路[28]、逆行胆囊切除或次全切除[29-30]以及适时中转开腹等。这些方法已为外科医师熟知、应用,对提高LC安全性,降低BDI发生率,发挥了重要作用。但这些方法有的比较繁琐或需要特殊设备,或延长手术时间、增加患者费用,且均不能完全预防BDI的发生,故有必要进一步探讨新的、更加有效的预防策略。
笔者近年在诊治不同类型BDI(横断或者切除)的基础上,结合LC实践,凝练提出一种新的预防BDI理论和方法,即逆行追踪法。有认为其日常LC即如此游离,因而不算新方法。但查阅文献,并无相关文献予以介绍或加以凝练命名为沿“胆囊管”逆行追踪法。与众多预防方法相比,逆行追踪法强调:在L C 初始分离出“胆囊管”后,应紧贴其向胆囊和肝脏方向逆行追踪游离,然后根据其是否汇入胆囊或发自肝内胆管,以甄别其真假,判断其是否为真实的胆囊管或胆囊管的安全部位。如游离后证实为真胆囊管,方可断夹、安全切除胆囊。否则应改变解剖部位,重新寻找胆囊管,直至胆囊切除。这是其根本不同之处,因而是一种新理论或新概念。
首先,本研究选取临床常见的8 种胆管结构(变异)图,应用逆行追踪法进行模拟解剖。如沿实际胆囊管或其安全部位向胆囊和肝脏逆行游离,则发现其并非发自肝内胆管,则可安全断夹之,并切除胆囊。如沿正常或变异胆管(类似于实际手术中可能分离出的假胆囊管)逆行追踪,会发现该其发自肝脏;此时,只要终止操作、改变解剖路径,就可避免BDI;否则,会致严重缺损。继之,本研究又在324例LC患者中进行临床应用。术中解剖胆囊三角、分离出“胆囊管”后,应用逆行追踪法向胆囊和肝脏游离,结果证实发现319例为真实胆囊管;另5例出自或与肝内胆管连通,而非真实的胆囊管或其安全部位。借助逆行追踪法,安全完成所有LC,仅1例术后出现轻微胆汁漏,无其他BDI发生,同时还发现4例胆管变异。
笔者体会逆行追踪法有如下优点:⑴ 可有效预防BDI。逆行追踪法强调,LC分离出“胆囊管”后,无论其是否为真实胆囊管,均应先紧贴其向胆囊和肝脏方向逆行追踪游离,以判断其真伪,再决定是否断夹或改变解剖部位,从而有效避免B D I,本组仅1 例术后发生轻微胆汁漏,效果显著。即便“胆囊管”于分离之初已被切断,如继续沿其向上逆行游离时发现为正常或变异胆管,则不会再将其于近肝处切断,就可避免胆管缺损这种严重的损伤。因为,仅有胆管横断者,对端吻合比较简单,疗效肯定;如被切除导致缺损过长,则不易对端吻合,多需行胆管空肠Roux-Y吻合术[31-34],日后易发返流性胆管炎或吻合口狭窄。⑵ 操作简便,不需要特殊仪器设备。无论术者分离出的“胆囊管”真假,只要沿之继续逆行解剖,均可进行甄别。当然,如遇重度炎症粘连,难以显示胆囊管和胆囊前三角等极端情况时,需结合其他方法如先解剖后三角、钝性解剖等,以助显露,为逆行“逆行追踪法”应用创造条件,本组共有急性胆囊炎57例(其中急性化脓或坏疽性胆囊炎12例),萎缩性胆囊炎7例,通过上述方法均能解剖出胆囊管,然后逆行分离以辨真假。⑶ 不刻意追求胆囊三角的解剖。逆行追踪法强调沿分离出“胆囊管”逆行追踪,以甄别其真假,无需拘泥于胆囊三角的解剖。⑷ 有助于发现胆管变异。模拟解剖显示,逆行追踪法能很好识别各种胆管变异。LC患者术前多行超声检查,无法判断是否存在胆管变异。但如果LC时严格采用逆行追踪法,则可发现潜在的胆管变异,并规避损伤。本研究共发现4例胆管变异,其中3例术前并无MRCP资料。因此,逆行追踪法同样适用于伴有各种胆管变异时的LC。
总之,逆行追踪法是一种新的预防BDI概念,具有安全有效、操作简便等优点,可作为其他预防方法的有益补充,值得临床进一步研究应用。当然,本研究所提逆行追踪法预防BDI,并不包括胆管撕裂伤、电灼伤及血管损伤等;其创新性、安全性和有效性还需多中心、前瞻性临床对照研究来检验。

