低剂量头颅CT扫描最佳迭代算法(ASIR-V)权重的初探
姜露 胡智军 李豆 贾永军 魏东红 郭江 韩冬 刘振堂
以往头颅CT扫描由于设备硬件条件、迭代算法、头颅解剖结构的限制,图像质量和辐射剂量一直是大家非常关注的问题[1]。随着近几年CT设备不断更新,多模型迭代算法不断发展,为低剂量头颅CT扫描检查提供可能[2]。本组研究主要探讨低剂量头颅CT扫描联合第三代多模型迭代算法ASIR-V技术,获得最佳诊断图像质量与Post-ASIR-V权重相关性研究。
资料与方法
1.患者资料
前瞻性选取2018年3月~2018年4月体检者60例。男42例,女18例,年龄23~62岁,平均(38.46±8.46)岁。将60例随机分为A、B两组,每组30例(表1)。
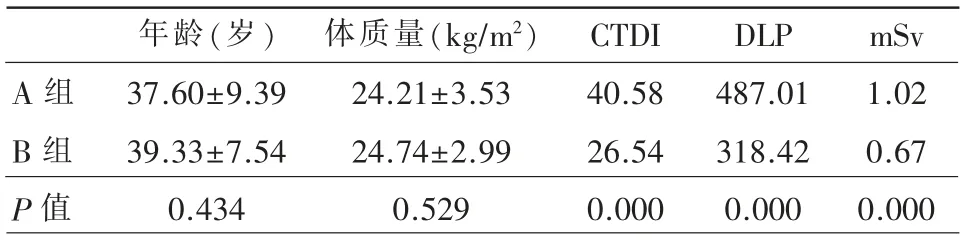
表1 患者一般资料及辐射剂
2.扫描设备及方法
扫描设备:采用GE Revolution CT进行扫描。
扫描方法:患者仰卧,头先进,扫描基线为听眦线,从颅底扫描到颅顶,脑窗观察图像。扫描条件A组120 kV,固定毫安280 mA并采用FBP进行重组;B组100 kV,固定毫安为280 mA并采用Post-ASIR-V重组权重分别为:0%、20%、40%、60%、80%、100%。两组均采用轴扫方式进行扫描,准直器宽度120 mm,扫描层厚为5 mm,后重组层厚为1.25 mm,转速1.0 s/r,共采集24层图像。CT剂量:表示受检者接受CT检查的X线剂量,有CT权重剂量指数(weighted CT dose index,CTDI)、剂量长度乘积(douse-length product,DLP)并计算有效辐射剂量(effective dose,ED),计算公式为ED=DLP×k,k=0.0021 mSv/(mGy·cm)。
3.图像客观测量
将上述图像用头颅的窗宽/窗位(90/40HU)显示,在后颅窝层面、基底节区层面和半卵圆中心层面放置兴趣区(ROI),采集面积约1 cm2,分别在连续3个层面测量其CT值、SD值求平均值,并计算信噪比SNR=CT值/SD值,所有测量均选择无病灶区,采用单因素方差分析对CTDI、DLP、ED辐射剂量相关因素进行客观评价(表2)。
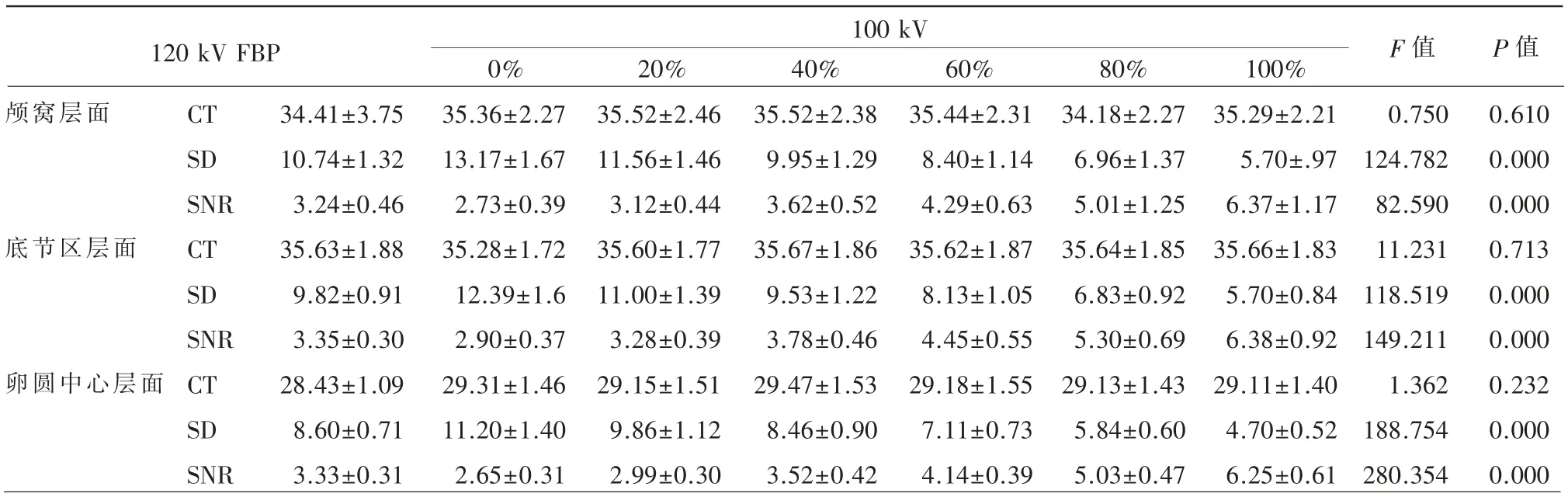
表2 A、B组客观图像质量评价表(均数±标准差,HU)
4.图像主观评价
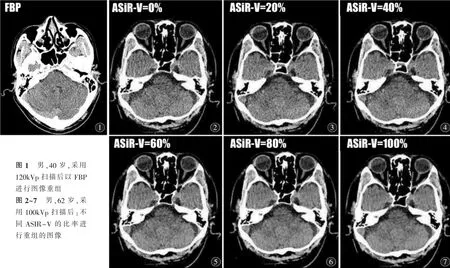
由2名高年资影像医师在PACS上进行采用双盲评价。不显示图像的扫描条件,分析图像质量。2名医师一致良好。采用三分法[3]对图像质量评价:3分为图像质量较好,无明显伪影;2分为图像有少许伪影但不影响诊断;1分为图像有严重伪影(表3)(图1~7)。
5.统计学处理
采用SPSS 21.0统计软件对数据进行统计学分析,比较A、B两组扫描剂量产生的CTDI、DLP及ED,并作单因素方差分析。Kappa对两名医师的一致性进行统计学分析,一致性良好(Z>0.65),一致性一般(Z=0.40~0.65),一致性差(Z<0.4)对主观评分采用秩和t检验对不同Post-ASIR-V权重图像质量进行统计学分析最佳权重,卡方检验对A,B两组图像质量进行统计学分析两组差异性无统计学意义(P>0.05)。
结 果
1.辐射计量比较
不同剂量组CT扫描的一般资料和X线辐射剂量见表一。A、B两组扫描的CTDI分别为40.58、26.54 mGy,DLP分 别 为487.01、26.54 mGy·cm并计算有效辐射剂量(effective dose,ED),计算公式 为ED=DLP×k,k=0.0021 mSv/(mGy·cm),经t检验,P<0.01,差异有显著性意义,100 kVp低剂量组与120 kVp常规剂量有效辐射剂量降低了34.31%。

表3 A、B组主观图像质量评价表
2.噪声比较
各组剂量SNR值经统计学分析后,两组中各感兴趣层面的SNR之间P<0.01,差异均有统计学意义,且随着Post-ASIR-V权重由0%~100%递增SD值逐渐减低,SNR逐渐增高,图像质量相应提高,各组间差异具有统计学意义(P<0.01)。
3.图像质量主观评价比较
100 kVp与120 kVp组对病灶的检出率均为100%,但当B组Post-ASIR-V权重在60%时,主观评分最高,图像质量最佳。
讨 论
头颅CT临床上最多常规检查,CT辐射剂量的伤害一直是大家关注的焦点问题。随着设备硬件更新换代,第三代新模型迭代算法的革命,低辐射剂量扫描已成为可能[4]。第三代新模型自适应统计迭代ASIR-V平台[5],目前该算法在国内外开始广泛应用临床。ASIR-V通过基于噪声、物体及物理光学3个模型降低噪声、提高密度分辨力、抑制伪影,进一步改善图像质量,ASIR-V在降低辐射剂量[6]。ASIR-V优于之前临床上主流的算法是FBP、ASIR、MBIR[7]。有研究表明ASIR-V第三代新模型迭代算法不但可以降低图像噪声,提高图像质量;而且在保持图像质量的前提下,使降低辐射剂量变成了可能[8]。
在CT检查过程中,不同kVp图像质量与Post-ASIR-V的权重有一定相关性,即不同kVp要得到最佳图像质量其Post-ASIR-V的权重也不同[9],图像质随Post-ASIR-V递增SD逐渐呈下降趋势,图像质量逐步提高。本研究中当100 kV组Post-ASIR-V权重大于60%时,图像质量逐渐下降。McCollough等[10]在 文中提 到CTDIvol在 美国及国际范围内都被确认,这个值可以指导医学物理学家对扫描协议的设置与调试,也可把患者的扫描范围及扫描部位相结合,预估患者的辐射剂量。日本放射协会诊断参考指南[11]也是用CTDI及DLP来评价患者辐射剂量,剂量以CTDIvol及DLP这两个指标为参照,可在不同的机型及扫描方案间进行对比。
近些年,迭代重组算法的开发已成为研究的热点[12,13]。因为迭代重组算法所需的投影数据少,可在低辐射剂量条件下重组较高质量的图像。随着计算机运算能力的大幅提高,迭代重组算法运算时间大幅缩短,已逐渐取代传统FBP算法。早期的迭代重组算法纳入了系统噪声模型,可提供比FBP重组算法质量更高的图像。噪声在成像的过程中是CT设备不可避免的只能用概率统计方法来描述的随机误差信号,会干扰有效信号的解读。噪声模型是采用多种数学方法对噪声的特性进行描述和表达,最终实现对噪声水平的控制。有文献显示,在相同图像质量条件下迭代重组算法与FBP重组算法相比可降低25%~60%辐射剂量[14,15]。ASIR是一种混合迭代重组算法,即图像由迭代图像与FBP图像按一定比例混合而成:ASIR 30%,表示图像由ASIR与FBP以3∶7的权重比例混合而成;ASIR 0%即FBP图像;ASIR 100%即完全的迭代重组图像。Ning等[16]报道,与FBP相比,在相同剂量下,ASIR 50%可降低SD 28%~32%,提高对比噪声比28%~39%;在图像质量一致的条件下,可降低辐射剂量36%。本研究中对ASIR的评价结果与文献[17]报道一致。早期迭代重组算法的特点是基于统计学原理进行数据空间和图像空间迭代运算,但除了仅有的系统噪声模型外缺少更完善的多模型系统,易造成噪声频率的改变和漂移,易出现蜡像状伪影。继单一模型迭代重组算法之后,多模型迭代重组算法进一步改善图像质量。由于在运算时纳入更多模型,因此多模型迭代重组算法包括MBIR(model-based iterative recon struction,商品名Veo;GE公司)和IMR(itera tive model reconstruction;Philips公司)[18,19]。以Veo为例,运算时纳入的模型包括系统光学模型、系统噪声模型、物体模型和物理模型,较FBP可降低噪声约80%。由于运算时间长,目前无论是Veo还是IMR均难以投入临床检查使用。近期开发的ASIR-V[20]改善图像质量的能力优于ASIR,而运算速度快于Veo。与Veo的4个模型不同,ASIRV放弃了系统光学模型。系统光学模型的作用在于提高图像空间分辨力,却是最为消耗运算时间的模型,因此ASIR-V的运算速度远快于Veo。ASIR-V保留噪声、物体及物理3个模型的目的在于降低噪声、提高密度分辨力、抑制伪影。由于较ASIR进一步改善图像质量,ASIR-V在降低辐射剂量方面的作用也进一步增强。
依据低剂量技术使用原则(ALARA)要求[21],操作者根据机型的特点进行必要的扫描方案调整。120 kV组的噪声与100 kV组相比,有统计学差异,且100 kV组中各后置ASIR-V权重之间噪声的差异也具有统计学差异,笔者认为临床可以推荐使用100 kV低剂量头颅CT扫描,并联合60%后置迭代重组获得最佳头颅CT图像,且较120 kV组降低34.31%辐射剂量。本研究也具有一定的局限性:(1)采集的病例数较少,未能够进行大样本分层研究;(2)本实验使用100 kv管电压,未尝试更低的管电压。今后有待进一步研究。
综上所述,Revolution CT100 kV低管电压技术结合Post-ASIR-V 60%重组算法,可降低辐射剂量,且图像质量可满足诊断。

