李斯特菌溶血素通过激活PI3K/Akt 信号通路促进呼吸道上皮细胞炎症反应及MUC5AC表达
尹 芳 胡月圆 易 娟 李贵南
(湖南省儿童医院新生儿二科,长沙410007)
单核细胞增生李斯特菌(Listeria monocyto-genes,LM)是一种常见的革兰阳性致病菌,其主要以食物为媒介通过消化道传播。感染人和动物可引起脑膜炎、败血症、流产等症状,病死率高达30%[1]。由于LM耐受性强、在轻度感染的情况下易被忽视等特点,使得LM成为目前世界范围内感染最为严重的致病菌之一。目前研究发现LM入侵人体是否引起致病与菌体含量和宿主的年龄及免疫状态有关。LM是一种胞内寄生的致病菌,宿主对其清除作用只能依靠细胞免疫功能[2]。因此,易感者以新生儿、孕妇以及免疫功能缺陷者为主。近年来,新生儿感染LM引发肺炎的病例逐年上升,其主要通过孕妇的胎盘传播。LM感染后可使新生儿出现发热、呼吸急促、呼吸困难、窒息等显著的呼吸道症状。
李斯特菌溶血素(Listeriolysin O,LLO)是LM的关键毒力因子,主要由hly基因编码,是胆固醇依赖性细胞溶素家族成员之一。研究发现hly基因敲除菌株并不具有体外溶血活性,对小鼠也不能产生感染症状[3]。LLO能与胆固醇共同作用于细胞膜,并在细胞膜上形成孔状结构,进而使LM从液泡中释放以逃避巨噬细胞的免疫攻击。此外,LLO还能诱导T细胞发生凋亡从而减弱机体的免疫功能[4,5]。考虑到LLO的多种功能及其对于LM致病的重要性,深入研究LLO作用的分子机制对于预防控制LM感染意义重大。本研究通过探讨LLO引起的宿主细胞炎症反应以及MUC5AC表达与磷酯酰肌醇3激酶/蛋白激酶B(Phosphatidylinositol-3-kinsae/protein kinase B,PI3K/Akt)信号通路的关系,希望能为阐明LM致病的分子机制提供实验依据。
1 材料与方法
1.1实验材料 人呼吸道上皮细胞株(16-HEB)购自美国ATCC细胞库国内代理商;LLO由本实验室原核表达纯化制备;RNA提取液、Trizol试剂盒购自北京奥维亚生物公司;cDNA逆转录试剂盒购自上海斯信生物科技有限公司;p-Akt抗体、Akt抗体、β-actin抗体购自美国Cell Signaling Technology公司;IL-6、IL-1β检测试剂盒购自eBioscience公司;MUC5AC试剂盒购自武汉优尔生科技股份有限公司;RT-PCR引物设计合成均由上海生物工程有限公司完成;细胞培养试剂、耗材均购自Sigma公司。
1.2方法
1.2.1细胞培养及细胞处理 冻存的16-HEB细胞株37℃快速溶解后加入含10%胎牛血清的DMEM培养基(含1%的青霉素-链霉素混合液),于37℃、5%CO2的细胞培养箱中培养。待细胞密度达85%以上进行细胞传代。将细胞按相应比例稀释后置于24孔板或者新的细胞瓶中,分别用浓度为15、30、45 μg/ml的LLO刺激细胞,24 h后收集细胞及上清待用。用20、40 μmol/L的PI3K抑制剂LY294002预处理细胞后,再用45 μg/ml的LLO刺激细胞24 h后收集细胞及上清待用。
1.2.2qRT-PCR 将上述收集的细胞使用Trizol试剂盒提取总RNA,纯化后按照逆转录试剂盒说明书使其逆转录为cDNA,随后按照qRT-PCR反应体系进行引物扩增。扩增完毕后,使用2-ΔΔCt法计算IL-6、IL-1β以及MUC5AC mRNA的转录水平。PCR引物设计如下:MUC5AC上下游引物:5′-CCATAGTACAGTGGTCGATGC-3′、5′-GATCGATACATGGGTA-GACTT-3′;IL-6上下游引物:5′-GCCTTCGGTCCA-GTTGCC-3′、5′-GCGCAGAATGAGATGAGTTGTCATG-3′;IL-1β上下游引物:5′-ACTACAGCAAGGGCTT-ACAGG-3′、5′-TCTTTCAACACGCAGGACAG-3′。
1.2.3Western blot检测 收集上述处理后的细胞,超声破碎后得到细胞总蛋白。采用BCA法进行蛋白定量。将各样本浓度调整一致后,按照Western blot说明书进行配胶、加样、跑胶、转膜,用5%脱脂奶粉室温封闭2 h,随后加入稀释好的一抗4℃孵育过夜。第二天洗膜后再加入稀释好的二抗室温孵育2 h。最后将配制好的ECL发光液均匀滴加在膜上,置于显影仪中显影,随后以β-actin为内参采用 Image J2X软件进行灰度值扫描,计算相对表达量。
1.2.4ELISA检测 收集上述处理后得到的细胞上清,采用双抗体夹心ELISA法检测IL-6、IL-1β以及MUC5AC,并于酶标仪450 nm处测定OD值。最后按照相应的ELISA检测试剂盒说明书计算IL-6、IL-1β的含量以及MUC5AC的浓度。
2 结果
2.1LLO诱导MUC5AC表达 为了观察LLO对MUC5AC表达的影响,我们采用浓度为15、30、45 μg/ml 的LLO刺激16-HEB细胞株24 h后,qRT-PCR以及ELISA检测细胞内MUC5AC mRNA转录水平和细胞上清中MUC5AC浓度。结果如图1所示,随着LLO浓度的增加,MUC5AC mRNA转录水平以及MUC5AC浓度都呈递增趋势,且均显著高于未处理的对照组(P<0.05),表明LLO能够刺激16-HEB细胞株中的MUC5AC表达。
2.2LLO刺激产生IL-6与IL-1β 为了检测LLO刺激产生炎症反应的情况,我们采用浓度为15、30、45 μg/ml的LLO刺激16-HEB细胞株24 h后,qRT-PCR以及ELISA检测细胞内炎性因子IL-6与IL-1β mRNA转录水平以及细胞上清中IL-6与IL-1β的含量。结果如图2所示,随着LLO浓度的增加,IL-6与IL-1β mRNA转录水平以及含量均显著增加,且高于对照组(P<0.05),表明LLO能够刺激16-HEB细胞株产生炎症反应。通过Pearson直线相关性分析发现IL-6与IL-1β mRNA的相关系数为0.94,浓度相关系数为0.96,表明IL-6与IL-1β的产生具有显著的相关性。
2.3LLO能够激活PI3K/Akt信号通路 为了检测LLO对PI3K/Akt信号通路的影响,我们按照上述处理后收集细胞提取总蛋白,Western blot检测细胞中p-Akt的表达情况。结果显示,p-Akt的表达随LLO浓度的增加而递增,且较对照组差异显著(P<0.05),提示LLO能够激活PI3K/Akt信号通路(图3)。

图1 不同浓度LLO对MUC5AC表达的影响

图2 不同浓度LLO对IL-6与IL-1β产生的影响
2.4PI3K抑制剂LY294002抑制p-Akt的表达 为了检测PI3K/Akt信号通路与LLO刺激细胞产生炎症反应以及MUC5AC表达的关系,我们先用PI3K抑制剂LY294002处理细胞,并通过检测p-Akt的表达情况来验证对PI3K/Akt信号通路的抑制效果。结果显示,不同浓度抑制剂LY294002均能有效抑制p-Akt的表达(P<0.05),但抑制剂浓度20 μmol/L与40 μmol/L对p-Akt表达的抑制作用并无显著差异(图4)。
2.5抑制PI3K/Akt信号通路对MUC5AC表达的影响 为了确定PI3K/Akt信号通路与MUC5AC表达的关系,我们使用抑制剂LY294002预处理细胞后再用45 μg/ml的LLO刺激细胞,并检测细胞中MUC5AC的表达情况。结果如图5所示,抑制p-Akt表达后能够显著降低细胞中MUC5AC mRNA转录水平以及MUC5AC浓度(P<0.05),提示抑制PI3K/Akt信号通路能够降低LLO刺激引起的MUC5AC表达。

图3 不同浓度LLO对p-Akt表达的影响
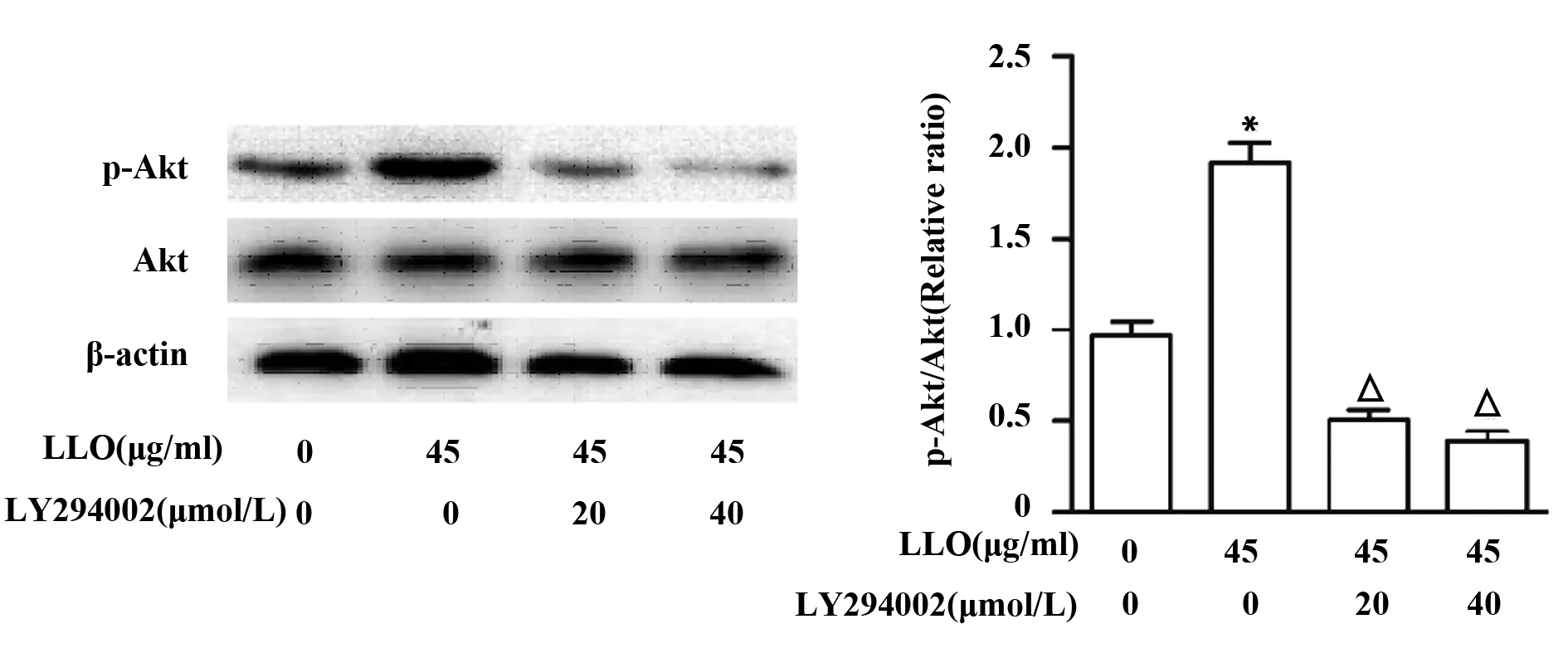
图4 抑制剂LY294002对16-HEB细胞株中p-Akt表达的影响

图5 抑制PI3K/Akt信号通路对细胞中MUC5AC表达的影响

图6 抑制PI3K/Akt信号通路对细胞中炎性因子产生的影响
2.6抑制PI3K/Akt信号通路对IL-6、IL-1β产生的影响 为了确定PI3K/Akt信号通路与炎症反应发生的关系,我们使用抑制剂LY294002预处理细胞后再用45 μg/ml的LLO刺激细胞,并检测细胞中炎性因子IL-6、IL-1β的产生情况。结果如图6所示,抑制p-Akt表达后能够显著降低细胞中IL-6、IL-1β mRNA的转录水平以及含量(P<0.05)。提示抑制PI3K/Akt信号通路能够减轻LLO刺激引起的炎症反应。
3 讨论
LLO是由LM分泌的一种重要的成孔毒素,其能在LM感染的早期和晚期裂解吞噬泡,从而使LM在感染入侵宿主细胞时能够逃避宿主靶细胞的清除[6]。尽管已有研究表明LLO是LM入侵宿主细胞的关键信号分子[7],能够激活NF-κb、磷脂酰肌醇、钙信号通路。但其是否能够激活PI3K/Akt 信号通路,并通过PI3K/Akt信号通路的活化进一步引起致病作用,目前尚不清楚。本研究通过探讨LLO刺激细胞产生炎症反应以及MUC5AC表达与PI3K/Akt信号通路的关系,旨在进一步明确LLO致病的分子机制。
Akt是真核细胞中参与信号转导的关键分子,它能够参与调控细胞凋亡、细胞侵袭等多方面的功能。PI3K家族作为Akt激活过程中的关键环节,其在许多呼吸道以及肺组织炎症反应中均发挥了至关重要的作用[8]。有研究表明,通过抑制PI3K/Akt信号通路来抑制蛋白激酶C-δ的表达,能够减轻过敏性呼吸道炎症反应[9]。此外,卵清蛋白引起的呼吸道过敏性反应可能也是通过激活PI3K/Akt信号通路引起的[10]。本研究通过Western blot检测发现LLO能够刺激16-HEB细胞株中p-Akt的表达,有效激活PI3K/Akt信号通路,提示其可能也与LLO引起的呼吸道炎症反应有关。
黏蛋白主要是由呼吸道和消化道分泌的一类大分子糖蛋白,其在呼吸道中主要发挥清洁润滑以及保护作用。目前人类已知的黏蛋白已达18种,MUC5AC作为其中一种重要的胶样黏蛋白,其表达水平的变化能直接反映呼吸道感染与炎性病变的发生情况。当人体出现呼吸道的炎性疾病时,MUC5AC分泌会明显增加,进而发挥相关的保护作用[11,12]。本研究通过采用不同浓度的LLO刺激16-HEB细胞株,发现MUC5AC的转录水平及浓度均显著上升,表明LLO与LM引起的呼吸道病变密切相关,该结果与之前的报道相符。
有研究表明,MUC5AC在呼吸道炎症反应中会出现过度分泌的情况,有效控制MUC5AC过度分泌对于开发相关的呼吸道感染药物至关重要[13]。本研究采用PI3K抑制剂LY294002处理细胞后,先通过Western blot验证抑制效果,再进一步检测细胞中MUC5AC转录水平与浓度的变化情况,发现抑制PI3K/Akt信号通路能够有效降低MUC5AC的表达,提示LLO刺激MUC5AC表达与PI3K/Akt信号通路有关。该结果也为寻求控制MUC5AC过度分泌的分子靶点提供了依据。
炎症反应是机体常见的一种病理过程,其通常由促炎细胞因子所介导,主要包括IL-1β、TNF-α、IL-6、IL-8等[14]。促炎细胞因子是机体在炎症早期分泌的一种细胞因子,它能够直观反映机体炎症的发生情况。其中IL-6是由Th2细胞以及单核细胞等产生的一种重要的细胞因子,其致炎作用已经得到证实。IL-1β则是由内皮细胞、成纤维细胞等在应答感染时分泌的细胞因子,它能够促进B细胞增殖分泌抗体,进而促进免疫调节[15]。本研究发现不同浓度的LLO均能有效刺激细胞产生IL-6、IL-1β,该结果进一步证实了LLO在呼吸道感染中的致炎作用。随后我们采用抑制剂抑制PI3K/Akt信号通路后,同样发现LLO刺激产生的IL-6、IL-1β显著降低,提示LLO刺激产生的炎症反应也与PI3K/Akt信号通路有关。
综上所述,本研究通过初步探讨LLO刺激16-HEB细胞株产生炎症反应以及MUC5AC表达的分子机制。发现LLO能够激活PI3K/Akt 信号通路进而诱导16-HEB细胞株产生炎性因子IL-6、IL-1β,并促进细胞中MUC5AC的表达。这为进一步明确LM的致病机制,开发有效的预防治疗药物奠定了实验基础。