骨髓间充质干细胞及其来源的微泡在慢性肾衰竭中的修复机制①
秦军建 邢艳芳 莫江彬 刘筱萍 侯铁奇
(广州医科大学附属第三医院,广州510150)
慢性肾衰竭(Chronic renal failure,CFR)是指各种原因造成的慢性、进行性肾实质损害,导致肾脏明显萎缩,难以维持其基本功能,临床上以代谢产物潴留,水、电解质及酸碱失衡,全身系统受累为主要表现的临床综合征,其严重影响我国居民的健康及生活[1]。目前,临床上对于CFR治疗以透析、肾脏移植治疗为主,通过透析能替代部分肾脏功能,但是难以替代肾脏的内分泌、代谢功能等,导致临床死亡率较高。肾脏移植由于供体数量相对有限,移植后医疗费用、移植后并发症发生率较高,难以在基层医院推广实施[2]。随着干细胞移植理论和技术的不断发展,为慢性肾衰竭的治疗提供了新的方法。文献报道显示:干细胞在特定的条件下除了能分化为骨、软骨、脂肪细胞外,还能向肾脏细胞、神经细胞等分化,并且干细胞来源相对较广[3]。因此,利用干细胞技术寻找有效的方法促进肾脏损伤修复、重塑能为肾脏病的治疗开辟新的方向。
骨髓间充质干细胞(Mesenchymal stem cells,MSC)是一类特殊的细胞,由于细胞分离、制备方法简单并且植入机体后免疫原性较低而在组织工程中广泛使用[4]。文献报道显示:MSC细胞可塑性相对较强,能在特定的条件下向多种细胞分化,而用于肾脏疾病中则能促进缺损部位修复、再生[5]。国内学者研究表明[6]:移植外源性MSC用于肾脏疾病中有助于改变肾脏局部微循环,促进血管生成,降低炎症反应发生。但是部分学者认为干细胞移植后主要通过旁分泌减轻肾脏损伤[7]。文献报道显示:MSC移植后能促进肾脏缺损部位修复,改善局部微循环,防止损伤细胞凋亡[8]。骨髓间充质干细胞分泌的微泡(Micro-vesicles,MVs)是从细胞表面脱落或细胞区室释放的小圆形膜片,但是微泡的生物学意义并未得到重视[9]。研究表明[10]:微泡能通过多种不同的方式影响靶细胞的行为,将其用于骨髓间充质干细胞修复慢性肾衰竭中有助于促进肾功能恢复,但是不同学者试验结果存在争议。本研究以2015年5月~2016年3月医院实验室进行试验的SD大鼠42只作为研究对象,探讨骨髓间充质干细胞及其来源的微泡制备方法及在慢性肾衰竭中的修复机制,现报道如下。
1 材料与方法
1.1材料
1.1.1对象 选择2015年5月~2016年3月广州医科大学附属第三医院实验室进行试验的SD大鼠(8周龄)42只作为研究对象,雄雌随机,体质量186~215 g,平均(200.08±10.63)g,所选动物均由广州医科大学医学动物实验中心提供,许可证号:SCXK(新)2011-0004。SD大鼠饲养时控制实验室恒温(20±2)℃,恒湿(50~60)%,SD大鼠常规饲养,自由摄食、饮水,光照12 h,建模前12 h禁食,试验均通过医院动物委员会批准同意。2只大鼠用于骨髓间充质干细胞制备,40只大鼠用于慢性肾衰竭模型制备。随机取10只大鼠设为空白对照组;30只大鼠建模后随机数字法分为阳性对照组(n=10)、干细胞组(n=10)及微泡干预组(n=10)。
1.1.2主要仪器和试剂 冰冻切片机、DMEM/F12细胞培养液、RIPA Lysis Buffer 蛋白裂解液、细胞计数板、倒置相差显微镜成像系统、手术器械一套、脂质超声微泡造影剂等相关试剂和仪器厂家见表1。
1.2方法
1.2.1骨髓间充质干细胞的制备和鉴定 ①细胞的分离、培养。利用密度梯度离心法完成单一核细胞分离,采用贴壁方法完成细胞的培养。取2只健康的SD大鼠,采用浓度4%戊巴比妥钠麻醉后脱毛,将大鼠固定在操作台上,在无菌条件下将双下肢胫骨、股骨取出,剔除肌肉及结缔组织,浸泡在PBS中,剪掉大鼠股骨与胫骨两端,采用含10 kU/L的肝素盐水连续冲洗,收集冲洗液。向冲洗液中加入4 ml分离液并一同移到10 ml离心管中,2 000 r/min离心20 min,获得4层离心液,取第二层离心液,悬浮,2 000 r/min离心5 min,去除上层清液,放入完全培养基对细胞进行培养,每天换液一次,取悬浮生长细胞,每3 d换液一次,待细胞融合80.0%~90.0%后进行传代培养[11]。②MSC细胞鉴定。采用流式细胞仪测定细胞表面特异性抗原。取第三代生长的细胞,PBS 2次冲洗,采用消化液对细胞进行1~2 min消化,显微镜下观察细胞形态,待50.0%圆形细胞时加入终止液,采集细胞1 000 r/min离心5 min,重悬在EP管中,向上述分离制备细胞中加入CD29一抗,孵育30 min,荧光标记后加入二抗,孵育30 min,采用流式细胞仪完成CD29检测,设置对照组细胞,完成细胞的鉴定[12]。
表1主要仪器和试剂
Tab.1Maininstrumentsandreagents

Major instruments and reagentsManufacturer/LotFrozen slicerLeica CM1900DMEM/F12 cell culture fluidUnited States GibcoRIPA Lysis Buffer Protein LysateChina BiyuntianInverted phase contrast microscopeGermanyCell counting plateShanghai refinement of biochemical rea-gents Co,Ltd.Flow cytometerBecton Dickinson,USASurgical instrumentsHospital supplyLipid ultrasound microbubblecontrast agentPrepared according to the Institute of Radiology using conventional methodsOptima L-90K UltracentrifugeBeckman Coulter
1.2.2慢性肾衰竭模型制备及处理方法 ①动物模型建立。取40只健康SD大鼠,取10只大鼠设为空白对照组;30只大鼠采用肾切除5/6合并高盐饮食3个月方法建立大鼠慢性肾衰竭模型。手术器械经过高压消毒、灭菌,对每只大鼠采用2%异氟醚、氧气吸入方法麻醉,待麻醉生效后进行常规消毒、铺巾,从腹部中线纵行切开皮肤,确定腹主动脉的位置,从腹主动脉去除血,利用两步法完成5/6肾脏切除手术完成大鼠慢性肾衰竭动物模型,2/3左肾采用带有电极止血钳进行融化;第二次术后1周结扎并切断右侧肾脏血管、周围组织,将右侧肾脏摘除。SD大鼠建模后采用高盐连续喂养3个月。②慢性肾衰竭大鼠处理。 阳性对照组建模成功后不采取任何措施处理,干细胞组进行移植骨髓间充质干细胞治疗,经尾静脉注射1 ml骨髓间充质干细胞(细胞密度为2.0×106个/ml);微泡干预组移植骨髓间充质干细胞后以强度为1.0 W/cm2及频率为1 MHz 超声微泡辐照。将建模后大鼠经尾静脉注射0.5 ml造影剂,密度为2.0×106个/ml,辐照参数:强度为1.0 W/cm2及频率为1 MHz超声微泡辐照,辐照5 s,停5 s,连续进行1 min[13]。
1.2.3观察指标 ①细胞形态观察。取分离、培养获得的细胞,分别在培养第1天、第3天及传代后在倒置显微镜下观察细胞形态、生长方式[14]。②细胞表面特异性抗原测定。采用流式细胞仪对制备培养的骨髓间充质干细胞及对照组细胞表面特异性抗原CD29进行测定[15]。③肝细胞生长因子(HGF)、表皮生长因子(EGF)蛋白表达。4组大鼠修复7 d后每组处死大鼠5只,取出肾组织,提取肾组织总蛋白,采用Western blot测定HGF、EGF蛋白表达条带吸光度值[16]。④炎性反应及细胞黏附分子1。4组大鼠处理前、后经尾静脉取血 3 ml,完成血清分离后采用酶联免疫吸附试验测定各组肿瘤坏死因子α(TNF-α)及细胞黏附分子1水平,有关操作严格遵循仪器操作说明书完成[17]。⑤HE染色。4组大鼠均连续进行30 d干预,修复完毕后每组处死大鼠5只,取肾脏组织,制备5 μm切片,行HE染色[18]。

2 结果
2.1实验大鼠数量 本研究中纳入42只SD大鼠,大鼠全部纳入试验结果,中途未发生死亡、脱落。
2.2制备骨髓间充质干细胞的培养 刚接种的MSC细胞1 d后培养瓶底可见多种形态细胞,为了进一步纯化细胞,3 d 换液一次,细胞纯化呈梭状、纺锤状,以旋涡方式生长;细胞贴壁后生长迅速,细胞传代一次需要3 d,经过3代培养后细胞数量相对较多,见图1。
2.3制备培养的骨髓间充质干细胞表面特异性抗原测定 流式细胞仪测定结果表明:对照组细胞表面CD29几乎不表达,而MSC细胞表面CD29阳性率为91.54%,符合骨髓间充质干细胞的表面特征,见图2。
2.4Western blot完成4组大鼠HGF、EGF蛋白测定 Western blot结果表明:HGF蛋白在4组相对分子量为82 000部位存在特异性条带;而EGF蛋白则在4组相对分子量为5 500部位存在特异性条带,且微泡干预组特异性条带较粗,其次为干细胞组,见图3。
2.54组SD大鼠炎性反应及细胞黏附分子1水平比较 微泡干预组与空白对照组TNF-α及细胞黏附分子1水平差异无统计学意义(P>0.05);微泡干预组TNF-α水平,低于干细胞组与阳性对照组(P<0.05);微泡干预组细胞黏附分子1水平高于干细胞组与阳性对照组(P<0.05);干细胞组TNF-α水平低于阳性对照组(P<0.05);干细胞组细胞黏附分子1水平高于阳性对照组(P<0.05),见表2。
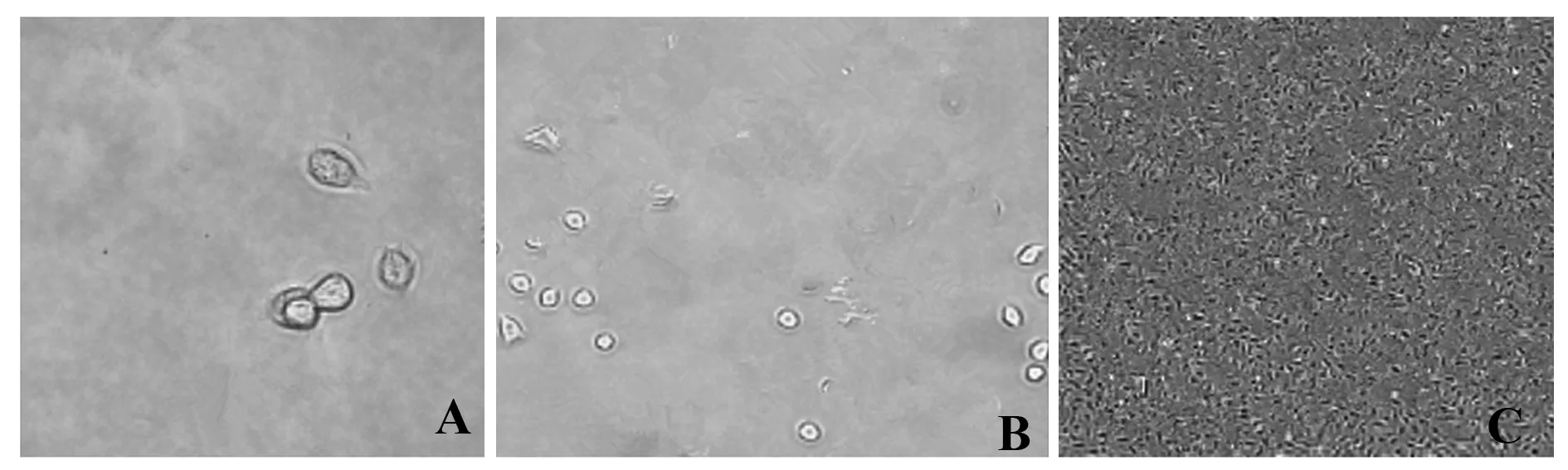
图1 制备细胞不同时间点形态Fig.1 Preparation of cells at different time points morphologyNote: A.The 1 d morphology of cell culture;B.The 3 d morphology of cell culture;C.The morphology of cells after subculture.

图2 制备细胞表面特异性抗原测定Fig.2 Preparation of cell surface specific antigen assayNote: A.The expression of CD29 in the control group;B.The expression of CD29 in the MSC.
2.64组大鼠修复30 d后HE染色结果比较 阳性对照组建模后未经任何处理,肾脏损伤明显,存在大量炎性细胞;空白对照组未参与建模,肾脏组织完整,未见肾脏组织损伤;干细胞组修复30 d后肾脏损伤缓解,仍存在少许炎性细胞;微泡干预组修复后30 d肾脏组织损伤明显改善,未见炎性细胞,见图4。
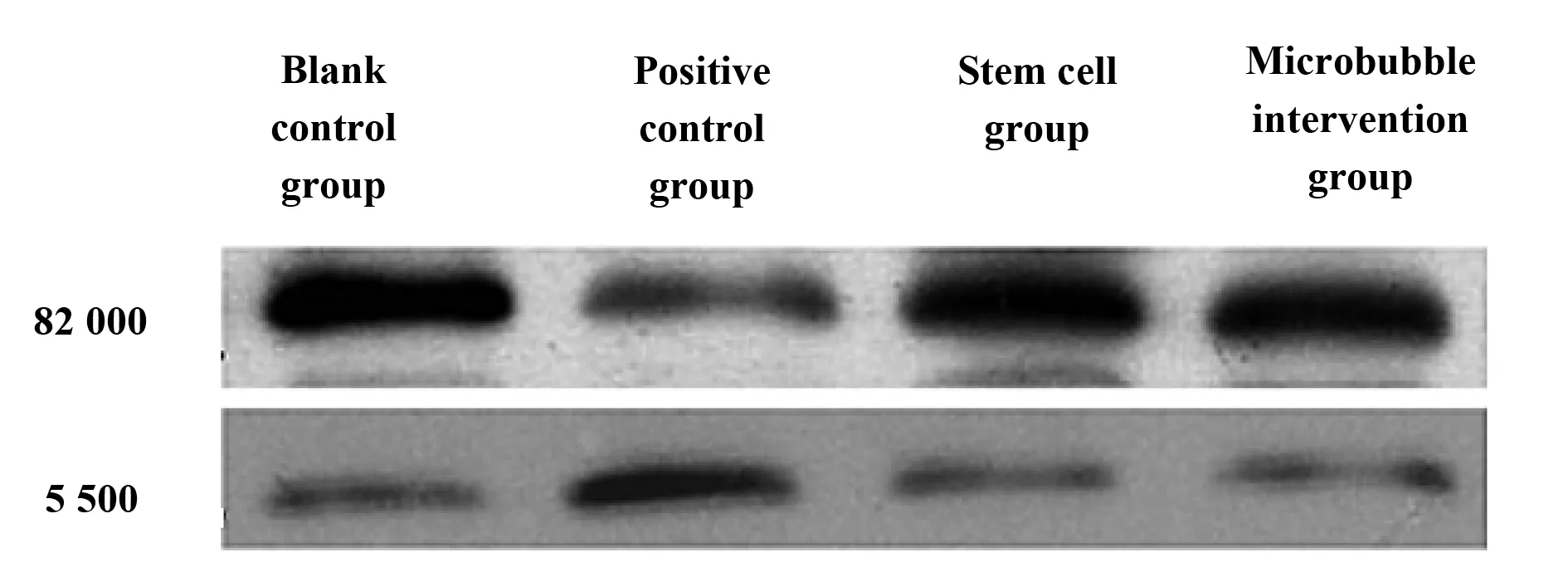
图3 Western blot完成4组大鼠HGF、EGF蛋白测定Fig.3 Four groups of rats HGF,EGF protein determination by Western blot
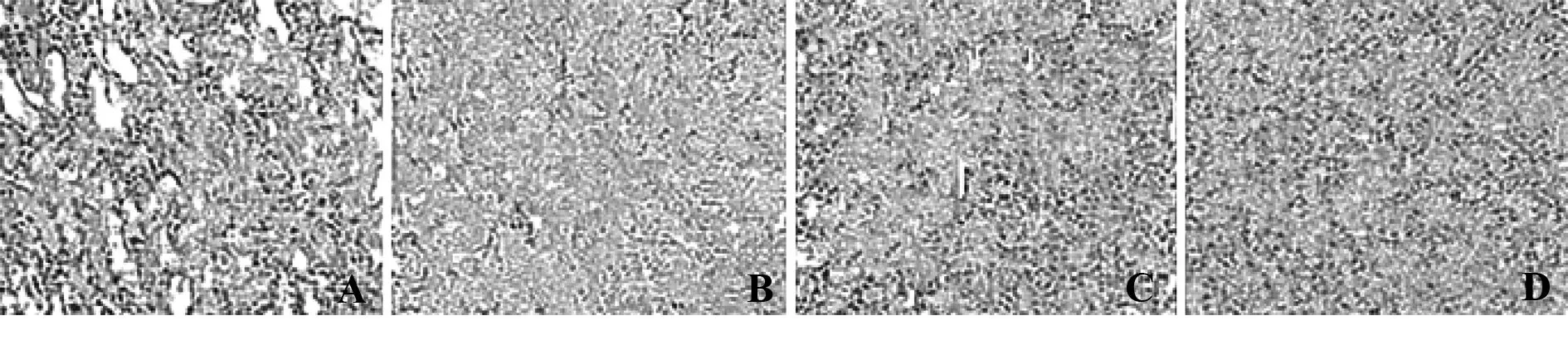
图4 4组大鼠修复30 d后HE染色结果比较(×200)Fig.4 Comparison of HE staining results in four groups after 30 days of repair(× 200)Note: A.The positive control group HE staining;B.The blank control group HE staining;C.The stem cell group HE staining;D.The microbubble intervention group HE staining.
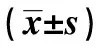

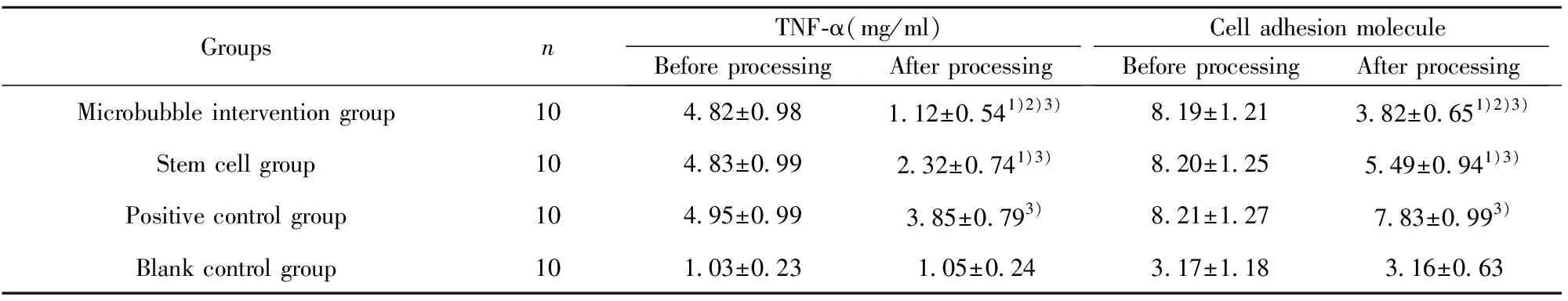
GroupsnTNF-α(mg/ml)Before processingAfter processingCell adhesion moleculeBefore processingAfter processingMicrobubble intervention group104.82±0.981.12±0.541)2)3)8.19±1.213.82±0.651)2)3)Stem cell group104.83±0.992.32±0.741)3)8.20±1.255.49±0.941)3)Positive control group104.95±0.993.85±0.793)8.21±1.277.83±0.993)Blank control group101.03±0.231.05±0.243.17±1.183.16±0.63
Note:1)P<0.05 compared with positive control group;2)P<0.05 compared with stem cell group;3)P<0.05 compared with blank control group.
3 讨论
干细胞是一类相对复杂的细胞群,在特定的条件下能实现多向分化、自我更新。目前,临床上研究相对较多的是源于骨髓中的成体干细胞和间充质干细胞[19]。国外学者研究表明[20]:将间充质干细胞用于心肌梗死、脑梗死、肝功能衰竭中能取得理想的效果,间充质干细胞能分泌促进细胞生长的因子,从而为MSC细胞移植营造良好的微环境。随着医疗技术的不断发展,MSC细胞在肾脏疾病治疗中也取得理想的效果[21]。本课题中,采用密度梯度离心法完成单一核细胞分离,采用贴壁方法完成细胞的培养及鉴定。本研究中,细胞换液一次细胞纯化呈梭状、纺锤状,以旋涡方式生长;细胞贴壁后生长迅速,细胞传代一次需要3 d,经过3代培养后细胞数量相对较多;流式细胞仪测定结果表明:对照组细胞表面CD29几乎不表达,而MSC细胞表面CD29阳性率为91.54%,制备细胞CD29呈阳性。骨髓间充质干细胞修复慢性肾脏损伤机制可能为:干细胞能为肾脏部位细胞提供更多的生长环境,细胞通过局部调节受损免疫及炎症反应有助于促进血管的生成及重建,能在特定的条件下分化为血管内皮细胞,有助于促进自身的修复,抑制肾小管上皮细胞的分化,有助于减少胶原的形成[22,23]。但是,骨髓间充质干细胞的移植修复慢性肾脏损伤时受到的影响因素较多,包括体外增殖及定向迁移潜能、移植过程中细胞密度过高、过度传代等,均会造成干细胞提前衰老,导致细胞出现多边形态、影响修复效果[24]。
干细胞植入的有效性及靶向性是干细胞移植治疗慢性肾衰竭的关键,且最近超声介导微泡的生物学效应被广泛关注及研究。微泡能引起空化效应导致一些微观的生物学反应,能引起局部炎症反应,产生相应的细胞因子等[25]。经过微泡处理后能增加骨骼肌毛细血管细胞黏附分子1及血小板源生长因子表达水平,从而促进骨缺损修复能力。本研究中,微泡干预组TNF-α水平低于干细胞组与阳性对照组(P<0.05);微泡干预组细胞黏附分子1水平高于干细胞组与阳性对照组(P<0.05);干细胞组TNF-α水平低于阳性对照组(P<0.05);干细胞组细胞黏附分子1水平高于阳性对照组(P<0.05)。提示:微泡能提高慢性肾衰竭组织细胞黏附分子1表达水平,有助于抑制炎症因子水平。国外学者采用超声介导微泡后产生的生物学效应用于非缺血性心肌病中均取得理想效果,其机制均与超声介导微泡产生局部生物学效应,使细胞黏附分子表达增加,可能通过调节心肌组织胶原的合成和降解,改善心肌局部胶原的含量,同时促进骨髓间充质干细胞归巢从而实现修复缺损部位的目的[26]。HGF蛋白及EGF蛋白均能加速肾损伤后的修复。通常而言,EGF存在肾脏细胞表面受体酪氨酸激酶激活细胞信号,从而使微泡介导的骨髓间充质干细胞能缩短肾损伤的修复[27]。同时,肾脏祖细胞及上皮细胞对于EGF均能发生明显的增生反应,而HGF则对于肾脏衍生细胞、肾脏固有细胞能发挥良好的有丝分裂、变形、运动及分化能力[28,29]。本研究中,Western blot结果表明:HGF蛋白在4组相对分子量为 82 000 部位存在特异性条带;而EGF蛋白则在4组相对分子量为5 500 部位存在特异性条带,且微泡干预组特异性条带较粗,其次为干细胞组。此外,本课题从组织学角度对超声辅助微泡后骨髓间充质干细胞修复慢性肾衰竭效果进行分析,结果表明:阳性对照组建模后未经任何处理,肾脏损伤明显,存在大量炎性细胞;空白对照组未参与建模,肾脏组织完整,未见肾脏组织损伤;干细胞组修复30 d后肾脏损伤缓解,仍存在少许炎性细胞;微泡干预组修复后30 d肾脏组织改善未见炎性细胞。由此看出:干细胞及微泡处理后的骨髓间充质干细胞均能促进慢性肾脏损伤修复,但是微泡处理后修复效果更加,能为慢性肾脏损伤修复提供新的思路[30]。
综上所述,采用全骨髓法能分离培养骨髓间充质干细胞,将频率为1 MHz、强度1.0 W/cm2脉冲超声辐照微泡用于慢性肾衰竭大鼠骨髓间充质干细胞修复中有助于抑制炎性反应,提高细胞黏附分子1水平,具有广泛的应用前景。

