miR-145-3p在多发性骨髓瘤中表达及其对多发性骨髓瘤细胞凋亡与自噬作用机制的研究
任明亮,李 辉,刘冬斌,陈国雄,谭镇南,刘 鹄
(南方医科大学附属南海医院骨科,广东 佛山 528000)
多发性骨髓瘤(multiple myeloma,MM)为一种浆细胞系恶性肿瘤,目前尚无完全治愈方法,分析MM的发病机制可为靶向药物的研发提供依据[1]。微小RNA(miRNA)是一种非编码的RNAs,可同靶mRNA的3’端非翻译区(3’UTR)互补结合抑制mRNA翻译或降解mRNA链,因此miRNA可能通过影响mRNA翻译过程而影响细胞多种功能,近期有研究显示miR-21、miR-32、miR-19a和miR-92a参与MM发生发展[2,3]。而miR-145、miR-145-3p也是miRNA家族成员之一,被认为是肿瘤抑制基因,可靶向调控多个肿瘤相关基因,继而影响肿瘤生长、侵袭、转移及肿瘤血管生成,已有研究证实miR-145与急性髓系白血病、骨髓间充质干细胞成骨发生密切相关,但miR-145-3p对MM的调控机制研究较少[4,5]。本文分析了miR-145-3p在MM中表达情况及其靶向调控P21/ULK1/LAMP2信号通路对MM细胞的凋亡与自噬作用,现报道如下。
1 资料与方法
1.1一般资料2014年6月至2017年5月我院收治的MM患者60例(MM组)、健康体检者30例(正常组),纳入标准:①MM患者符合《中国多发性骨髓瘤诊治指南(2013年修订)》[6]中相关诊断标准,经组织活检或骨髓涂片、单克隆抗体免疫球蛋白、X射线检查确诊;②MM患者浆细胞在10%~30%;③均知情同意本研究并签署知情同意书,且正常组无心、肝、肾等重要脏器疾病。MM组男33例,女27例;年龄20~54岁[(37.15±4.03)岁],正常组男14例,女16例;年龄21~52岁[(37.12±4.05)岁],两组一般资料比较差异无统计学意义(P> 0.05),有可比性。
1.2方法
1.2.1miRNA提取及细胞株来源 所有入组患者均进行骨髓穿刺,留取新鲜血浆2~4 ml,采集血液样本均置于血常规EDTA-K2抗凝管,后采用QIAGEN试剂盒以Trizol法抽提miRNA,并取2 μl在核酸蛋白定量测定仪上测定OD值,进行鉴定与准确定量。MM细胞株U266、RPMI-8266、LP-1、H929(各30株),均由本院血液科提供,经MACS分选CD138+浆细胞作为正常对照组细胞。
1.2.2逆转录及引物设计与合成 按TaKaRa公司试剂盒COde NO.RR718提供说明书进行,20 μl混合反应液包括:dNTP 2 μl,10X RT Buffer 2 μl,RT特异引物(1 μm)0.3 μl,Total RNA 100 ng,MMLV反转录酶(200 U/μl)0.2 μl,RNA酶抑制剂(40 U/μl)0.3 μl,RNase Free dH2O补足至20 μl,逆转录条件:16 ℃ 30 min;42 ℃ 40 min;85 ℃ 5 min。
1.2.3荧光定量PCR反应 以荧光定量PCR法(ABI7900实时荧光PCR仪,购自美国Applied Biosystems公司)检测miR-145-3p水平,反应体系:2×Master Mix 5 μl,cDNA 2 μl,10 uM的PCR特异引物F 0.5 μl,10 μm的PCR特异引物R 0.5 μl,以RNase Free dH2O补足至10 μl,反应条件:95 ℃ 10 min,95 ℃ 10 s,60 ℃ 20 s,循环40次;95 ℃ 10 s,60 ℃ 60 s,95 ℃ 15 s。
1.2.4细胞转染实验 ①选取毒性最低的人骨髓瘤细胞株LP-1(30株),在37 ℃、5%二氧化碳培养箱中,加10%胎牛血清、1%双抗(青霉素100 U/ml、链霉素0.1 mg/ml)进行常规培养,调整细胞至最佳状态,计数后调整浓度,细胞密度为1×105/ml;②吸取2.5 μl miR-145-3P mimic/inhibitors[均由广州阅博生物技术公司负责设计合成,其中miR-145-3P mimic为miR-145-3P的模拟物(mimic组),miR-145-3P inhibitors为miRNA抑制物(inhibitor组),均为即用型],同时设立转染对照组[siR-RiboTMTransfection Control(Cy3),Standard,1 nmol],三组各10株;③取1 μlRNAimax试剂加入Opti-MEM混合液,轻柔混匀,将稀释好的试剂在室温下静置20 min;④在24孔细胞平板中加入500 μl细胞悬液,混匀,miR-145-3P终浓度为150 nM(miR-145-3P inhibitor为250 nM);⑤收集细胞,以流式细胞仪(FC500MCL,美国贝克曼库尔特公司)检测转染5 d内细胞凋亡情况。
1.2.5miR-145-3p基因作用靶点分析 采用生物信息学软件及网站miRanda、Targetscan等预测miR-145-3p与凋亡、自噬相关作用的靶点。以westren blot试验检测上述转染细胞中P21、ULK1、LAMP2水平:配制5%浓缩胶(1、2、3、4 ml)、12%分离胶(5、10、15、20 ml),放置在4 ℃冰箱备用,后取适量蛋白及5×loading buffer按4∶1混合,进行电泳转膜、封闭与抗体反应、显影、曝光成像。
1.3统计学方法采用SPSS 19.0软件处理数据。计量资料以均数±标准差表示,组内比较采用配对样本t检验,组间比较采用独立样本t检验,组内不同时点OD值及不同组间P21、ULK1、LAMP2水平比较采用重复测量数据的方差分析。P< 0.05为差异有统计学意义。
2 结果
2.1MM组及正常组miR-145-3p表达水平比较
MM组血浆及U266、RPMI-8266、LP-1、H929细胞株中miR-145-3p表达水平均低于正常组(P< 0.05)。见表1。
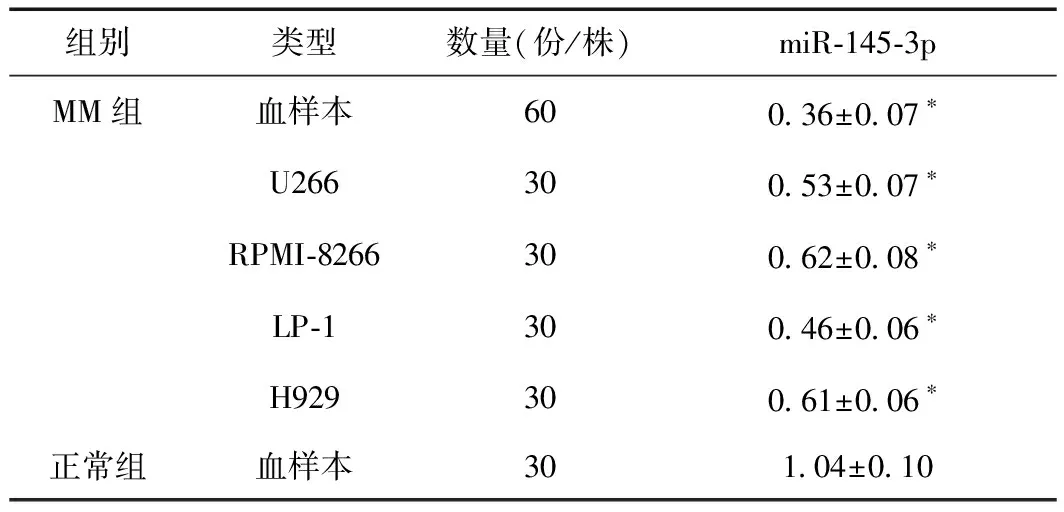
表1 MM组及正常组miR-145-3p表达水平比较
*与正常组比较,P< 0.05
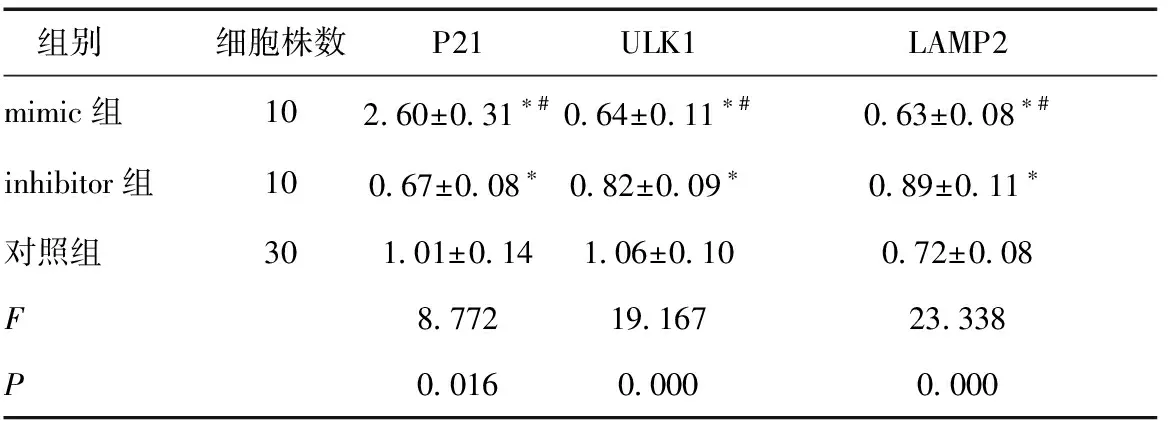
2.2不同转染细胞中OD值比较转染后随时间延长,三组OD值均增加,且转染后3 d及5 d OD值大小分别为mimic组<对照组 表2 不同转染细胞中OD值比较 *与转染1d比较,P< 0.05;#与对照组比较,P< 0.05;&与inhibitor组比较,P< 0.05 2.3不同转染细胞中P21、ULK1、LAMP2水平比较转染5 d后,mimic组P21水平高于inhibitor组、对照组,而ULK1、LAMP2水平低于inhibitor组、对照组(P< 0.05)。见表3、图1。 表3 不同转染细胞中P21、ULK1、LAMP2水平比较 *与对照组比较,P< 0.05;#与inhibitor组比较,P< 0.05 MM是起源于骨髓浆细胞的血液系统恶性肿瘤,患者骨髓中浆细胞克隆性增殖积聚,分泌单克隆免疫球蛋白或其片段,造血干细胞移植为治疗MM最有效方法,但受脊髓来源、配型及高医疗费因素影响,限制了其在临床的应用,而新型靶向药物应用为MM提供了新的选择,明确MM作用机制是研制新型靶向药物的关键[7]。大量研究证实,表观遗传学调控方式,包括miRNA、DNA甲基化、组蛋白修饰等调控在MM发生发展中起着重要作用,徐艳妮等[8]的研究发现miRNA家族中miR-29a、miR-155、miR-16值变化可作为MM的分子生物学诊断标志,其中miR-29a/miR-16值对MM诊断价值最高。而iR-145为近年来新发现的参与急性髓系白血病等细胞侵袭、转移、增殖、分化、凋亡的miRNA分子[9],有miR-145-5p、miR-145-3p两种形式,已有研究证实miR-145-5p在肺鳞状细胞癌、前列腺癌发病中起着重要作用,而关于miR-145-3p在MM中的作用机制尚不明确[10,11]。 图1 电泳结果(NC-miR为阴性对照) 本次研究结果显示荧光定量MM组血浆及细胞株(U266、RPMI-8266、LP-1、H929)中miR-145-3p水平均较正常组低,证实miR-145-3p在MM患者的血浆及细胞株中均发生了表达下调,体内体外实验结果均表明,在U266、RPMI-8266、LP-1、H929细胞株中低表达miR-145-3p可能促进MM发生发展,具有一定的临床应用潜力。药物主要通过抑制NF-κB的核转位,下调caspase蛋白酶家族等途径而诱导细胞凋亡,在MM药物治疗中,部分患者会出现caspase家族蛋白调控失控,导致凋亡途径异常,对地塞米松等药物耐受,因此分析其凋亡机制十分必要[12]。本次研究则发现,在分别转染miR-145-3p mimic、inhibitor后,随时间延长,mimic组、inhibitor组、阴性对照组OD值均增加,且转染后3 d、5 d OD值大小分别为mimic组<对照组 综上所述,miR-145-3p在MM患者中呈低表达状态,可能通过激活P21、抑制ULK1/LAMP2信号通路而促进细胞凋亡、自噬作用。
3 讨论


