单核细胞增生李斯特菌的耐药特征及机制
,,, , ,
单核细胞增生李斯特菌(Listeriamonocytogenes,Lm)是一种重要的食源性人兽共患病原菌,其对食品安全及人类健康的影响已经引起很多国家的高度重视。Lm引起的人和动物的李斯特菌病具有低发病率、高致死率的特点。据统计,人李斯特菌病发病率约每百万人0.1~11.3例,死亡率为20%~30%[1]。Lm具有第一代喹诺酮类药物、磷霉素和第三代头孢菌素的天然耐药性,对临床上常用于革兰氏阳性菌的各种抗生素均敏感[2]。但1988年[3]首例李斯特菌四环素耐受株出现以来,不断有研究报道从各类食品及临床病例中分离到一种甚至多种抗生素耐受的菌株[4]。弄清Lm耐药性的产生机制,从而控制多重耐药菌的产生和传播,已经成为我们面临的重要工作任务之一。
1 单核细胞增生李斯特菌耐药特征
细菌耐药问题一直是国内外的关注焦点和研究热点,WHO已将其列为本世纪最大的公共安全问题之一。长期以来世界各国均对不同来源的Lm的耐药性进行了密切监测,表1展示了不同地区食品及临床样品中分离的Lm的耐药情况。
在国内,2012年闫韶飞[5]等对分离自我国23个地区10类食品的635株Lm进行药敏实验,结果显示平均耐药率为10.39%,多重耐药率为1.1%,其中生猪肉(26.67%)和生牛肉(25%)中分离的菌株耐药率最高。2015年Shi W[6]等报道我国即食食品来源的Lm耐药率为67.5%,其中21.25%的菌株对两种及以上的抗生素耐受。国外Lm食品分离株耐药现状同样严峻。Lm污染的生肉、即食食品、水产品、冰淇淋和蔬菜进入食物链是造成欧洲、北美洲、亚洲和非洲等地区爆发的李斯特菌病的主要原因。在西班牙,Gómez[7]等报道2009-2012年间分离自肉制品及环境样品的206株Lm耐药率为34.5%,多重耐药率为2.9%。Chen[8]等报道美国水产及环境样品中分离的Lm对头孢噻肟、克林霉素的耐药率分别为71%和69%。在马来西亚,Lm即食食品分离株耐药率为57.6%,多重耐药率高达47.4%,对青霉素(53%)、四环素(15.6%)、万古霉素(9.4%)和红霉素(6.3%)的耐药尤其显著[9]。在埃塞俄比亚,Garedew[10]等报道2012-2013年分离自即食食品的Lm多重耐药率为16.7%。综合国内外研究报道,食品源Lm呈现耐药率不断升高和耐药谱逐渐变宽的趋势,无疑给李斯特菌病的临床用药造成一定困难。从菌株来源看,国内外动物性食品如禽畜肉类、即食食品中分离的Lm具有较高的耐药水平。据美国疾病防控中心统计,2013年美国市场上出售的抗生素中73%由兽医购买[11]。畜牧业中抗生素的大量使用导致了禽畜肉制品中抗生素的残留以及从中分离的菌株存在较高的耐药性。有研究表明,细菌耐药性与抗生素的消耗量有关[12]。一个典型的例子即四环素。国内食品源Lm对四环素耐药最为严重[5,13-15]。作为一类广谱抗生素,四环素常作为预防和治疗禽畜疾病或促进禽畜生长的饲料添加剂被大量应用于养殖业[16],抗生素对细菌的选择压力导致了Lm四环素耐药水平的提高。由此可见,细菌的耐药性与抗生素的使用密切相关,对于使用时间越久、使用范围越广、使用频率越高的抗生素,耐药现象越普遍[17]。
目前,临床上用于治疗李斯特菌病的药物主要为β-内酰胺类抗生素(氨苄西林、青霉素),可单独使用或与庆大霉素联合使用。常使用的备选治疗方案为甲氧苄啶和磺胺类药物[18]。Lm临床分离株的耐药监测对于科学合理用药至关重要,临床药物的误用或过度使用是细菌产生耐药性的一个重要原因。孙照琨[19]等对1963-2013年间国内临床Lm耐药率进行统计,复方新诺明、庆大霉素、丁胺卡那霉素、青霉素、环丙沙星和氨苄西林总体耐药率较高,分别为40.9%、23.0%、21.7%、18.9%、14.3%和11.1%。国外临床分离株耐药性同样不容乐观。Hansen J M[20]等报道1958-2001年间丹麦Lm临床分离株对庆大霉素(1.9%)、复方新诺明(6%)和环丙沙星(0.9%)耐受。在葡萄牙,Magalhaes R[21]等对Lm临床分离株进行耐药检测,结果显示环丙沙星、利福平、呋喃妥因和链霉素的耐药率分别为24.1%,13.8%,41.4%和58.1%,其中有29株(14.3%)对两种及以上抗生素耐药。Morvan[22]等报道1926-2007年间法国临床分离的4 816株Lm耐药率为1.27%,主要耐受四环素和喹诺酮类抗生素。1970-2008年间巴西Lm临床分离株的药敏实验结果显示利福平、复方新诺明耐药率分别为1.5%和2.9%[23]。Borcan[24]等对2009-2013年间罗马尼亚Lm临床分离株进行药敏试验,结果显示氨苄西林、青霉素耐药率均为7.7%。综上所述,尽管Lm临床分离株的耐药率和耐药种类在地区上存在差异,但许多国家均出现对氨苄西林、青霉素等临床一线药物耐受甚至多重耐药的报道,这无疑会导致临床经验性治疗难以奏效,给重症感染患者的治疗带来巨大困难。整体来看,临床和食品来源Lm均对β-内酰胺类、氨基糖苷类、喹诺酮类和磺胺类等抗生素表现出耐药性,提示耐药菌株存在经食品加工、销售环节传染给消费者的潜在风险,且部分人群因长期使用抗生素又会进一步导致细菌耐药性的增强。
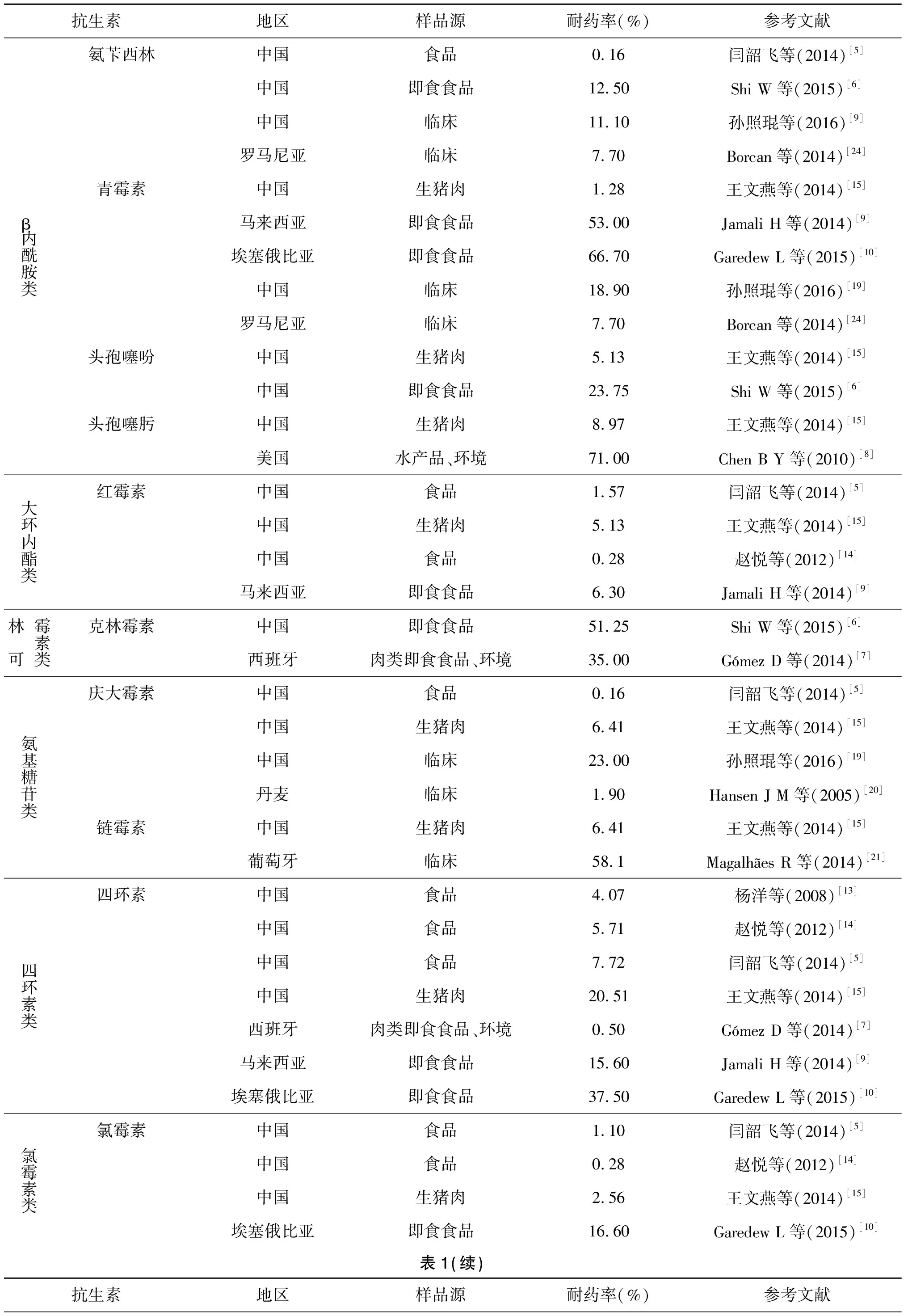
表1 不同地区食品及临床样品中分离的Lm耐药株Tab.1 Antibiotic-resistant Lm isolated from food and clinical in different regions
2 单核细胞增生李斯特菌耐药机制
在抗生素的选择性压力下,耐药菌株不断出现,特别是多重耐药性菌株,而耐药菌株通过动物产品产业链从农场到餐桌,最终造成严重的公共卫生问题。因此,弄清Lm的耐药机制对于李斯特菌病的预防和控制将具有重要意义。Lm的耐药机制十分复杂,包括可移动元件介导的耐药基因转移、药物作用靶点的改变、药物的外排作用、钝化酶或灭活酶的产生、生物被膜等多种机制。
2.1可移动元件介导的耐药基因转移 不耐药的Lm可以通过获得携带抗生素耐药基因的可移动元件产生耐药性。转座子、整合子和质粒等可移动元件在肠球菌和链球菌中普遍存在,并能在肠球菌、链球菌和李斯特菌内部及各菌种之间传递[25]。与四环素耐药密切相关的Tn916是一种广宿主接合性转座子,与Tn1545一起被称为Tn916/Tn1545家族。Tn916通常携带有tet(M)基因。tet(M)基因能通过接合作用从无害李斯特菌转移到Lm、绵羊李斯特菌和粪肠球菌,也可从粪肠球菌转移到Lm[26]。Tn1545在体内外都能通过接合作用从粪肠球菌转移到Lm[27]。质粒pIP501宿主范围广泛,可介导细菌对氯霉素类、大环内酯类、林可酰胺类和链霉素类抗生素的耐药性。pIP501可通过接合作用进入Lm胞内并进行复制,并能在李斯特菌属和链球菌之间转移[28]。
2.2药物作用靶点的改变Lm能通过改变或修饰抗菌药物结合靶位或使得药物作用的靶基因发生突变,使得靶基因表达产物的空间构型与理化性质发生变化,从而导致细菌对抗生素变得不敏感。Lm中存在的四环素耐药基因tet(M)、tet(S)能通过编码的核糖体保护蛋白(RPPS)与核糖体结合,从而阻止四环素对细菌蛋白合成的抑制作用,从而产生耐药性。Lm细胞膜上存在至少5种青霉素结合蛋白(PBP),β-内酰胺类抗生素通过与PBPs结合,抑制了细菌细胞壁的合成从而引起细胞死亡。而当细胞膜上PBPs数量减少或结构改变,抗生素与其结合力便显著降低,就会产生耐药[29]。部分Lm耐药菌株具有ermB、ermC基因,能够编码红霉素核糖体甲基化酶,降低核糖体与抗生素的结合力,介导Lm对红霉素的高水平耐药[30]。
2.3药物的外排作用 药物外排泵是位于细菌细胞膜上的一类功能性膜转运蛋白,当细胞内药物浓度达到某一临界值时,细菌能依靠主动外排泵出机制来降低细菌体内药物的浓度,从而使菌体产生耐药表型。对于金黄色葡萄球菌、大肠杆菌、绿脓杆菌等细菌,外排泵导致的耐药是其耐药的主要原因。Lm中存在MdrL和Lde两种外排泵,分别由mdrL和lde基因编码[31]。大环内酯类抗生素、头孢噻肟以及重金属和溴化乙锭均由MdrL泵出;Lde属于细菌外排系统中常见的主要易化子超家族(Major facilitator superfamily, MFS),是一种自足型多药外排转运蛋白,与Lm的喹诺酮耐药性密切相关,可利用质子偶联交换产生的质子驱动力外排多种化学结构不同的底物,从而降低细胞内相应物质的浓度。
2.4钝化酶或灭活酶的产生 产生灭活酶是引起细菌耐药性的机制之一。细菌产生的灭活酶主要有β-内酰胺酶、氨基糖苷类修饰酶等,这些酶可破坏抗生素或使之失去抗菌作用,使药物作用于菌体前就被破坏或失活。细菌由质粒介导或染色体突变而产生β-内酰胺酶,通过水解和非水解方式(酶与抗生素结合形成稳定的复合物)破坏β-内酰胺环,使抗生素失活。氨基糖苷类修饰酶是细菌对氨基糖苷类抗生素产生耐药的主要机制,其主要催化氨基糖苷类药物氨基或羟基的共价修饰,使得氨基糖苷类药物与核糖体的结合减少,促进药物摄取的EDP-II也被阻断而产生耐药性[32]。有报道Lm通过在肠球菌-链球菌中广泛存在的aad6基因,产生6-N-链霉素腺苷酰基转移酶,从而产生对链霉素的耐受[33]。
2.5细菌生物被膜的形成 生物被膜通过多种机制相互协调参与耐药形成,如通过屏障作用减少抗菌药物的渗透、形成类似芽孢细胞的状态使细菌对抗菌药物不敏感、细菌传感效应的调节等。有报道细菌在生物被膜状态下更容易吸收外源基因进入菌体细胞内,从而利于耐药基因的获得[34]。细菌形成生物被膜后,能抵抗百倍以上正常剂量的药物,呈高度耐药[35]。影响Lm生物被膜形成的关键因子有鞭毛糖蛋白、胞外DNA、胞外多糖、胞外结合蛋白和群体感应系统等[36]。鞭毛调节因子DegU通过调控鞭毛糖蛋白基因的转录直接影响生物被膜的形成。胞外DNA参与Lm粘附和生物被膜早期的形成,并与胞外多糖、胞外结合蛋白共同组成胞外基质。Lm的Agr群体感应系统可以直接正调控生物膜,也可通过调控毒力因子、耐药因子间接调控生物膜,是一种整体水平的调控网络体系。
3 展 望
李斯特菌病作为一种由Lm感染引起的食源性疾病,不仅影响食品安全甚至危及人类生命。近年来国内外食品及临床分离的Lm耐药谱逐渐变宽,中国、丹麦、巴西、罗马尼亚等国均出现对氨苄西林、青霉素等临床一线药物耐受甚至多重耐药菌株的报道。耐药菌株通过动物产品产业链从农场到餐桌进行传播,对公众健康带来威胁,最终造成严重的公共卫生问题。应加强对各种来源的Lm的分子流行病学研究及耐药性监测,临床上应谨慎、合理使用抗生素,减缓细菌耐药性的产生。弄清Lm的耐药机制对于李斯特菌病的预防和控制同样具有重要意义。
利益冲突:无

