宫颈癌组织中miR-216b 与FOXM1 表达及与临床病理特征的关系
王梦漪 卢宏达 陈 莉 雷 章
华中科技大学同济医学院附属武汉市中心医院肿瘤科,湖北武汉 430014
宫颈癌是常见的女性恶性肿瘤之一,在所有女性恶性肿瘤中排第三位,死亡率较高,严重危害女性健康[1]。手术治疗和局部放疗是目前主要治疗方案,但晚期患者治疗效果不佳,5 年生存率较低[2]。因而,有必要进一步研究其发生发展的分子机制。微小RNA(miR)是长度为18~25 个核苷酸的内源性非编码RNA 调控因子,参与细胞分化、细胞周期凋亡调控和细胞迁移等[3]。宫颈癌中存在多种miR 的异常表达现象,且miR 可通过调节下游靶基因的表达,参与肿瘤细胞增殖、侵袭和迁移等恶性生物学过程[4-5]。有研究报道显示[6],长链非编码RNAXLOC_008466 可作为分子海绵结合miR-216b,调控癌细胞的增殖及迁移。然而miR-216b 在宫颈癌中的表达及相关机制研究鲜有报道。叉头框蛋白M1(FOXM1)参与细胞的有丝分裂过程,该蛋白异常表达可导致因纺锤体缺陷引起的有丝分裂过程的延迟,进而影响癌细胞的增殖[7]。本研究中,通过检测宫颈癌组织中miR-216b 及FOXM1 表达情况,分析两者之间的相关性,初步探讨其作用机制及临床意义。
1 资料与方法
1.1 一般资料
选取2016 年3 月~2019 年3 月华中科技大学同济医学院附属武汉市中心医院(以下简称“我院”)诊治的宫颈癌患者84 例作为病例组,同期选取我院诊治的宫颈上皮内瘤变(CIN)患者40 例作为CIN 组,经病理确诊为子宫肌瘤患者40 例作为对照组。病例组年龄34~65 岁,平均(55.7±5.4)岁;病理类型:宫颈鳞癌63 例,子宫腺癌21 例;分化程度:高分化19 例,中分化32 例,低分化33 例;肿瘤分期参考2009 年国际妇产科协会(FIGO)制定的标准[8]:ⅠA2 期13 例,ⅠB1 期12 例,ⅠB2 期17 例,ⅡA1 期13 例,ⅡA2 期10 例,ⅢA 期12 例,ⅢB 期7 例;浸润深度:浅肌层例34 例,深肌层50 例;伴淋巴结转移13例,无淋巴结转移71 例;人乳头瘤病毒(HPV)16/18 阳性70 例,阴性14 例。CIN 组年龄35~65 岁,平均(55.5±5.8)岁;肿瘤分期:ⅡA1 期12 例,ⅡA2 期10 例,ⅢA期12 例,ⅢB 期6 例。对照组年龄42~66 岁,平均(54.7±5.1)岁。三组年龄比较,差异无统计学意义(P>0.05),具有可比性。本研究经我院医学伦理委员会批准。
纳入标准:①均经活检病理或术后病理学检查确诊;②均为初次诊治;③临床病理及随访资料完整;④患者均知情同意且签署知情同意书。排除标准:①合并其他器官恶性肿瘤;②合并上呼吸道感染等感染性疾病;③合并严重的心、肝等脏器功能不全。
1.2 方法
收集术中切取的部分病理组织,液氮速冻后,置于-80℃冰箱保存。取约30 mg 组织标本,Trizol 法提取总RNA。以5μL总RNA为模板,使用TaqManMicro-RNA 反转录试剂盒(美国ABI 公司,批号:20160219)进行逆转录合成cDNA。miR-216b 特异性茎环引物,正向引物:5′-GCCGCGCTAAAGTGCTTA-3′,反向引物:5′-CACCAGGGTCCGAGGT-3′,U6 上游引物:5′-CTCGCTTCGGCAGCACATATACT-3′,下游引物:3′-ACGCTTCACGAATTTGCGTGTC-5′,FOXM1 上游 引物:5′-CCGCTCGAGGGACTGTTCTGCTCCTCATAG-3′,下游引物:5′-ATAAGAATGCGGCCGCTGGCAGTCTCTGGATAATGATC-3′。荧光定量PCR 反应条件为:94℃,4 min;94℃,30 s;60℃,1 min;72℃,30 s;共40 个循环。总反应体系共20 μL,包括cDNA 2 μL,TaqDNA 聚合酶0.25 μL、上下游引物各0.1 μL、10×PCR缓冲液2.5 μL、10 mmol/L dNTPs 0.5 μL,ddH2O 补至20 μL。所有反应均在实时定量PCR 仪(美国ABI 公司)上完成,每个样本重复3 次。采用相对Ct 值方法进行数据分析,miR-216b 表达水平相对于内参基因U6 的比值为2-ΔΔCt,且ΔCt=CtmiR-216b-CtU6,FOXM1相对定量表达水平ΔCt=CtFOXM1-CtU6。
1.3 观察指标
观察三组miR-126b 及FOXM1 表达情况,miR-126b 及FOXM1 表达与临床病理特征之间的关系及其相关性分析。
1.4 统计学方法
采用SPSS 22.0 统计学软件进行数据分析,计量资料用均数±标准差(±s)表示,多组间比较采用单因素方差分析、SNK-q 法检验,两组间比较采用t 检验;相关性分析采用Pearson 线性相关分析。以P<0.05为差异有统计学意义。
2 结果
2.1 三组miR-126b 及FOXM1 表达比较
病例组miR-126b 表达水平显著低于CIN 组及对照组,FOXM1 表达水平显著高于CIN 组及对照组,差异均有统计学意义(均P<0.05)。CIN 组miR-126b水平显著低于对照组,FOXM1 水平显著高于对照组,差异均有统计学意义(均P<0.05)。见表1。
表1 三组miR-126b 及FOXM1表达比较(±s)
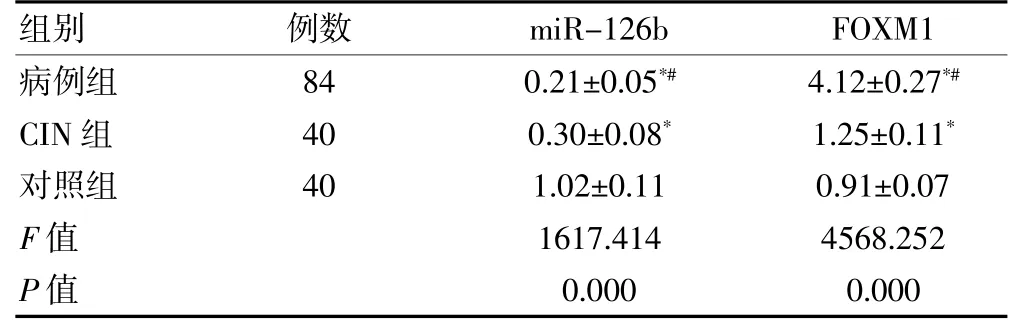
表1 三组miR-126b 及FOXM1表达比较(±s)
注:与对照组比较,*P<0.01;与CIN 组比较,#P<0.01。miR-126b:微小RNA-216b;FOXM1:叉头框蛋白M1;CIN:宫颈上皮内瘤变
2.2 miR-126b 及FOXM1 表达与临床病理特征之间的关系
miR-126b 及FOXM1 表达与FIGO 分期、肿瘤分化程度及浸润深度有关(P<0.05),与年龄、病理类型、有无淋巴结转移及有无HPV 16/18 感染无关(P>0.05)。见表2。
2.3 相关性分析
miR-126b 水平与FOXM1 水平呈负相关(r=-0.694,P=0.001)。
表2 miR-126b 及FOXM1 表达与临床病理特征之间的关系(±s)
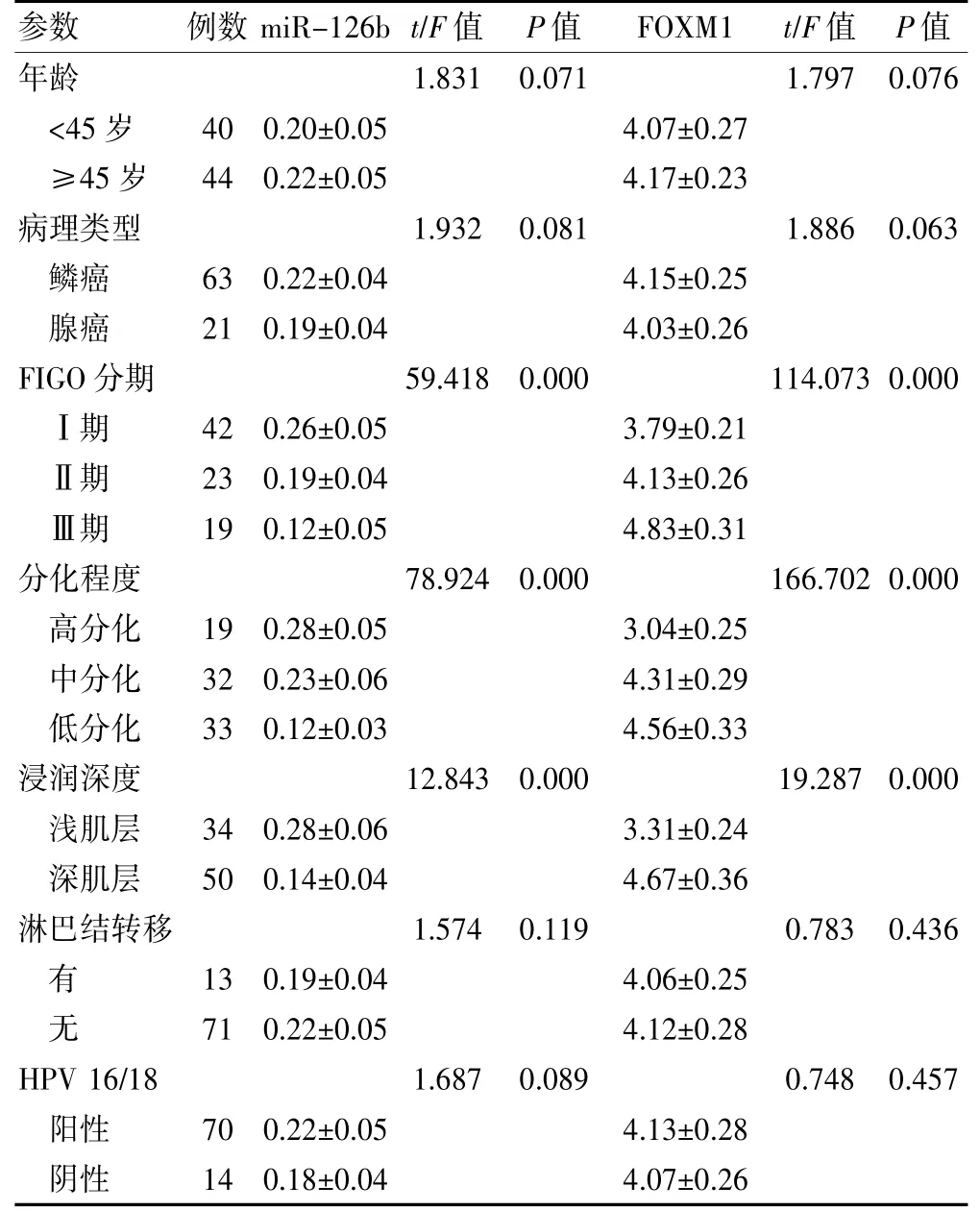
表2 miR-126b 及FOXM1 表达与临床病理特征之间的关系(±s)
注:miR-126b:微小RNA-216b;FOXM1:叉头框蛋白M1;FIGO:国际妇产科协会;HPV:人乳头瘤病毒
3 讨论
宫颈癌是致死率最高的妇科恶性肿瘤之一,中晚期患者预后更差。近年来,随着对宫颈癌分子机制研究的深入,新生物学标志物的发现及新技术的临床应用,患者的生存率提高,死亡风险降低[9]。但目前宫颈癌发生发展的分子机制尚不清楚,仍需寻找关键的诊断和治疗的分子生物靶点。研究显示,多种miRNA 如miR-375、miR-101 参与调控子宫颈癌细胞的增殖、迁移及侵袭过程[10-11]。miR-216b 在胰腺癌、乳腺癌等多种肿瘤中均存在表达异常,参与肿瘤的增殖、浸润和转移等过程的调控[12-13]。
本研究结果显示,病例组miR-126b 表达水平低于CIN 组及对照组,提示miR-126b 可能作为一种肿瘤抑制性miR,参与宫颈癌的发生发展过程。有学者在Hela、SiHa 及C33A 等宫颈癌细胞系中也发现miR-126b 表达下调现象[14],与本研究结果一致。但miR-126b 过表达可促进肿瘤细胞的增殖并抑制凋亡过程。目前miR-126b 表达下调的机制尚不清楚,可能与编码基因的突变或其他因子转录后调控有关。有研究报道[15],长链非编码RNA CCAT2 可以作为分子海绵结合miR-126b,抑制miR-126 功能,促进肿瘤细胞的增殖和转移。miR-126b 可以靶向调控自噬相关基因Beclin-1 和LC3-Ⅱ的表达[16],Beclin-1 表达下降和LC3-Ⅱ表达升高共同导致细胞自噬功能降低,促进肿瘤的发生发展。本研究结果显示,FIGO 分期越高、分化越差、肌层浸润越深,miR-126b 水平越低,提示miR-126b 水平能够反映病情严重程度,有可能成为新的相关肿瘤标志物。
FOXM1 在促进细胞周期G1/S 期和G2/M 期转换中发挥重要作用。本研究结果显示,病例组FOXM1 表达水平高于CIN 组及对照组,提示其可能与FOXM1 mRNA 的3′非编码区的miR 结合减少有关。在胶质瘤中,miR-876-5p 结合FOXM1 mRNA 后,抑制FOXM1表达,进而抑制肿瘤的进展[17]。此外,FIGO 分期越高、分化越差、肌层浸润越深,FOXM1 表达水平越高,提示FOXM1 可反映疾病严重程度、提示不良预后等。
高危型HPV 感染,如HPV 16、18 型,是宫颈癌发病的重要原因。本研究结果显示,HPV 感染与miR-126b 及FOXM1 表达水平无明显相关性,提示单纯HPV 感染并非是导致宫颈恶性转变的唯一因素,其他病因如基因突变、遗传易感性等均可能参与宫颈癌的发生发展[18]。此外,本研究结果显示,miR-126b 水平与FOXM1 水平呈负相关,提示FOXM1 可能作为miR-126b 的靶基因,受到miR-126b 的负向调控。骨肉瘤组织中也发现miR-126b 能结合FOXM1 mRNA的3′非编码区,抑制FOXM1 mRNA 的翻译过程,进而抑制肿瘤的增殖、浸润和转移[19-20]。但一种miR 可能存在多种靶基因,宫颈癌中FOXM1 是否是miR-126b的靶点及二者是否在宫颈癌发生发展过程中发挥关键作用,有待深入研究。
综上所述,宫颈癌组织中miR-126b 及FOXM1均异常表达,两者共同参与宫颈癌的发生发展过程,有可能成为宫颈癌诊断、治疗及预后评估的新肿瘤标志物。

