双层阳极微生物燃料电池系统降解偶氮染料及同步产电
汪莲,曹羡,冯羽中,张毅,李先宁
双层阳极微生物燃料电池系统降解偶氮染料及同步产电
汪莲,曹羡,冯羽中,张毅,李先宁
(东南大学 能源与环境学院,江苏 南京,210096)
构建一种新型单室双阳极微生物燃料电池(MFC)系统并用于处理难降解有机染料废水;研究进水染料质量浓度、水力停留时间和双层阳极间距对难降解有机物去除率和系统产电性能的影响;利用UV-Vis光谱扫描和气相色谱−质谱联用(GC−MS),分析降解过程中的一系列降解产物。研究结果表明:当系统通入200~600 mg/L的染料活性艳红X-3B时,单阳极和双阳极MFC系统的有机物去除效率并无较大差异,最大脱色率之差不超过10%;当系统通入800~1 000 mg/L的X-3B时,双阳极MFC系统表现出较好的脱色效果和较强的有机负荷耐受能力;当2个阳极层间距设为10 cm时,双阳极MFC系统(简称S-10系统)的处理性能最佳;当水力停留时间为1.5 d,进水X-3B质量浓度为1 000 mg/L时,S-10系统的脱色率可达96.34%,化学需氧量(COD)去除率为74.16%;上、下阳极的最大功率密度分别为0.150 W/m3和0.121 W/m3,系统内阻为1 053.1 Ω;苯胺是一种典型的X-3B降解中间产物。
微生物燃料电池;偶氮染料;生物产电;脱色降解
偶氮染料因其分子结构中含有1个或多个氮氮双键(—N=N—)而命名[1]。它是合成染料中使用最多的1个品种,约占有机合成染料总量的80%,现已成为工业使用量最大的1种染料。据统计,全世界每年消耗8万多t的偶氮染料[2],由此产生大量的偶氮染料废水。偶氮染料是一类难降解有机物[3],染料分子及其中间产物会对环境造成严重的危害。目前,处理偶氮染料废水的方法主要有物理、化学和生物方法,而物理化学法往往存在处理成本高、污染物降解不彻底、引发二次污染等问题[4],因此,人们致力于探索绿色环保、廉价高效的生物方法。微生物燃料电池(microbial fuel cell,MFC)是以微生物为催化剂将有机物中的化学能转化为电能的装置,结构上分为阳极区和阴极区,中间用质子交换膜隔开[5]。ZHU等[6]指出在单室微生物燃料电池(MFC)系统中,取消质子交换膜结构,不仅能降低构建和运行成本,而且能降低系统的内阻。MOHAN等[7]的研究表明,在电化学催化和生物降解的双重作用下,MFC系统对偶氮染料的去除效果得到增强。YADAV等[8]构建人工湿地型微生物燃料电池来处理染料废水,化学需氧量(COD)的去除率可达75%,最大功率密度为15.73 mW/m2。FANG 等[9]的研究发现,利用单室MFC系统处理染料废水,当水力停留时间(HRT)为3 d时,脱色率最高为92.83%。装置结构(如电极、基质、微生物等)和运行条件(水力停留时间、有机负荷)是影响MFC系统净化及产电性能的2个原因[10]。阳极作为产电微生物附着的载体,既影响产电微生物的附着量,还影响着电子从微生物向阳极的传递[5]。目前,人们对MFC的研究仍局限于单层阳极,对于双层阳极结构的研究较少。单室单层阳极MFC系统还存在着水力停留时间较长、污染物分配不均、电子传递速度慢[5]、污染物降解不平衡、反应条件不匹配等问题,为此,本文作者从装置构型的角度考虑,构建一种新型单室双层阳极MFC系统来处理染料废水,通过优化双层阳极间距、染料质量浓度、水力停留时间等试验参数,分析其影响机制,建立最佳的系统构型。
1 材料与方法
1.1 试验装置
本研究采用升流式MFC。系统由有机玻璃制成,试验装置如图1所示。装置上部分呈圆筒状,内径为30 cm,高为50 cm;筒身从底部向上,每间隔5 cm设置1个采样口。圆筒底部连接1个高为5 cm的锥形布水器。双层阳极的构造自下而上依次铺设砂砾层、下阳极层、砂砾层、上阳极层、砂砾层、阴极层。阳极层和阴极层由活性炭颗粒(直径为3~5 cm,比表面积为500~900 m2/g,填充密度为0.45~0.55 g/cm3)和不锈钢丝网构成,其中不锈钢丝网埋在电极层的中部以增强电子的转移[11]。阴、阳极均由钛导线(直径为1 mm)向外引出,并使用环氧树脂包裹暴露于溶液中的金属部分,防止金属与溶液接触发生反应而造成阴、阳极短路的现象[12]。外电路由铜导线连接1000 Ω的电阻形成闭合回路。
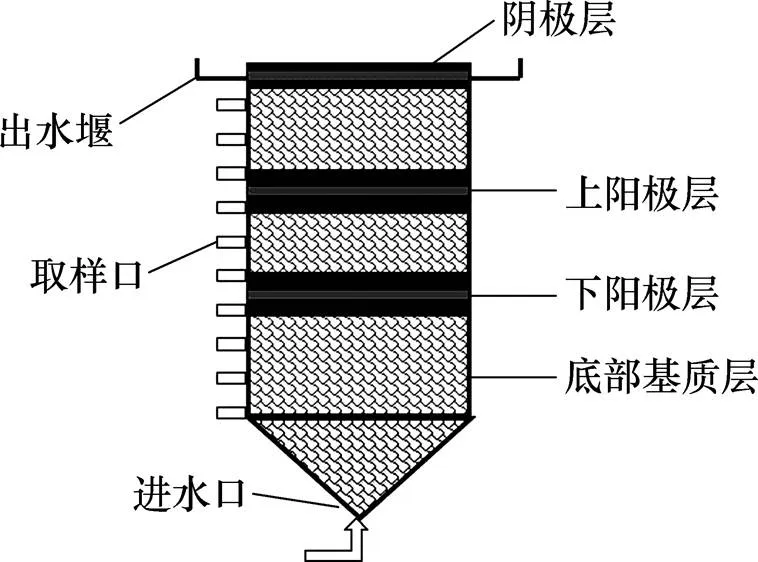
图1 双层阳极MFC装置结构示意图
1.2 系统接种与运行
接种污泥为南京市某污水处理厂二沉池回流污泥。系统接种后,先配置以葡萄糖为底物的人工模拟废水,连续进水培养。同时,连接数据自动采集模块,时刻记录系统的产电情况。经过一段时间的培养,系统能产生稳定持续的较高电压则视为系统启动成功。待系统稳定1月后,可根据试验内容,调整进水染料质量浓度和水力停留时间。所有试验均在(25±2) ℃室内温度下连续进行。
选取典型的偶氮染料——活性艳红X-3B作为目标污染物。本文X-3B购于上海汇邦精细化工有限公司。模拟废水成分如下:KCl,130.0 mg/L;NH4Cl,133.7 mg/L;MgSO4·7H2O,40.0 mg/L;NaH2PO4·2H2O,497.0 mg/L;Na2HPO4·12H2O,275.0 mg/L;NaHCO3,313.0 mg/L;C6H12O6·H2O,400.0 mg/L。微量元素的组分如下:ZnSO4·12H2O,2.0 mg/L;MnSO4·H2O, 2.2 mg/L;CoCl2·6H2O,0.24 mg/L;(NH4)6Mo7O24·4H2O,0.117 mg/L;CaCl2,15.0 mg/L;FeSO4·7H2O,1.0 mg/L。
1.3 试验设置
本文共采用4种不同结构的反应器进行试验,分别为阳极层间距为0 cm的双阳极MFC系统(即单阳极MFC系统)、阳极层间距为5 cm的双阳极MFC系统、阳极层间距为10 cm的双阳极MFC系统(分别记为S-0,S-5和S-10系统);另增加一个开路状态的单阳极MFC系统作为试验对照组,记作S-C系统。同时,将对照组MFC中的砂砾层和活性炭层统称为基质层。此外,试验控制阳极总体积相同。分别进行以下试验:1) 在水力停留时间(HRT)为2 d时,设置不同的X-3B质量浓度,通入上述MFC反应器,探究不同阳极间距的MFC对染料废水的处理性能及MFC系统的产电效果;2) 在一定的X-3B质量浓度下,设置不同的水力停留时间(HRT),探究不同反应器对染料废水的处理性能及系统的产电效果;3) 对上述试验装置的污染物沿程降解产物进行检测分析。所有的试验均设置3组平行样,取各组平均值作为试验结果。
1.4 分析与计算
活性艳红X-3B的质量浓度通过紫外分光光度计检测。脱色率计算公式如下:
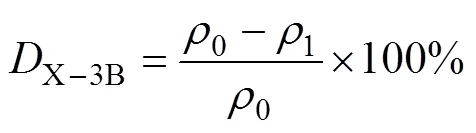
式中:X-3B为X-3B的脱色率,%;0为进水X-3B质量浓度,mg/L;1为出水X-3B质量浓度,mg/L。
COD采用重铬酸钾法测定,COD去除率计算公式如下:
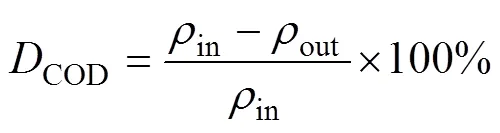
式中:COD为COD去除率,%;in为进水COD质量浓度,mg/L;out为出水COD质量浓度,mg/L。
电流和电压通过数字采集模块每1小时采集并记录1次。功率密度计算公式如下:
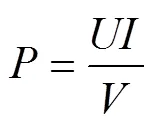
式中:为功率密度,W/m3;为电压,V;为电流,A;为阳极有效工作体积,m3。
X-3B的降解中间产物通过气相色谱−质谱联用仪(GC−MS)检测。GC−MS测试条件如下。
1) 气相色谱实验条件。选择DB5-MASS石英毛细管柱(高度×直径为25.00 m×0.32 mm),载气为高纯氦气,流量为39.5 cm/s;进样口温度设为280 ℃;传输线温度设为280 ℃;溶剂延迟时间设为4 min。升温程序如下:先设定柱温为60 ℃并保持0.5 min,然后以25 ℃/min的速度升温至235 ℃并保持2 min,再以2 ℃/min的速度升温至250 ℃保持5 min,最后以15 ℃/min的速度升温至280 ℃并保持5 min。进样量为1 μL,不分流进样。
2) 质谱实验条件。选择全扫描模式,质谱的电离方式为电子轰击电离(EI),电子能量为70 eV,离子源温度为280 ℃,电子倍增器电压为1 605 V,质荷比扫描范围为45~600。
2 结果与讨论
2.1 染料质量浓度对X-3B的去除及系统产电性能的影响
图2所示为不同MFC系统中染料脱色率随废水中X-3B质量浓度的变化。由于染料在阴极层、上部基质层和中部基质层的脱色率总和不足3%,故未在图中标出。从图2可见:对照组S-C系统中染料最高脱色率为60.2%,而MFC系统运行后,染料脱色率得到极大提高,说明MFC系统能促进偶氮染料废水的降解。当进水X-3B质量浓度从200 mg/L增大到 1 000 mg/L时,S-0系统中染料脱色率从90.53%下降到70.37%;S-5系统中染料脱色率从92.28%下降到81.32%;S-10系统中染料脱色率从95.50%下降到90.10%。与单阳极MFC系统相比,双层阳极结构的MFC系统中染料脱色率下降趋势缓慢,说明双层阳极结构对有机负荷的耐受能力更强。此外,当进水质量浓度从200 mg/L增到800 mg/L时,底部基质层的脱色能力几乎相同,X-3B的脱色率达到30%左右;当X-3B质量浓度进一步增大到1 000 mg/L时,底部基质层的脱色能力降到20%左右。这是因为底部基质层使用的填料一致,具有相同的比表面积和微生物附着能力[11],在中低染料质量浓度范围内形成相近的生物量,从而厌氧降解有机物的能力相差不大[13]。当进一步增加X-3B的质量浓度时,其生物毒性明显增强,抑制了微生物的生长及活性,导致X-3B脱色率的下降。
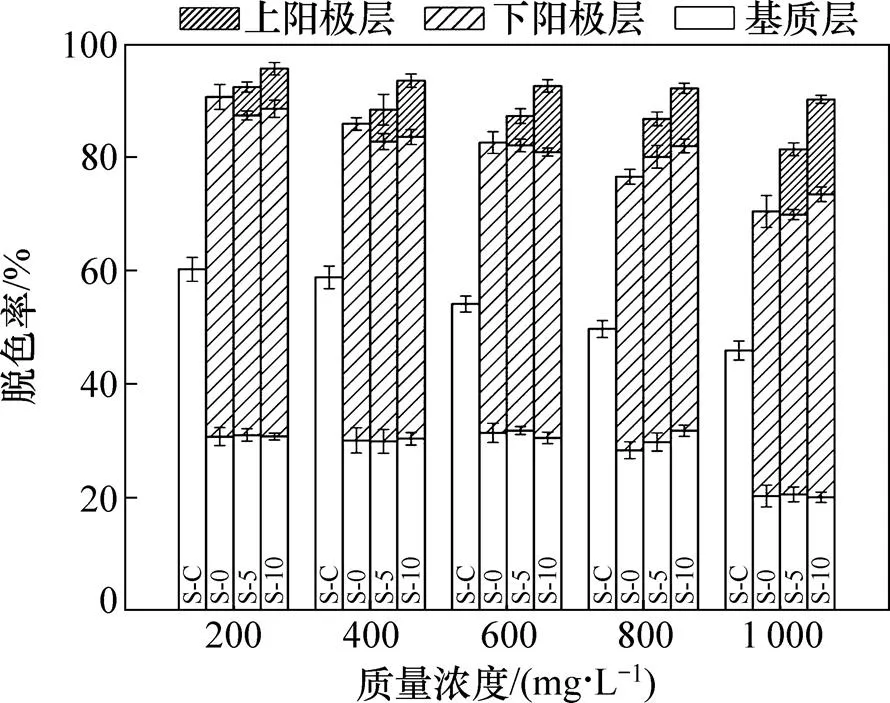
图2 不同MFC系统中染料脱色率随废水中X-3B质量浓度的变化
当进水X-3B质量浓度相同时,双阳极MFC系统脱色率比单阳极MFC系统的高。这是因为微生物利用共基质葡萄糖产生电子,一部分电子被产电菌传递给X-3B用于脱色[9],而2个阳极层的存在,加快了电子循环进程,在一定程度上实现了电子在阳极层中的重新分配,使X-3B能够接受更多的有效电子,故其脱色率增强。在一般情况下,MFC中阳极层在去除污染物方面起着关键作用[14],而本文试验结果表明设置2个阳极层能增强系统的整体处理性能。高质量浓度的染料废水从装置底部通入系统,沿程向上,废水先接触下阳极层再接触上阳极层。下阳极层的微生物受到抑制,生物量下降,X-3B脱色效率下降,而同时由于下阳极层的存在降低了进入上阳极层的废水质量浓度,减轻了上阳极层的负荷,上阳极层微生物活性受到的影响较小。此外,电极的存在也提高了产电菌的活性,加速了电子向X-3B传递[15],提高了上阳极层的脱色率。
图3所示为不同质量浓度X-3B废水中MFC系统电流随时间的变化。由图3可以看出:随着进水X-3B的质量浓度增大,系统输出电流均逐渐减小。X-3B质量浓度的增大意味着更多的电子被用于X-3B降解,集电体获得的电子数量则相对减少,电流降低[16]。此外,偶氮染料分子本身具有一定的生物毒性[17],X-3B质量浓度的增大会抑制微生物的生长及活性[3],而产电菌也不可避免地受到危害,这将会阻碍电子的产生、转移、分配和传递过程,从而导致电流降低。
在同一X-3B质量浓度范围内,单阳极MFC系统的产电量最低。单阳极MFC系统只包含1个集电体,电子传输到集电体的路径长,阻力大,导致集电体接收到的有效电子数目减少;而双阳极MFC系统中设置了2个集电体,有效产电空间增大[11],电子更容易传输到集电体上,产电性能得到提高。在双阳极MFC系统中,上阳极层的电流输出高于下阳极层中的电流输出。从系统中污染物分配的角度考虑,X-3B废水经过下阳极层之后减轻了上阳极层的有机物负荷,而上阳极层的微生物活性又相对较高,X-3B不需要过多的电子,剩余的电子被转移到集电体上,形成外电路。
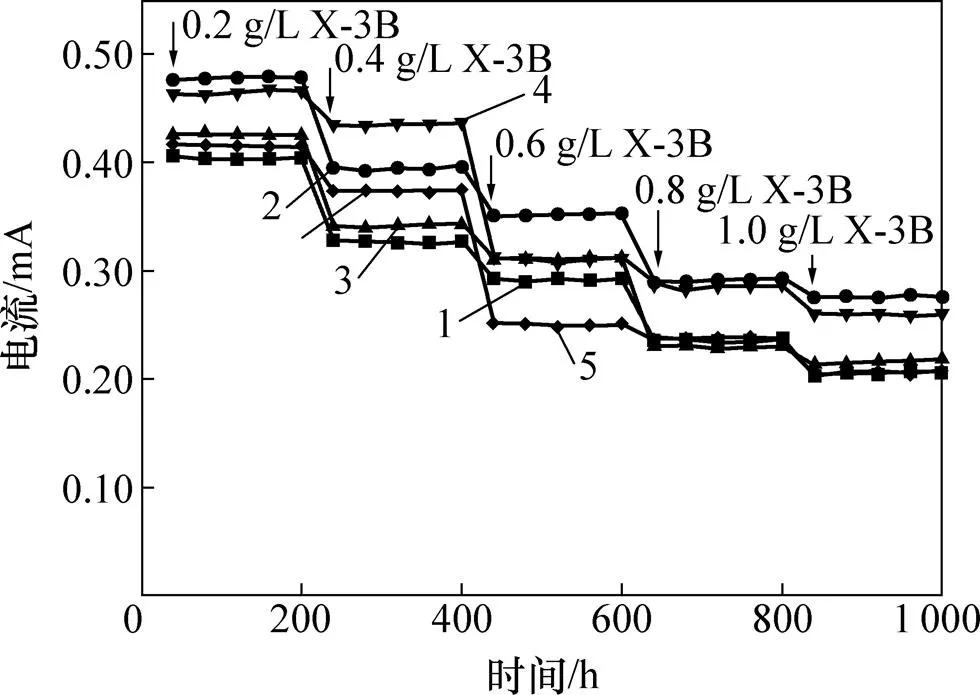
1—S-0系统;2—S-5系统上阳极;3—S-5系统下阳极;4—S-10系统上阳极;5—S-10系统下阳极。
2.2 HRT对X-3B的去除及系统产电性能的影响
当进水X-3B质量浓度为1 000 mg/L时,不同MFC系统中X-3B的脱色率随水力停留时间(HRT)的变化如图4(a)所示。将试验组和对照组对比可以发现:运行MFC系统后,X-3B的脱色率显著提高;对于单阳极MFC系统,当HRT减小时,X-3B的脱色率从75.02%下降到60.11%。这是因为HRT减小,水流速度加快,水体对生物膜的冲刷作用增强[11]。试验中观察到装置出水堰处有生物膜,因而推测生物量的减少直接导致X-3B脱色率降低。随着HRT减小,底物与微生物的有效接触时间缩短,底物降解不彻底,X-3B不能得到充足的电子。此外,高质量浓度的染料废水会抑制阳极产电菌的活性,使电子的产生转移等一系列过程受阻,从而使X-3B的脱色率降低。然而,双层阳极MFC系统在HRT减小时,X-3B的脱色率呈现先增加后降低的趋势。当HRT为1.5 d时,MFC系统X-3B脱色率达到最大,S-5系统的X-3B脱色率为85.60%,S-10系统的X-3B脱色率为96.34%。当HRT较高时,大部分污染物均被下层阳极去除,进入上层阳极的污染物质量浓度较低,上阳极去除率不高从而导致总去除率不高。在试验中,检测各个功能层的出水染料质量浓度。当进水X-3B质量浓度为1 000 mg/L,HRT为2 d时,S-10系统上阳极的进水染料质量浓度仅为276.1 mg/L。陈胜等[18]指出,在一定范围内提高进水质量浓度,有助于增强厌氧反应器的处理能力。因而推测:随着HRT的缩短,下阳极负荷增加导致进入上阳极的污染物质量浓度在一定范围内提高,使得上阳极去除率提高;若进一步缩短HRT,则生物量的大量流失将不可避免地导致X-3B脱色率下降。
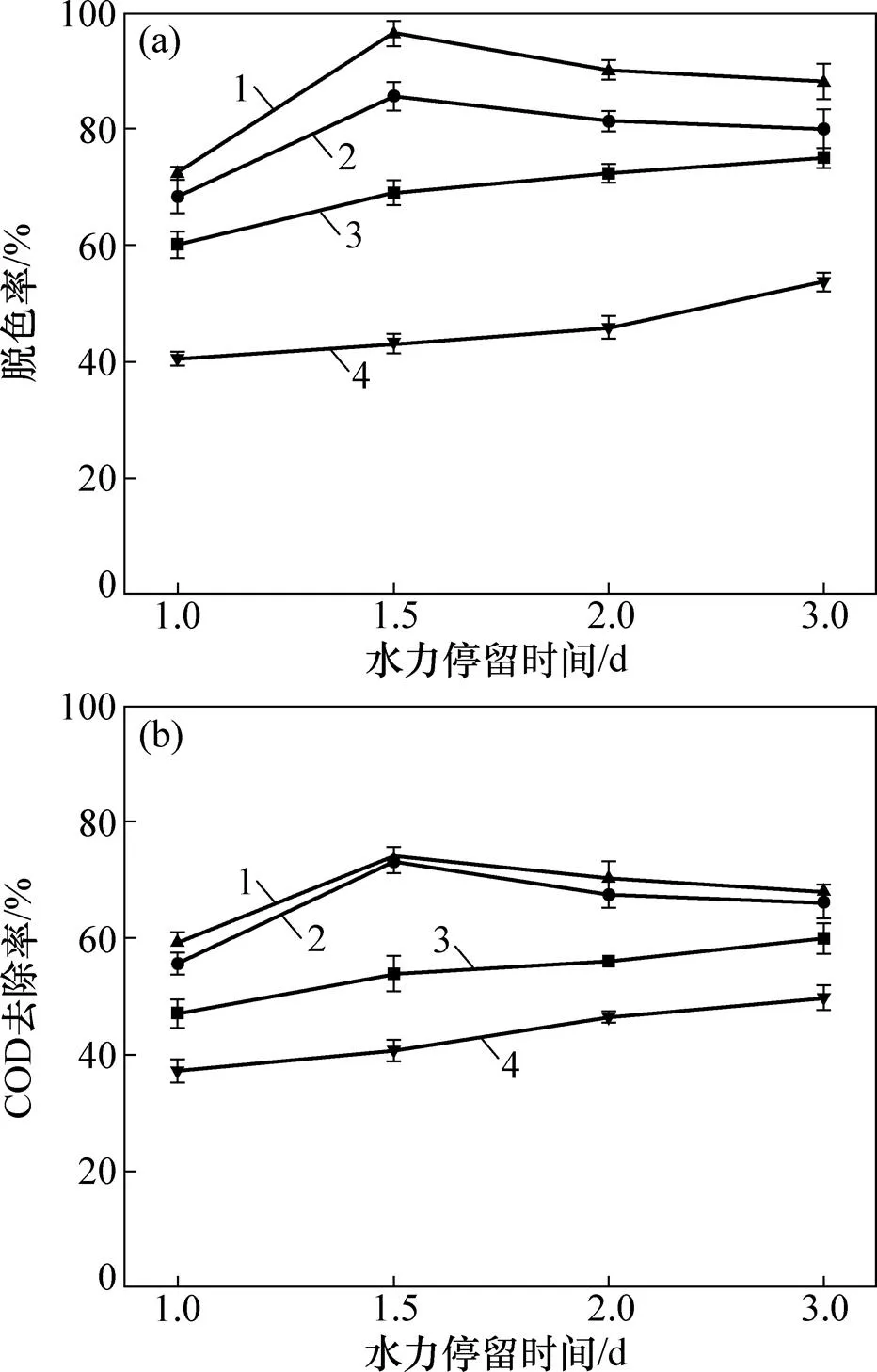
(a) X-3B脱色率;(b) COD去除率
在相同水力停留时间下,各系统对X-3B总的脱色率从高到低依次为S-10系统、S-5系统和S-0系统。双阳极结构具有较强的抗冲击负荷能力,在X-3B的脱色方面保持良好的稳定性。
图4(b)所示为不同MFC系统的COD去除率随时间的变化。由图4(b)可知:当HRT从3 d减小到1 d时,S-0系统COD去除率从60.07%下降到47.16%;当HRT为1.5 d时,双阳极MFC系统的COD去除率达到最大;S-5系统COD去除率为73.33%,S-10系统COD去除率为74.16%;上、下阳极层同时接入电路,电化学催化作用的有效反应空间增大,有利于微生物降解有机物,使得双阳极MFC系统有着更高的COD去除率。
结合以上分析可知:当进水X-3B质量浓度为 1 000 mg/L,HRT为1.5 d时,MFC系统对污染物的处理效果最好。相同的底部基质层设计使得装置底部污染物去除能力相差无异。而适当增大2个阳极层的间距,上阳极层将会降解更多的X-3B。在COD的去除方面,S-10系统并没有表现出明显的优势。这是由于试验利用重铬酸钾法检测COD,而重铬酸钾并不能完全氧化X-3B分子中苯环、萘环等复杂结构,故COD测定值往往偏低[11],X-3B被厌氧微生物降解后会产生大量的中间产物,这些中间产物能被重铬酸钾氧化而表现出更高的COD值[16],在一定程度上,使得COD的去除率有所下降。
图5所示为在HRT为1.5 d,进水X-3B质量浓度为1 000 mg/L条件下测得的MFC系统的极化曲线和功率密度曲线。由图5可知:S-0系统,S-5系统上、下阳极以及S-10系统上、下阳极的最大功率密度分别是0.180,0.159,0.134,0.150和0.121 W/m3。通过极化曲线欧姆极化区的线性拟合得出S-0系统、S-5系统和S-10系统的内阻分别为651.1,839.2和1053.1 Ω。
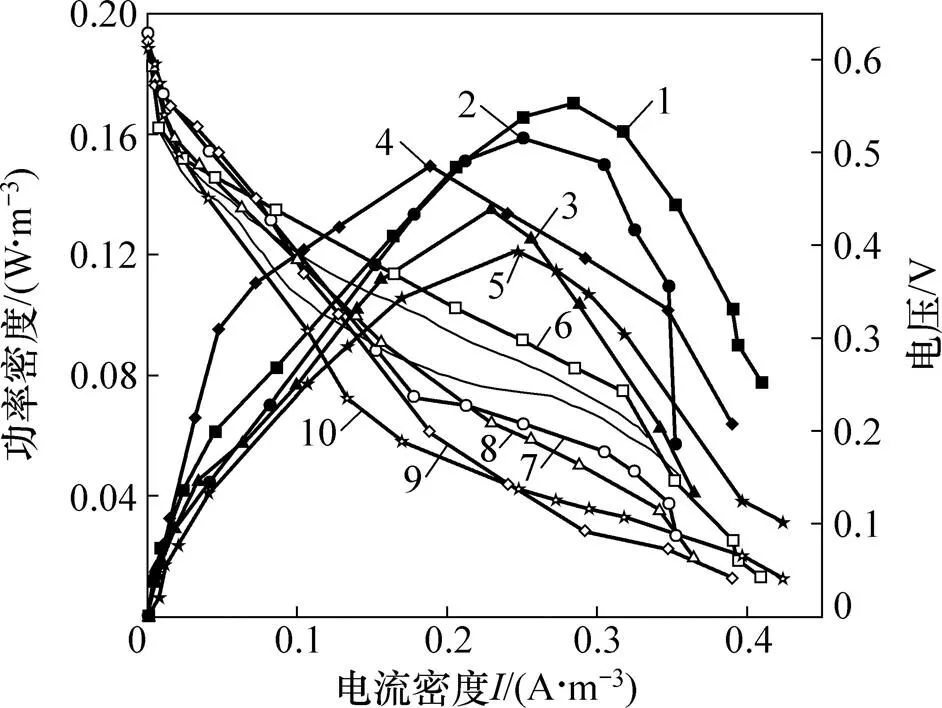
1—S-0功率密度;2—S-5上阳极功率密度; 3—S-5下阳极功率密度;4—S-10上阳极功率密度; 5—S-10下阳极功率密度;6—S-0极化曲线; 7—S-5上阳极极化曲线;8—S-5下阳极极化曲线;9—S-10上阳极极化曲线;10—S-10下阳极极化曲线。
对比单阳极和双层阳极系统可以发现:双层阳极结构对有机负荷的耐受能力更强,在相同的X-3B质量浓度下,双阳极MFC系统脱色率明显高于单阳极MFC系统脱色率并且双阳极MFC系统在处理高质量浓度的染料废水时仍能得到较好的处理效果。双层阳极MFC的2个阳极功率输出与单阳极MFC功率输出无较大差异,而双层阳极MFC可从上、下2个阳极层回收电子,从电子回收的角度考虑,双层阳极构造强于单阳极构造。
2.3 X-3B中间产物的分析
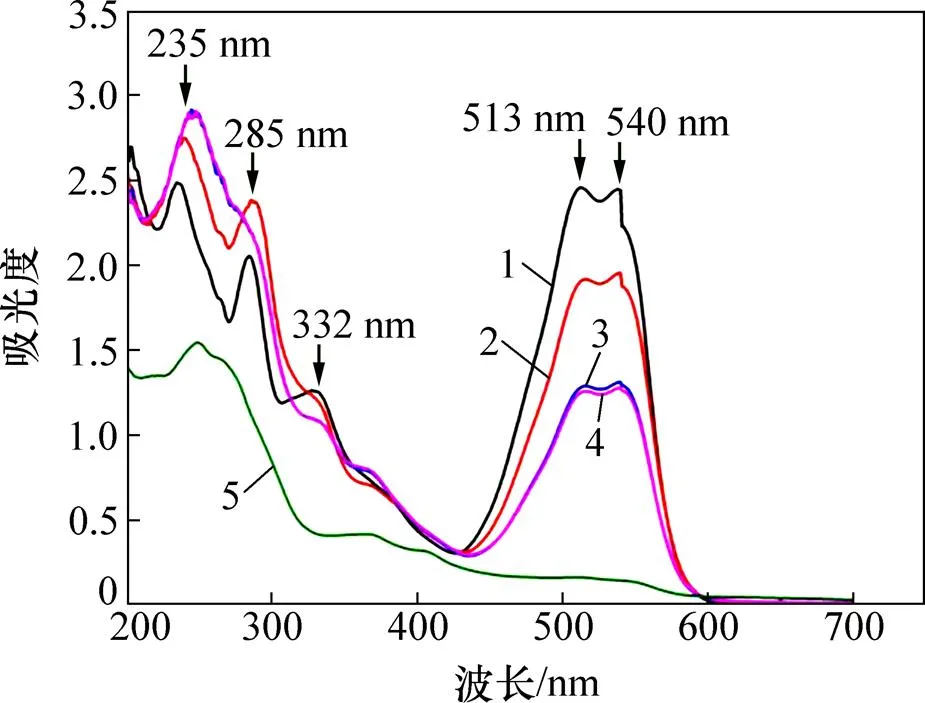
试验从处理能力最优的S-10系统中取样,选取代表性水样(系统进水、下阳极进水、下阳极出水、上阳极进水、阴极出水)进行UV-Vis光谱扫描,其结果如图6所示。
由图6可以看出:在紫外可见光区,X-3B主要存在5个吸收峰,分别位于235,285,332,513和 540 nm处。其中,235 nm处的峰是苯环的特征吸收峰,285 nm处的峰是三嗪结构的特征吸收峰,335 nm处的峰是萘环的特征吸收峰,513~540 nm所形成的宽吸收峰则是由共轭体系n-π结构引起的,X-3B中的偶氮键(—N=N—)与苯环和萘环相连构成共轭体系结构,吸收可见光线,使X-3B呈红色[19]。
1—系统进水;2—下阳极进水;3—下阳极出水;4—上阳极进水;6—阴极层出水。
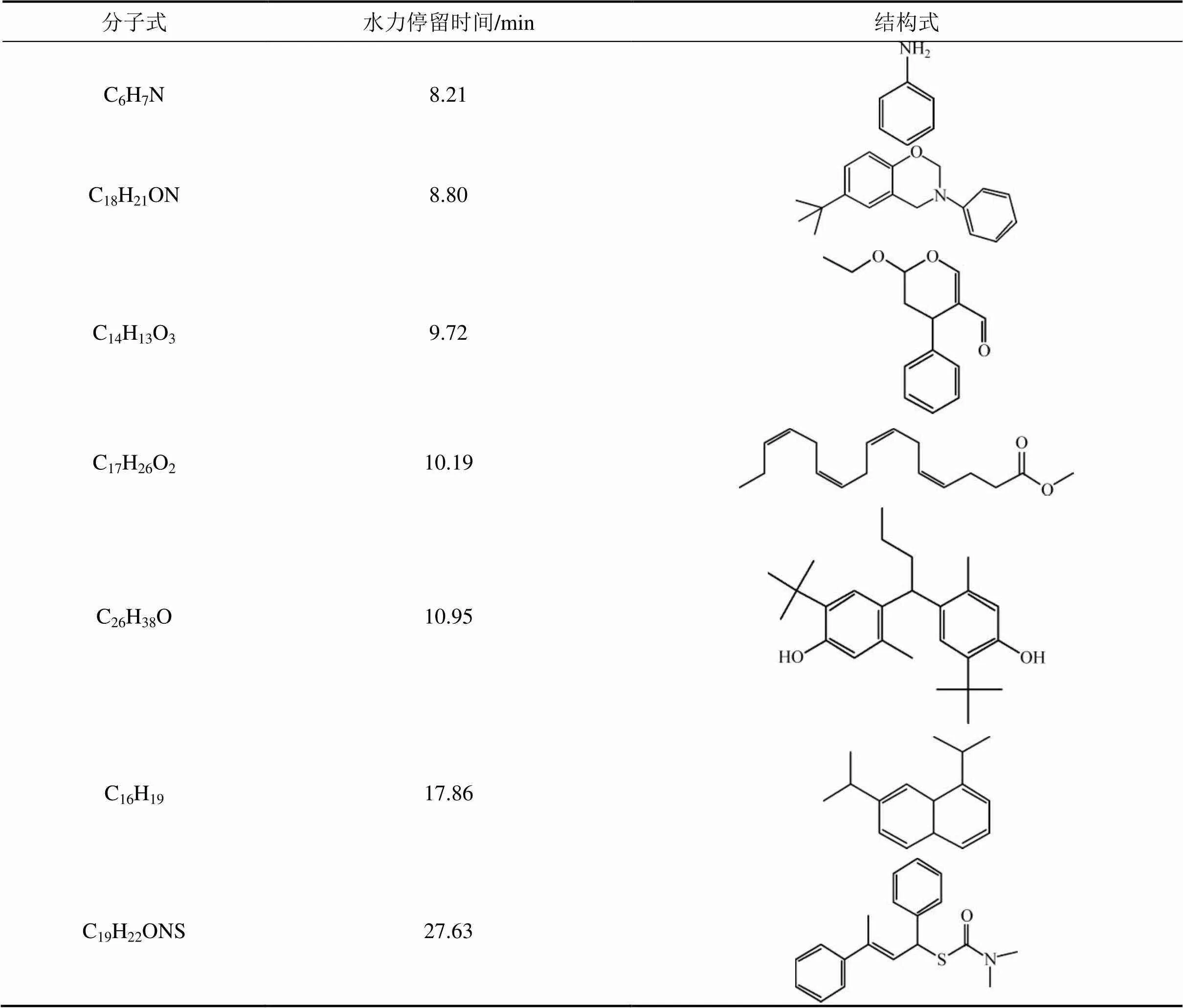
表1 X-3B降解的可能中间产物
由图6中不同位置出水处水样的扫描图谱可以发现:经过基质层微生物的厌氧降解,X-3B中的共轭体系n-π结构被大量破坏,这一现象符合基质层的脱色情况;而苯环、三嗪结构的吸收峰有所增大,这是染料分子降解产生的中间产物造成的影响。随着X-3B废水继续向上流动,流出下层阳极后,X-3B中的共轭体系n-π结构被进一步破坏,此时,苯环的吸收峰增大,而三嗪结构的吸收峰却基本上消失。这说明三嗪结构在下阳极层就开始被降解去除。对比下阳极出水和上阳极进水扫描图谱可以发现,中间基质层几乎不能降解X-3B。上层阳极在去除X-3B过程中也起到了一定的作用,最终的阴极层出水图谱说明双阳极MFC系统对染料X-3B废水的去除具有良好的效果。通过对比发现,苯环结构主要在阴极被破坏,中间产物发生了进一步降解。偶氮染料的生物降解主要是通过偶氮还原酶使其发生还原裂解[20],染料分子中的氮氮双键被打破,萘环、苯环和三嗪基团也被降解而发生开环反应,染料大分子被分解为小分子有机物,最终实现脱色的目的。
试验采用气相色谱−质谱联用(GC−MS)对S-10系统不同位置的出水进行检测,X-3B降解的可能中间产物如表1所示。由表1可知:X-3B降解的可能中间产物主要是苯胺、醛类、醇类、芳香烃等有机物。一般来说,偶氮分子中的氮氮双键打破后会形成2种芳香化合物,即苯胺和含三嗪结构的氨基萘甲基化合 物[21]。本文仅仅检测到苯胺,而未检测到第2种芳香化合物。这是因为含三嗪结构的氨基萘甲基化合物会被快速降解为其他中间产物[22]。此前,有研究[23]表明:苯胺会被降解为苯酚,而苯酚很容易开环形成低相对分子质量产物;三嗪和萘环结构则会转化为醛类、酮类、简单的芳香化合物以及碳氢化合物。最后,这些烃类化合物在阳极被矿化为CO2和H2O[24]。
3 结论
1) 微生物燃料电池(MFC)系统对X-3B染料的降解具有良好的效果。当通入200~600 mg/L的X-3B时,单阳极和双阳极MFC系统在污染物的去除方面并无较大差异,X-3B最大脱色率之差不超过10%;当通入800~1 000 mg/L的X-3B时,双阳极MFC系统对有机负荷耐受能力更强。在相同的X-3B质量浓度下,单阳极MFC系统脱色率低于双阳极MFC系统脱色率并且单阳极MFC系统的产电性能也较低。
2) 水力停留时间(HRT)会对MFC系统的染料脱色和产电性能造成一定的影响;随着HRT减小,单阳极MFC系统的X-3B染料脱色率下降,而双阳极MFC系统的X-3B染料脱色率呈现先增大后降低的趋势;S-10系统在HRT为1.5 d时脱色率达到最大,为96.34%;COD去除率的变化规律与脱色率的变化规律一致,COD去除率最高为74.16%;适当增大2个阳极层的间距,污染物去除率会有所提高;当双层阳极间距设为10 cm时,MFC系统的污染物去除性能最佳。同时,双层阳极MFC系统具备2个阳极层,外电路上可以回收更多的电子。
3) 通过GC−MS分析得出苯胺是一种X-3B降解中间产物。
[1] CAI Yingjie, LIN Lina, XIA Dongsheng, et al. Degradation of reactive brilliant red X-3B dye by microwave electrodeless UV irradiation[J]. Acta Hydrochimica et Hydrobiologica, 2011, 39(1): 68−73.
[2] XU Fangcheng, MOU Zhiyi, GENG Jiya, et al. Azo dye decolorization by a halotolerant exoelectrogenic decolorizer isolated from marine sediment[J]. Chemosphere, 2016, 158: 30−36.
[3] SU Lin, FAN Xianpeng, YIN Tao, et al. Increasing power density and dye decolorization of X-3B-fed microbial fuel cell via prior TiO2photocatalysis[J]. RSC Advances, 2015, 5(102): 83906−83913.
[4] 严滨. 偶氮染料的微生物脱色[M]. 北京: 化学工业出版社, 2013: 10−13. YAN Bin. Decolorization of azo dyes by microorganisms[M]. Beijing: Chemical Industry Press, 2013: 10−13.
[5] 钱丹丹. 微生物燃料电池的研究综述[J]. 能源环境保护, 2014, 28(3): 4−7. QIAN Dandan. A review of microbial fuel cell[J]. Energy Environmental Protection, 2014, 28(3): 4−7.
[6] ZHU Feng, WANG Wancheng, ZHANG Xiaoyan, et al. Electricity generation in a membrane-less microbial fuel cell with down-flow feeding onto the cathode[J]. Bioresource Technology, 2011, 102(15): 7324.
[7] MOHAN S V, RAGHAVULU S V, PERI D, et al. Integrated function of microbial fuel cell (MFC) as bio-electrochemical treatment system associated with bioelectricity generation under higher substrate load[J]. Biosensors & Bioelectronics, 2009, 24(7): 2021−2027.
[8] YADAV A K, DASH P, MOHANTY A, et al. Performance assessment of innovative constructed wetland-microbial fuel cell for electricity production and dye removal[J]. Ecological Engineering, 2012, 47(5): 126−131.
[9] FANG Zhou, SONG Hailiang, CANG Ning, et al. Electricity production from azo dye wastewater using a microbial fuel cell coupled constructed wetland operating under different operating conditions[J]. Biosensors & Bioelectronics, 2015, 68: 135−141.
[10] 李薛晓, 程思超, 方舟, 等. 湿地基质及阴极面积对人工湿地型微生物燃料电池去除偶氮染料同步产电的影响[J]. 环境科学, 2017, 38(5): 1904−1910. LI Xuexiao, CHEN Sichao, FANG Zhou, et al. Effects of microbial fuel cell coupled constructed wetland with different support matrix and cathode ares on the degradation of azo dye and electricity production[J]. Environment Science, 2017, 38(5): 1904−1910.
[11] 李薛晓. CW-MFC对难降解有机物的去除特性及同步产电研究[D]. 南京: 东南大学能源与环境学院, 2017: 28−39. LI Xuexiao. Research on CW-MFC for bio-refractory organics removal and electricity production[D]. Nanjing: Southeast University. School of Energy and Environment, 2017: 28−39.
[12] SRIVASTAVA P, YADAV A K, MISHRA B K. The effects of microbial fuel cell integration into constructed wetland on the performance of constructed wetland[J]. Bioresource Technology, 2015, 195: 223−230.
[13] 熊昌龙. 人工湿地填料基质对污水厂尾水深度处理研究——以锦江芦溪河人工湿地试验基质为例[D]. 四川:成都理工大学地质灾害与地质环境研究院, 2014: 45−48. XIONG Changlong. A study on the advanced treatment of constructed wetlands’ filler substrate in tail water from sewage plant—taking experimental substrate of an artificial wetland in Jinjiang Luxi River as an example[D]. Sichuan: Chengdu University of Technology. Geohazard Prevention and Geoenvironment Protection Research Institute, 2014: 45−48.
[14] 伍峰. 微生物燃料电池发展现状与应用前景[J]. 广州环境科学, 2010, 25(2): 38−41. WU Feng. Current status and prospects in research on microbial fuel cells[J]. Guangzhou Environmental Sciences, 2010, 25(2): 38−41.
[15] 程思超, 方舟, 李薛晓, 等. 共基质对人工湿地型微生物电池脱色染料并产电的影响[J]. 水处理技术, 2016, 42(10): 44−48. CHEN Sichao, FANG Zhou, LI Xuexiao, et al. Effects of co-substrates on simultaneous decolorization of azo dye and bioelectricity generation in microbial fuel cell coupled constructed wetland[J]. Technology of Water Treatment, 2016, 42(10): 44−48.
[16] SUN Jian, HU Yongyou, BI Zhe, et al. Simultaneous decolorization of azo dye and bioelectricity generation using a microfiltration membrane air-cathode single-chamber microbial fuel cell[J]. Bioresource Technology, 2009, 100(13): 3185−3192.
[17] THUNG W E, ONG S A, HO L N, et al. A highly efficient single chambered up-flow membrane-less microbial fuel cell for treatment of azo dye acid orange 7-containing wastewater[J]. Bioresource Technology, 2015, 197: 284−288.
[18] 陈胜, 孙德智, 陈桂霞, 等. 厌氧-好氧移动床生物膜反应器串联处理垃圾渗滤液[J]. 环境科学, 2006, 27(10): 2076−2080. CHEN Sheng, SUN Dezhi, CHEN Guixia, et al. Treatment of landfill leachate using sequential anaerobic/aerobic moving-bed biofilm reactor[J]. Environment Science, 2006, 27(10): 2076−2080.
[19] CAO Xian, WANG Hui, LI Xiaoqi, et al. Enhanced degradation of azo dye by a stacked microbial fuel cell-biofilm electrode reactor coupled system[J]. Bioresource Technology, 2017, 227: 273−278.
[20] STOLZ A. Basic and applied aspects in the microbial degradation of azo dyes[J]. Applied Microbiology & Biotechnology, 2001, 56(1/2): 69−80.
[21] CAO Zhanping, ZHANG Jinghui, ZHANG Jingli, et al. Degradation pathway and mechanism of reactive brilliant red X-3B in electro-assisted microbial system under anaerobic condition[J]. Journal of Hazardous Materials, 2017, 329: 159−165.
[22] MOREIRA F C, BOAVENTURA R A, BRILLAS E, et al. Remediation of a winery wastewater combining aerobic biological oxidation and electrochemical advanced oxidation processes[J]. Water Research, 2015, 75: 95−108.
[23] DOS SANTOS A B, CERVANTES F J, VAN LIER J B. Review paper on current technologies for decolourisation of textile wastewaters: perspectives for anaerobic biotechnology[J]. Bioresource Technology, 2007, 98(12): 2369−2385.
[24] SREELATHA S, VELVIZHI G, KUMAR A N, et al. Functional behavior of bio-electrochemical treatment system with increasing azo dye concentrations: Synergistic interactions of biocatalyst and electrode assembly[J]. Bioresource Technology, 2016, 213: 11−20.
Degradation of azo dye and electricity production by dual-anode microbial fuel cell system
WANG Lian, CAO Xian, FENG Yuzhong, ZHANG Yi, LI Xianning
(School of Energy and Environment, Southeast University, Nanjing 210096, China)
A novel single-chamber dual-anode microbial fuel cell (MFC) system was constructed for the treatment of refractory organic dye-production wastewater. The effects of dye mass concentration, hydraulic retention time (HRT) and anode spacing on the removal efficiency of refractory organic matters and bio-electricity production were investigated. UV-Vis spectral scanning and gas chromatography-mass spectrometry (GC-MS) were used to analyze the degration products. The result show that when the MFC system is fed with X-3B of 200−600 mg/L, the single-anode MFC and dual-anode MFC have no significant differences in removal efficiencies of organic matters, and the difference between the maximum decolorization rate of two MFC systems does not exceed 10%. When MFC system is fed with 800−1 000 mg/L X-3B, the dual-anode MFC exhibits good decolorization effect and strong organic load capacity. When the anode spacing is 10 cm, dual-anode MFC system (namely S-10 system) presents the best processing performances. With 1 000 g/L X-3B and HRT of 1.5 d, S-10 system exhibits highest decolorization efficiency of 96.34% and the highest chemical oxygen demand (COD) removal efficiency of 74.16%. The internal resistance of S-10 system is 1 053.1 Ω, and the maxmium power densities of the upper and lower anodes are 0.150 and 0.121 W/m3, respectively. It is found that aniline is a typical X-3B degradation intermediate product.
microbial fuel cell; azo dye; bio-electricity production; decolorization and degradation
10.11817/j.issn.1672−7207.2019.02.003
X703.1
A
1672−7207(2019)02−0264−08
2018−03−21;
2018−05−21
江苏省自然科学基金资助项目(BK20171351,BK20141330);国家自然科学基金资助项目(21277024)(Projects (BK20171351, BK20141330) supported by the Natural Science Foundation of Jiangsu Province; Project(21277024) supported by the National Natural Science Foundation of China)
李先宁,教授,博士生导师,从事水污染控制研究;E-mail:lxnseu@163.com
(编辑 伍锦花)

