亚临床甲状腺功能减退症对经皮冠状动脉介入治疗患者临床结局的影响
吴九涛,刘凯,谭传辉,王敏,曾英,陈颖豪
普通人群亚临床甲状腺功能减退症(SCH)患病率为4%~20%[1],SCH表现为血清促甲状腺激素(TSH)水平轻度升高,但几乎没有临床症状或体征[2]。虽然血清游离甲状腺素(FT4)水平通常在参考范围内,但有研究报道SCH患者的心血管疾病风险和死亡率增加[3]。研究显示,亚临床动脉粥样硬化疾病如冠状动脉钙化,颈动脉内膜中层增厚和动脉粥样硬化,在SCH中发病率较高[4]。而血管内皮功能障碍,胆固醇代谢受损和血清C-反应蛋白(CRP)水平升高与SCH相关[5]。然而,SCH是否与接受经皮冠状动脉介入治疗(PCI)患者的心血管事件和死亡相关尚不确定。本研究采用前瞻性临床队列研究探讨SCH对PCI术后临床转归的影响。
1 资料与方法
研究对象:连续入组2012年1月至2017年12月在定安县人民医院诊断并在海南省人民医院心导管室行冠状动脉造影检查并接受PCI治疗的936例冠心病患者。排除标准:曾接受过冠状动脉旁路移植术,晚期恶性肿瘤,晚期肝硬化,严重自身免疫性疾病和伴有严重后遗症的脑血管意外。
临床资料收集:基本临床资料包括既往病史、体重、身高、体重指数(BMI),以及PCI前后实验室检查结果。使用肾脏病饮食改良方法计算估算肾小球滤过率(eGFR),慢性肾脏病定义为eGFR≤60 ml/(min·1.73 m2)。所有患者均在术前口服 300 mg阿司匹林和600 mg氯吡格雷或180 mg替格瑞洛。PCI术后,除非有禁忌证,所有患者均接受双联抗血小板药物治疗(至少1年)和他汀类药物治疗,并在术后3~12个月行血脂检测。超声心动图在PCI术前或术后3个月内进行,测量左心室射血分数(LVEF),左心室质量指数(LVMI)和二尖瓣舒张早期血流峰值与二尖瓣环运动速度之比(E/E')。
PCI及临床随访:受试者统一在海南省人民医院心导管室行冠状动脉造影和PCI,将每个狭窄病变的直径与位于病变近端和远端的正常血管段的腔直径进行比较,根据血管造影结果进行定量测量,需要PCI的狭窄病变定义为管腔狭窄≥70%。观察期间如果出现心绞痛症状或心肌缺血征象时需要复查冠状动脉造影。在出院后1、6、12、24个月通过电话随访和门诊检查来评估临床结果,随访终点为出现非致命性心肌梗死、再次血运重建、心原性死亡,以及包括以上终点任意组合的复合心血管事件。心原性死亡包括典型胸痛死亡和猝死;非致死性心肌梗死定义为典型的胸痛伴心电图改变,血肌钙蛋白T或I水平升高超过正常上限3倍以上;再次血运重建指对于支架内再狭窄或者非罪犯冠状动脉狭窄病变外的PCI治疗。
甲状腺功能检查和SCH的诊断:在PCI前检测血清TSH和FT4水平。甲状腺功能正常(ET)定义为 TSH 水平(0.4~4.4 mIU/L)和 FT4水平(0.7~1.8 ng/dl)均在指定的正常范围内[6]。SCH定义为TSH水平升高(≥4.5 mIU/L)和正常的FT4水平,无甲状腺功能减退的症状或体征[1]。排除TSH水平下降(<0.4 mIU/L)或FT4水平异常的患者、明确诊断为甲状腺功能减退症或亢进症的患者以及正在服用抗甲状腺药物或甲状腺激素替代治疗的患者。
受试者分组:根据TSH水平,将受试者分为甲状腺功能正常组(ET组,n=836)和亚临床甲状腺功能减退组(SCH组,n=100);SCH组又分为两个亚组SCH组1(TSH水平轻度升高4.5~6.9 mIU/L)和SCH组2(TSH水平中等升高≥7.0 mIU/L),再比较各组间临床结局差异。
统计学分析:使用统计学软件SPSS 24.0进行统计分析。正态分布的计量资料以均数±标准差表示,组间比较采用独立样本t检验。计数资料以百分比或率表示,两组差异比较采用卡方检验。非正态分布计量资料以中位数(P25,P75)表示,组间比较采用Mann-Whitney U检验。使用Kaplan-Mayer生存分析和Log-Rank检验来比较两组间的无事件生存率。对所有相关的协变量进行多因素Cox回归分析以评估SCH与不良临床结局之间的独立相关性。P<0.05为差异有统计学意义。
2 结果
两组患者基本临床特点及血管造影结果比较(表1):936例冠心病患者中位TSH水平为1.95 mIU/L,平均FT4水平为(1.15±0.19)pmol/L。确诊SCH患者100例(10.7%)。与ET组相比,SCH组中ST段抬高型心肌梗死(STEMI)比例较高(6.9% vs 14.0%,P=0.012),LVEF略低[(68.6±9.5)% vs (65.5±11.7)%,P=0.053],LVEF≤50%比例较高(5.6% vs 13.0%,P=0.004),B型利钠肽(BNP)水平较高(P=0.011),血红蛋白水平较低(P=0.032)。LVMI和E/E’在两组间无差异(P均>0.05)。

表1 两组患者基本临床特点及血管造影结果比较
随访结果(表 2):中位随访 321 d(170~473 d),ET组中位随访319 d(170~472 d),SCH组中位随访323 d(204~473 d)。随访期间,SCH组心原性死亡(3.0% vs 1.2%,P=0.006),支架内再狭窄需要再次PCI治疗(18.0% vs 11.7%,P=0.009)和复合心血管事件(23.0% vs 20.6%,P=0.002)的发生率均高于ET组。SCH组非致死性心肌梗死(4.0%vs 3.1%,P=0.108)及原罪犯血管外的新发狭窄病变而需要再次PCI治疗的发生率均高于ET组(7.0%vs 5.6%,P=0.694),但差异均无统计学意义。与整体队列基线时的脂质谱相比,LDL-C(-27.9 mg/dl,P<0.001)和甘油三酯水平(-9 mg/dl,P<0.001)降低,HDL-C水平(+1.2 mg/dl,P=0.006)升高,但两组间脂质谱变化无差异。随访期间ET组平均生存概高于SCH1组但差异无统计学意义(83.2%vs 76.4%,P=0.370),同时明显高于SCH2组(83.2%vs 64.2%,P<0.001);而SCH1组和SCH2组比较,平均生存概相似(76.4%% vs 64.2%,P=0.060)。
不同血清TSH水平组别复合心血管事件预测因子的多因素Cox回归分析(表3):模型1分析显示,TSH ≥4.5 mIU/L与糖尿病、总支架长度(TSL)、既往PCI史、BMI降低及第一代DES是复合心血管事件的预测因子;亚组分析(模型2)显示,TSH≥7.0 mIU/L是复合事件的预测因子,而TSH 4.5~6.9 mIU/L不再与复合事件的风险相关。
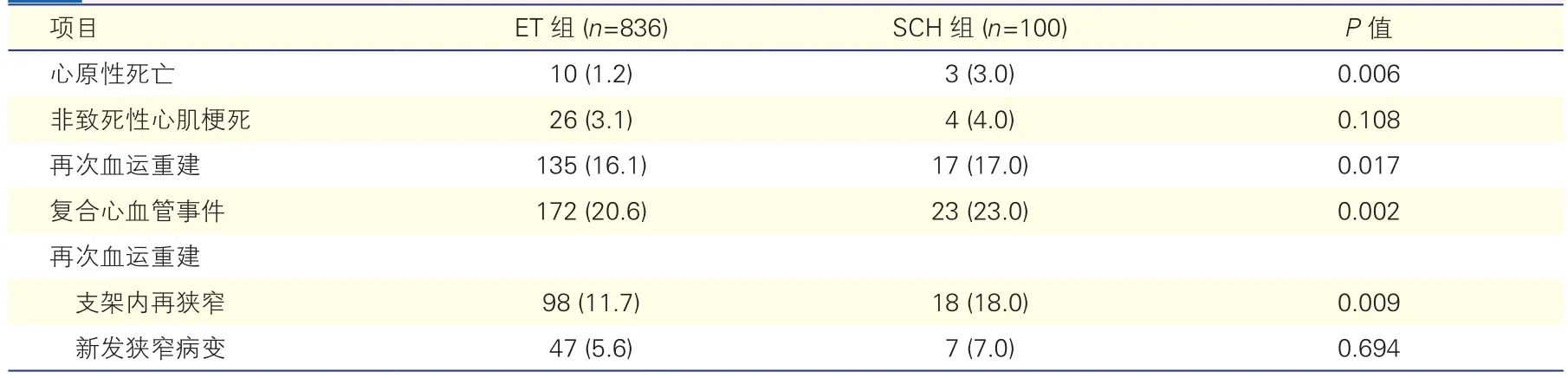
表2 ET组和SCH组随访结果比较 [例(%)]

表3 复合事件预测因子的多因素Cox回归分析
3 讨论
本研究显示,SCH与PCI后再次血运重建、心脏死亡和复合心血管事件风险较高相关。而且随着血清TSH水平的升高,复合心血管事件风险增加。SCH对不良临床结局风险的负面影响在单支病变患者、较长TSL(≥38 mm)、既往PCI、血清LDL-C水平降低和高敏C反应蛋白(hs-CRP)水平升高的患者中更为明显。SCH与支架内再狭窄患者再次PCI的风险相关,但不适用于新发冠状动脉病变。本研究结果与Parent等[7]研究结果一致,该研究报道基于血清TSH水平定义的甲状腺功能减退症和SCH与PCI后主要心血管事件风险增加相关。
有研究显示,SCH可增加亚临床动脉粥样硬化的风险,类似于甲状腺功能减退症[8]。但SCH对脂质代谢的影响一直存在争议。在本研究中,ET组和SCH组在基线或随访期间的脂质谱变化无显著差异。但最近一项分析表明SCH与总胆固醇、低密度脂蛋白胆固醇(LDL -C)、甘油三酯水平增加有关[9]。Khan等[10]发现,血清脂蛋白(a)水平在SCH患者中明显增加。与甲状腺功能减退症类似,SCH与全身性炎症和内皮功能障碍有关[11],导致SCH患者冠状动脉痉挛发生率更高[12]。而Nath等[13]研究发现,接受PCI的患者中多支血管病变在ET患者中比在甲状腺功能减退症中发生率更高。
本研究提示,SCH组非致死性MI的发生率高于ET组,可能是SCH组BNP水平升高、左心室收缩功能障碍发生率高的原因。Tuliani等[14]研究发现,STEMI患者PCI后的临床结果通常比稳定性心绞痛患者更差。但本研究发现,支架平均直径和TSL在SCH和ET组间无差异,多因素Cox回归分析结果还表明,SCH与复合心血管事件风险之间的关联与STEMI无明显关联。
就支架内再狭窄和新发狭窄病变而言,我们发现SCH组发生率均高于ET组。Pandrc等[15]研究发现,SCH是支架内再狭窄发生的危险因素,可能与SCH导致冠状动脉内皮受损、痉挛,炎性细胞聚集引起的过度内皮增殖有关;此外可能是SCH通过抑制脂蛋白酯酶活性,使之血清胆固醇清除能力下降,促进支架前后端动脉粥样硬化的发生。支架内再狭窄的再次PCI率较低,可能与本研究中患者的临床特点和血管造影特征有关,以及糖尿病和慢性肾脏病的发生率较低,TSL较短,平均支架直径较之其他研究[16-17]较小。总之,SCH患者PCI后预后较差,TSH≥7.0 mIU/L时心血管复合事件风险会明显增加,PCI后的患者应定期评估甲状腺功能,密切观察不良心血管事件的发生情况。

