带锈青铜文物材料在环境模拟介质中的电化学腐蚀行为
, , ,, , ,
(1. 华东理工大学,上海 200237; 2. 上海博物馆,上海 200050)
我国历史源远流长,文物种类繁多。其中,青铜文物以其精美的铭文图案和独特的造型闻名于世,是我国重要的历史文化遗产。考古出土的青铜文物是历史信息的重要载体,因此,对青铜文物的保护具有十分重要的历史意义。青铜文物出土后的保存环境复杂多样,大气中的氧气(CO2)、二氧化碳(CO2)、污染物(如SO2和NOx)、湿度、温度以及海洋大气环境中的氯化钠(NaCl)等盐类都是引起青铜腐蚀的因素。空气中的Cl-和SO2均会与金属反应,在青铜文物表面产生有害锈,加快青铜文物的粉化溃烂[1],并且Cl-和SO2含量越高,金属腐蚀越严重[2-3],且它们对金属的腐蚀有协同作用[4-5]。
青铜文物表面一般都附着了大量的腐蚀产物,可分为有害锈和无害锈。无害锈质地比较坚硬,可以保护青铜不再遭受进一步的腐蚀,主要成分是氧化亚铜(Cu2O)。有害锈会使青铜文物粉化,缩短其寿命,主要成分是氯化亚铜(CuCl)和碱式氯化铜[Cu2(OH)3Cl]等[6]。现有青铜腐蚀研究主要是针对裸青铜,对带锈青铜的相关研究较少,但带锈青铜比裸青铜更接近实际青铜文物。故本工作制备了3种带锈青铜试样用以替代青铜文物,研究了其在不同腐蚀介质中的电化学行为,并与裸青铜进行了比较,分析不同锈层在不同环境模拟介质中的腐蚀规律。
1 试验
1.1 腐蚀介质
腐蚀介质有3种:大气环境模拟液,根据文献[7]制备,主要成分为0.028 mol/L NaCl+0.01 mol/L Na2SO4+0.016 mol/L NaHCO3;海洋环境模拟液,根据文献[8]制备,主要成分为0.07 mol/L NaCl+大气环境模拟液;SO2环境模拟液,根据文献[8]制备,主要成分为0.07 mol/L Na2SO3+大气环境模拟液。
1.2 带锈青铜制备
1.3 电化学测试
采用电化学法研究4种青铜试样(裸青铜和3种带锈青铜)在3种腐蚀介质中的腐蚀行为。 电化学测试在PARSTAT 2273型电化学工作站上采用三电极体系进行。工作电极是青铜电极,参比电极为217型饱和甘汞电极(SCE),辅助电极为铂丝电极。电化学阻抗谱(EIS)测试在开路下进行,频率范围为5 mHz~95 kHz,扰动电位为10 mV。
2 结果与讨论
2.1 锈层表面形貌及成分
图1是4种青铜的扫描电镜图(SEM),表1是其能谱(EDS)分析结果[11]。
由图1可见:裸青铜表面平整光滑,有砂纸打磨后的划痕;带Cu2O锈青铜表面比裸青铜粗糙一些,且表面分布有较均匀的立方体锈层;带CuCl锈青铜表面疏松,锈层分布不均匀,有较大的孔隙;带混合锈青铜的锈层较为均匀,但有一些较大的颗粒存在。由表1可知,制成的各锈层成分较为理想,混合锈中包含CuCl、Cu2O、Cu2Cl(OH)3、Cu2CO3(OH)2、Cu4SO4(OH)6等成分[12]。

(a) 裸青铜(b) 带Cu2O锈青铜 (c) 带CuCl锈青铜(d) 带混合锈青铜图1 4种青铜的表面形貌Fig. 1 Surface morphology of 4 kinds of bronze:(a) bare bronze; (b) bronze with Cu2O; (c) bronze with CuCl; (d) bronze with mixed patina

%
2.2 在大气环境模拟液中的电化学腐蚀行为
开路电位(OCP)体现了金属的热力学稳定性,可用于研究金属腐蚀的机理[13]。当OCP往正向移动时表示金属钝化,金属表面生成氧化膜,腐蚀倾向变小;当OCP往负向移动时表示金属活化,表面氧化膜溶解腐蚀倾向变大。
由图2可知:在大气环境模拟液中,裸青铜的开路电位随浸泡时间的推移而缓慢降低,这是由于裸青铜与腐蚀介质接触后,在空气中形成的表面氧化膜与腐蚀介质反应,导致腐蚀电位下降;浸泡初期,
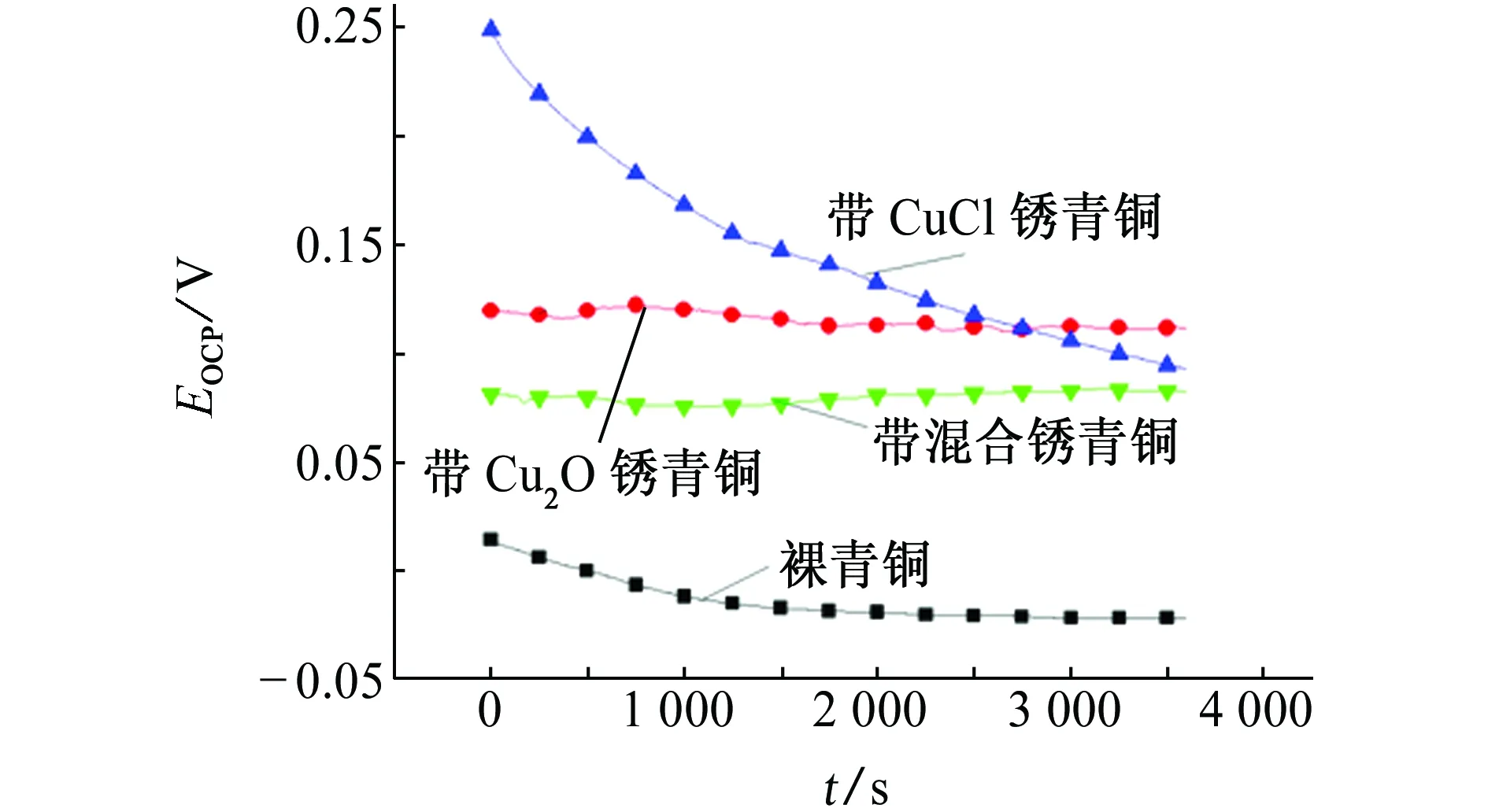
图2 大气环境模拟液中4种青铜的开路电位随浸泡时间的变化曲线Fig. 2 Curves of open circuit potential vs time for 4 kinds of bronze in atmospheric environment simulation solution
带CuCl锈青铜的开路电位下降速率比裸青铜的快很多,这是由于CuCl锈结构疏松,腐蚀介质易于穿过锈层接触基体,从而腐蚀倾向增大,而后在青铜基体表面形成钝化膜,当钝化膜均匀覆盖在青铜表面后,电位趋于稳定;带Cu2O锈和带混合锈青铜的开路电位随时间变化都比较稳定。
在大气环境模拟液中稳定后即浸泡3 600 s后,4种青铜的开路电位大小顺序为:带Cu2O锈青铜(0.115 V)>带CuCl锈青铜(0.095 V)>带混合锈青铜(0.083 V)>裸青铜(-0.022 V)。这表明裸青铜在大气环境模拟液中的腐蚀倾向最大,带Cu2O锈青铜的最小。
第二,涉及汉民族独特文化的谜语。如前所述,有些传统的文化现象在逐步消亡,年轻人对其日益陌生,包含此类文化现象的谜语,猜度起来就相当困难了。如谜底为“日”字的字谜:
图3是3种带锈青铜与裸青铜在大气环境模拟液中浸泡1 h和48 h时电化学阻抗谱的对比。图4是用于拟合电化学阻抗谱的等效电路图,拟合得到的参数见表2。图中,Rs是溶液电阻;Rct是电荷转移电阻;Rf是膜电阻;Zw是韦伯阻抗;电极界面双电层电容与理想电容有一定的偏离,即“弥散效应”,且这种“弥散效应”不可忽略[14],因此,Cf、Cdl分别是膜电容和双电层电容,nf和ndl分别是Cf、Cdl对应的离散系数。
裸青铜、带Cu2O锈青铜和带混合锈青铜浸泡1 h和48 h时的阻抗谱分别用图4(a)和图4(b)所示的等效电路拟合,带CuCl锈青铜浸泡1 h和48 h的阻抗谱用图4(c)所示的等效电路拟合。另外,表2中的Rp代表极化电阻,是体系中Rf与Rct之和[15],可用来表征金属的耐蚀性[16-17]。

(a) 带Cu2O锈青铜(b) 带CuCl锈青铜(c) 带混合锈青铜图3 3种带锈青铜与裸青铜在大气环境模拟液中浸泡1 h和48 h时电化学阻抗谱的对比Fig. 3 EIS comparison of 3 kinds of patinaed bronze with bare bronze in atmospheric environment simulation solution for 1 h and 48 h: (a) bronze with Cu2O; (b) bronze with CuCl; (c) bronze with mixed patina
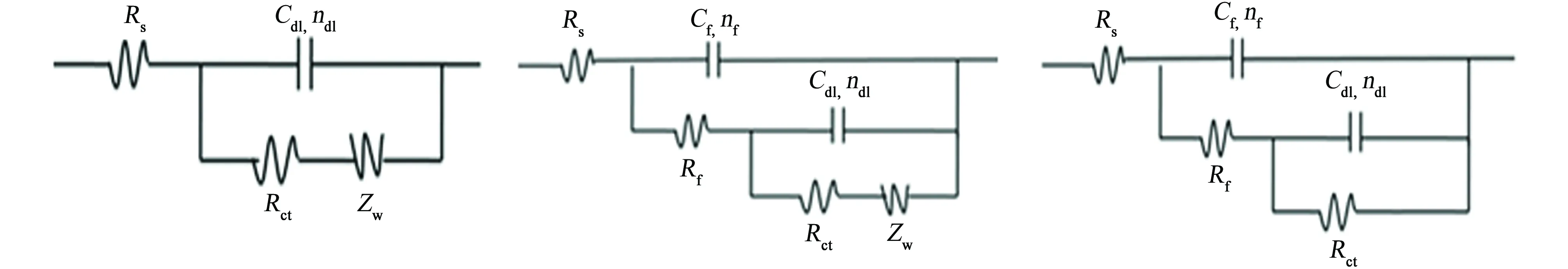
(a) 等效电路一(b) 等效电路二(c) 等效电路三图4 电化学阻抗谱等效电路Fig. 4 Equivalent electrical circuits of No. 1 (a), No. 2 (b) and No. 3 (c) for EIS fitting
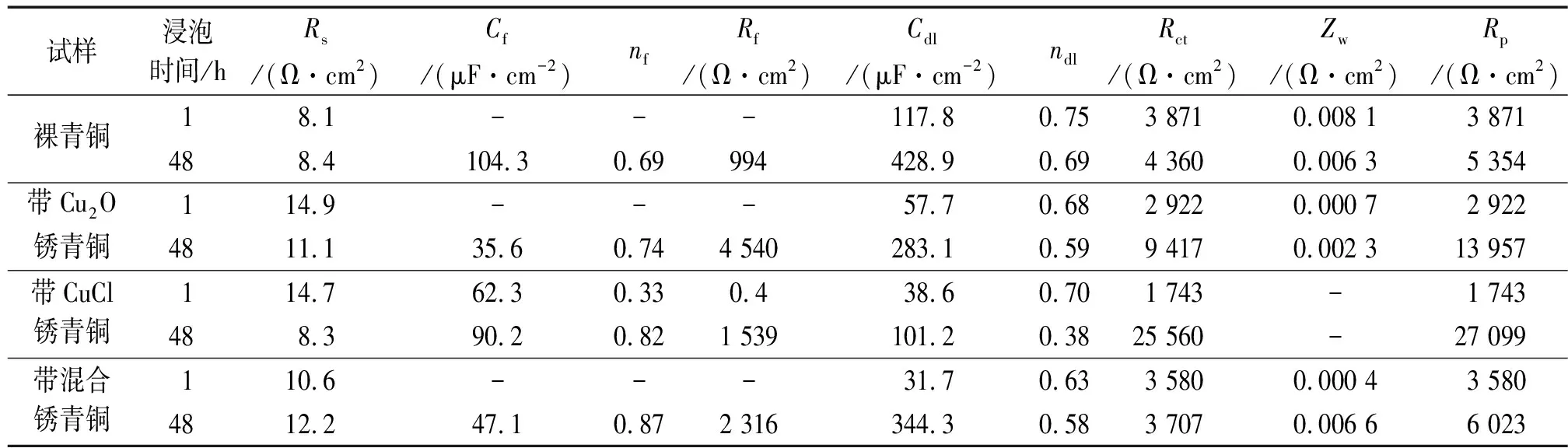
试样浸泡时间/hRs/(Ω·cm2)Cf/(μF·cm-2)nfRf/(Ω·cm2)Cdl/(μF·cm-2)ndlRct/(Ω·cm2)Zw/(Ω·cm2)Rp/(Ω·cm2)裸青铜18.1---117.80.753 8710.008 13 871488.4104.30.69994428.90.694 3600.006 35 354带Cu2O锈青铜114.9---57.70.682 9220.000 72 9224811.135.60.744 540283.10.599 4170.002 313 957带CuCl锈青铜114.762.30.330.438.60.701 743-1 743488.390.20.821 539101.20.3825 560-27 099带混合锈青铜110.6---31.70.633 5800.000 43 5804812.247.10.872 316344.30.583 7070.006 66 023
由图3(a)可见:在大气模拟液中浸泡1 h时,在裸青铜和带Cu2O锈青铜电化学阻抗谱的高频区均出现一个容抗弧,这是电化学法拉第过程;低频区均有一条扩散尾弧,表现为具有扩散特征的Warburg阻抗,表明此时腐蚀反应速率快,电子传递过程快,反应由氧的扩散过程控制[18]。一般来说,高频区代表沉积膜的响应,中频区代表基体的法拉第响应,低频区代表腐蚀产物、氯离子或者氧的扩散响应[19]。由表2可见:在浸泡1 h时,裸青铜的极化电阻大于带Cu2O锈青铜的,说明此时裸青铜的耐蚀性好于带Cu2O锈青铜的。这可能是由于带Cu2O锈青铜的表面不均匀处发生腐蚀,成为腐蚀微电池的阳极,反应见式(1)[20],反应生成的Cu4SO4(OH)6溶解度更小,并使环境呈一定的碱性,因此腐蚀速率减小。而裸青铜表面发生的腐蚀反应如式(2)~(3)所示[21],CuCl2-又通过与氧反应产生OH-,更多的CO2溶解在溶液中形成CO32-,与Cu2(OH)3Cl反应生成化学势上更加稳定的Cu2(OH)2CO3。由图3(a)和表2还可见:浸泡48 h时,在裸青铜和带Cu2O锈青铜电化学阻抗谱的中高频区都出现了两个容抗弧耦合的现象,说明腐蚀产物正慢慢沉积于青铜表面;与裸青铜相比,带Cu2O锈青铜的极化电阻更大,这可能是因为其生成的Cu4SO4(OH)6更加均匀稳定引起的。

Cu4SO4(OH)6+2OH-
(1)

(2)

(3)
由图3(b)可见:在大气模拟液中浸泡1 h时,带CuCl锈青铜的阻抗谱没有出现扩散尾弧,反应主要受电化学活化控制。这可能是由于CuCl锈结构疏松,基体与腐蚀介质接触面积大,使氧扩散加速所致。电荷转移电阻与腐蚀速率呈反比关系[21],在浸泡1 h时,带CuCl锈青铜的电荷转移电阻小于裸青铜的,表明腐蚀初期带CuCl锈青铜的耐蚀性比裸青铜的差。其原因有多方面:首先CuCl与腐蚀介质(Cl-)发生反应生成CuCl2-和CuCl3-,即CuCl被络合而溶解;其次,CuCl可以与O2和H2O发生反应生成CuCl2·3Cu(OH)2和HCl,HCl中的H+对基体进一步腐蚀生成CuCl,CuCl可再次与Cl-反应生成CuCl2·3Cu(OH)2,最终导致青铜器基体被破坏。由图3(b)和表2还可见:浸泡时间延长至48 h时,带CuCl锈青铜的容抗弧半径增大,表明其表面腐蚀产物随浸泡时间的延长逐步增厚;带CuCl锈青铜的电荷转移电阻大于裸青铜的,说明浸泡48 h时带CuCl锈青铜的耐蚀性比裸青铜的好。这可能是由于CuCl锈结构疏松,腐蚀性介质通过CuCl锈层与CuCl2-反应生成Cu2(OH)2CO3的速率更快,减缓了基体的腐蚀。
由图3(c)可见:带混合锈青铜在大气模拟液中浸泡1 h和48 h时的阻抗谱与裸青铜的相似。由表2可见:在浸泡1 h时,带混合锈青铜的极化电阻略小于裸青铜的,说明带混合锈青铜的腐蚀速率更快;浸泡48 h时,带混合锈青铜的极化电阻增大,腐蚀速率降低,这是因为此时混合锈与腐蚀介质发生反应,生成更稳定的腐蚀产物。
另外,在浸泡48 h时,4种青铜的极化电阻比浸泡1 h时的大,这表明随着浸泡时间的延长,4种青铜的腐蚀均减缓。
2.3 在海洋环境模拟液中的电化学腐蚀行为
由图5可见:在海洋环境模拟液中,带混合锈青铜和裸青铜的开路电位变化趋势相似,表现为先急剧升高然后趋于稳定,刚浸入海洋环境模拟液中时,这2种青铜表面被迅速氧化,因此开路电位出现急剧升高,待氧化膜覆盖青铜表面后,开路电位就趋于稳定了;带Cu2O锈青铜的开路电位随浸泡时间的波动不大,这可能是由于Cu2O的氧化膜较为致密;带CuCl锈青铜的开路电位随浸泡时间延长缓慢下降,说明腐蚀介质穿过酥松的锈层腐蚀基体,但反应相对缓慢。
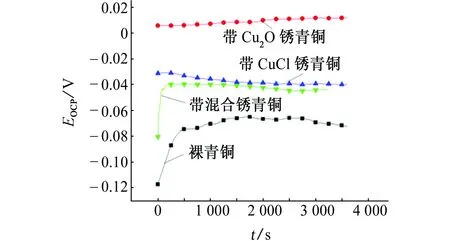
图5 海洋环境模拟液中4种青铜的开路电位随浸泡时间的变化曲线Fig. 5 Curves of open circuit potential vs time for 4 kinds of bronze in marine environment simulation solution
在海洋环境模拟液中稳定后即浸泡3 600 s后, 4种青铜开路电位大小顺序为:带Cu2O锈青铜(0.012 V)>带CuCl锈青铜(-0.034 V)>带混合锈(-0.044 V)>裸青铜(-0.072 V)。结果表明,裸青铜的腐蚀倾向最大,带Cu2O锈青铜的最小,与大气环境模拟液中呈现的规律相同。同时,与大气环境模拟液中的开路电位相比,海洋环境模拟液中的开路电位均出现负移,说明在海洋环境模拟液中4种青铜的腐蚀倾向比在大气环境模拟液中的更大。
图6是3种带锈青铜与裸青铜在海洋环境模拟液中浸泡1 h和48 h时电化学阻抗谱的对比。采用图4(a)和图4(b)所示等效电路对裸青铜、带Cu2O锈青铜和带CuCl锈青铜浸泡1 h和48 h时的阻抗谱时进行拟合,采用图4(b)所示的等效电路对带混合锈锈青铜浸泡1 h和48 h时的阻抗谱进行拟合。表3是4种青铜在海洋环境模拟液中阻抗谱的拟合参数。
由图6(a)可见:在海洋环境模拟液中浸泡1 h时,裸青铜和带Cu2O锈青铜阻抗谱的高频区均出现了一个容抗弧,在低频区均出现扩散尾弧。由表3可见:在浸泡1 h时,裸青铜的极化电阻略小于带Cu2O锈青铜的;当浸泡时间延长到48 h时,这2种青铜的膜电阻均增大,但裸青铜膜电阻的增大幅度更大,说明随着浸泡时间的延长,裸青铜更耐腐蚀,但两者相差不大。由前文可知,在腐蚀初期裸青铜也会生成Cu2O、H+和含氯化合物,一部分Cu2O生成Cu4SO4(OH)6,但在高含量Cl-环境中,随着H+的生成,另一部分Cu2O会产生CuCl2·3Cu(OH)2,如式(4)所示,使青铜发生粉化。

CuCl2·3Cu(OH)2
(4)
由图6(b)可见:与浸泡1 h时比,浸泡48 h时带CuCl锈青铜的容抗弧半径基本不变,腐蚀速率基本不变,同时低频区也出现了扩散尾弧,此时反应主要由扩散控制;浸泡1 h时,带CuCl锈青铜的电荷转移电阻略小于裸青铜的,表明带CuCl锈青铜更易被腐蚀,这主要由于在高含量Cl-环境中,CuCl极易发生反应,如式(3)和式(5)所示,而CuCl4-具有很强的氧化性,会破坏青铜基体,见式(6),如此循环往复,从而产生更多的CuCl2·3Cu(OH)2,使青铜基体遭到严重破坏。
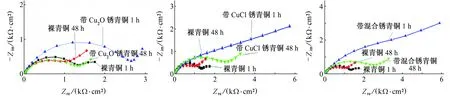
(a) 带Cu2O锈青铜(b) 带CuCl锈青铜(c) 带混合锈青铜图6 3种带锈青铜与裸青铜在海洋环境模拟液中浸泡1 h和48 h时电化学阻抗谱的对比Fig. 6 EIS comparison of 3 kinds of patinated bronze with bare bronze in marine environment simulation solution:(a) bronze with Cu2O; (b) bronze with CuCl; (c) bronze with mixed patina
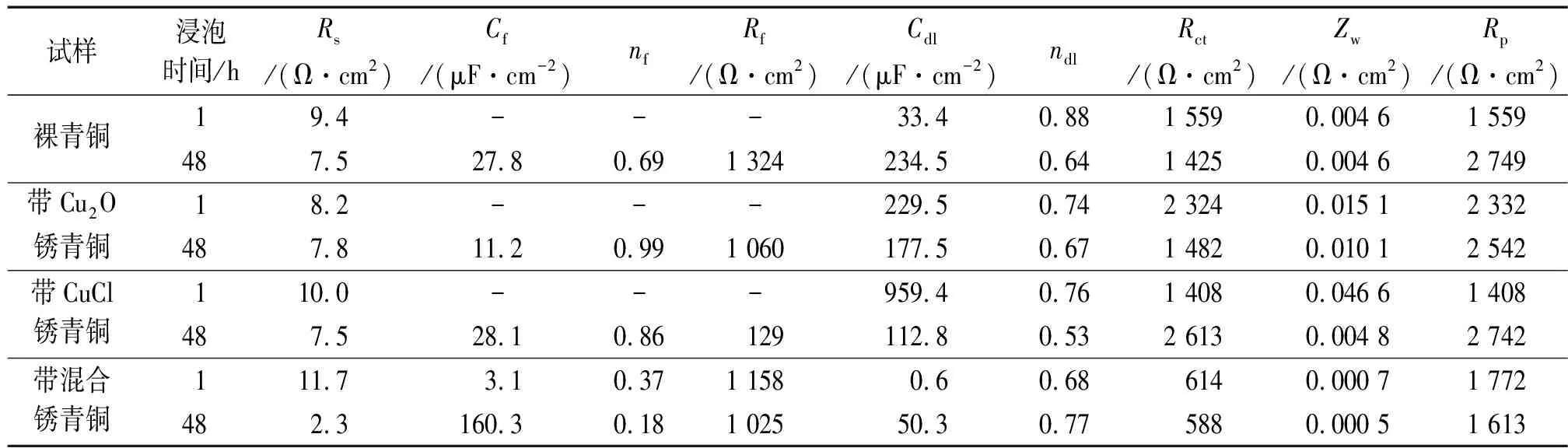
试样浸泡时间/hRs/(Ω·cm2)Cf/(μF·cm-2)nfRf/(Ω·cm2)Cdl/(μF·cm-2)ndlRct/(Ω·cm2)Zw/(Ω·cm2)Rp/(Ω·cm2)裸青铜19.4---33.40.881 5590.004 61 559487.527.80.691 324234.50.641 4250.004 62 749带Cu2O锈青铜18.2---229.50.742 3240.015 12 332487.811.20.991 060177.50.671 4820.010 12 542带CuCl锈青铜110.0---959.40.761 4080.046 61 408487.528.10.86129112.80.532 6130.004 82 742带混合锈青铜111.73.10.371 1580.60.686140.000 71 772482.3160.30.181 02550.30.775880.000 51 613

(5)

(6)
由图6(c)可见,在海洋环境模拟液中浸泡1 h时,带混合锈青铜在中高频区就出现两个耦合的容抗弧,这可能是混合锈本身具有沉积膜特征,在大气模拟液中带CuCl锈青铜也表现出微弱的沉积膜特征,但由于锈层不够致密,该特征不明显;浸泡时间延长至48 h时,容抗弧半径变小,说明其耐蚀性变差。 由表3可见:浸泡1 h时,裸青铜的极化电阻略低于带混合锈青铜的,表明带混合锈青铜在海洋环境模拟液中的腐蚀速率更小。
另外,对比可知,4种青铜在大气环境模拟液中的极化电阻基本比在海洋环境模拟液中的小,说明海洋环境中的高含量Cl-会增大对青铜的腐蚀。
2.4 在SO2环境模拟液中的电化学腐蚀行为
由图7可见:在SO2环境模拟液中,裸青铜表面生成的钝化膜在模拟液中缓慢溶解,所以其开路电位随浸泡时间的延长而下降,但电位最终保持相对平稳;Cu2O锈层存在孔隙,腐蚀介质容易侵入基体,导致带Cu2O锈青铜的开路电位开始剧烈下降,但之后形成更均匀的腐蚀产物层,因此其开路电位趋于稳定;带CuCl锈青铜的开路电位起初是一个缓慢下降的过程,随后经历了较为快速的下降,说明腐蚀介质在浸泡一段时间以后才与基体发生反应,这可能是腐蚀介质更易与CuCl发生反应,最终趋于稳定。带混合锈青铜的开路电位曲线相对稳定,这说明混合锈的结构致密,与腐蚀介质反应缓慢。
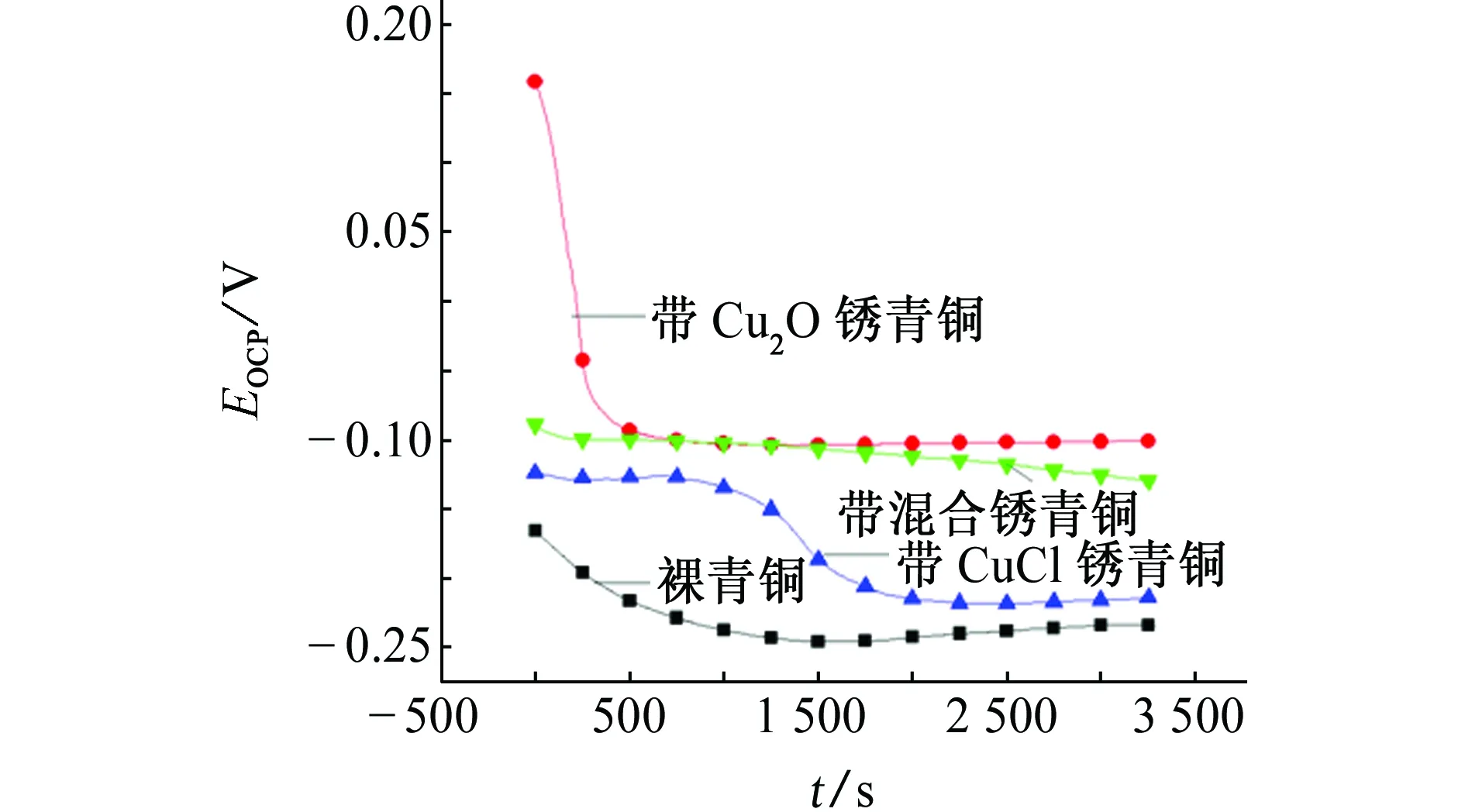
图7 SO2环境模拟液中4种青铜的开路电位随浸泡时间的变化曲线Fig. 7 Curves of open circuit potential vs time for 4 kinds of bronze in SO2 environment simulation solution
在SO2环境模拟液中稳定后即浸泡3 600 s后,4种青铜的开路电位大小顺序为带Cu2O锈青铜(-0.101 V)>带混合锈青铜(-0.129 V)>带CuCl锈青铜(-0.214 V)>裸青铜(-0.234 V)。这说明在SO2环境模拟液中,带Cu2O锈青铜的腐蚀倾向最小,而裸青铜的最大;较大气环境模拟液和海洋环境模拟液中的开路电位相比,4种青铜在SO2环境模拟液中的开路电位均发生了负移,表明青铜在该腐蚀介质中的腐蚀倾向最大。
图8是3种带锈青铜与裸青铜在SO2环境模拟液下浸泡1 h和48 h时电化学阻抗谱的对比。裸青铜、带Cu2O锈青铜和带CuCl锈青铜浸泡1 h和48 h时的阻抗谱的拟合分别采用图4(a)和图4(c)所示等效电路,带混合锈青铜浸泡时间1 h和48 h时的阻抗谱的拟合采用图4(c)所示等效电路。表4是4种青铜在SO2环境模拟液中电化学阻抗谱的拟合参数。
由图8(a)和表4可见:在SO2环境模拟液中浸泡1 h时,裸青铜和带Cu2O锈青铜在高频区均出现了一个容抗弧,低频出现扩散尾弧,裸青铜和带Cu2O锈青铜的电荷转移电阻均较大,而浸泡48 h时,电荷转移电阻显著下降,容抗弧半径均减小,表明两者腐蚀速率均增大,但此时膜电阻均有所增大,低频区的扩散尾弧均消失,表明腐蚀产物沉积在青铜表面,填满锈层的孔隙,形成均匀的腐蚀产物层,其反应为
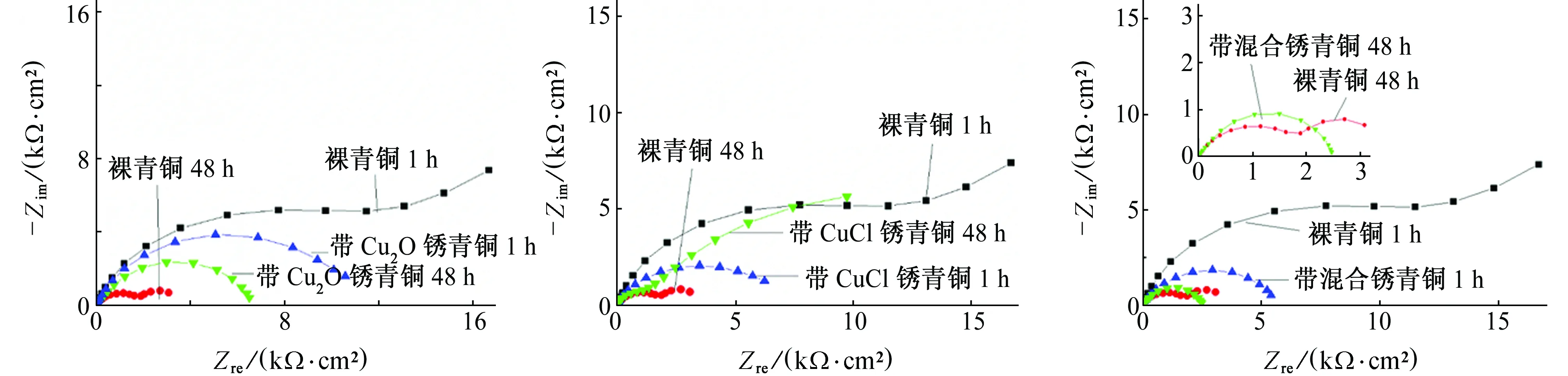
(a) 带Cu2O锈青铜(b) 带CuCl锈青铜(c) 带混合锈青铜图8 3种带锈青铜与裸青铜在SO2环境模拟液中浸泡1 h和48 h时电化学阻抗谱的对比Fig. 8 EIS comparison of 3 kinds of patinated bronze with bare bronze in SO2 environment simulation solution:(a) bronze with Cu2O; (b) bronze with CuCl; (c) bronze with mixed patina
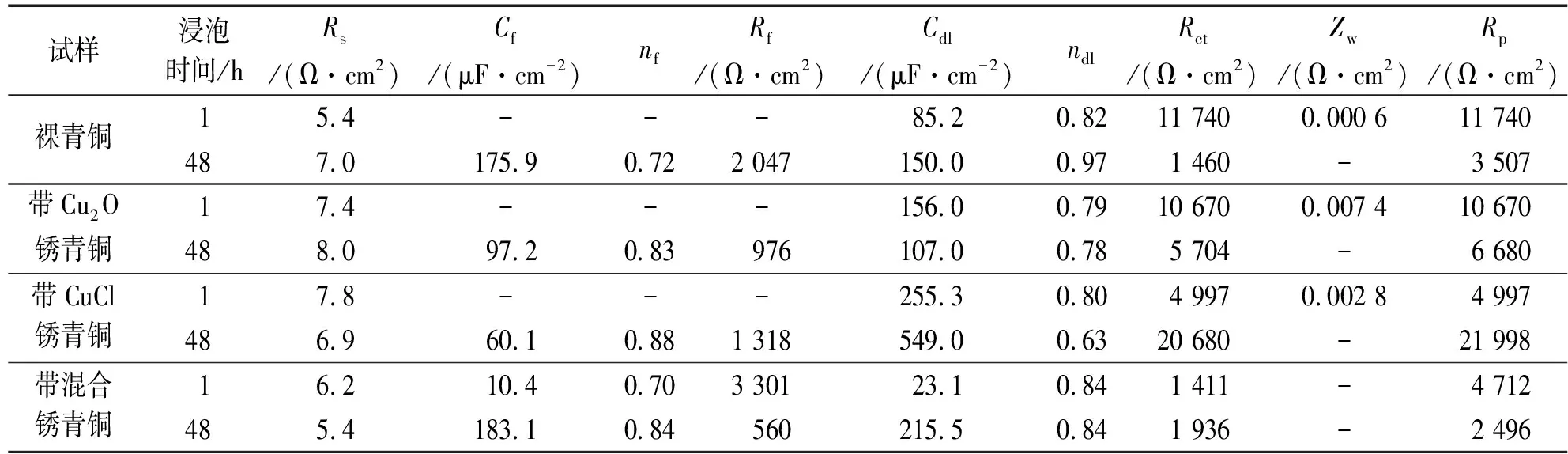
试样浸泡时间/hRs/(Ω·cm2)Cf/(μF·cm-2)nfRf/(Ω·cm2)Cdl/(μF·cm-2)ndlRct/(Ω·cm2)Zw/(Ω·cm2)Rp/(Ω·cm2)裸青铜15.4---85.20.8211 7400.000 611 740487.0175.90.722 047150.00.971 460-3 507带Cu2O锈青铜17.4---156.00.7910 6700.007 410 670488.097.20.83976107.00.785 704-6 680带CuCl锈青铜17.8---255.30.804 9970.002 84 997486.960.10.881 318549.00.6320 680-21 998带混合锈青铜16.210.40.703 30123.10.841 411-4 712485.4183.10.84560215.50.841 936-2 496

(7)
随后Cu2O进一步生成Cu4SO4(OH)6。此时,裸青铜的极化电阻小于带Cu2O锈青铜的,这可能是由于带Cu2O锈青铜生成的腐蚀产物层更致密均匀引起的。
由图8(b)和表4可见:在SO2环境模拟液中浸泡1 h时,带CuCl锈青铜的阻抗谱与裸青铜的相似,带CuCl锈青铜的电荷转移电阻比裸青铜的小,表明此时带CuCl锈青铜的腐蚀速率比裸青铜的大;浸泡48 h时,带CuCl锈青铜在高频区呈现出两个耦合的容抗弧,扩散尾弧消失,电荷转移电阻急剧增大,且远大于裸青铜的电荷转移电阻,表明此时带CuCl锈青铜更耐腐蚀,其表面生成均匀稳定的腐蚀产物,腐蚀完全由电化学活化控制。
由图8(c)和表4可见:在SO2环境模拟液中浸泡1 h和48 h时,带混合锈青铜在中高频区均出现容抗弧,但未出现扩散尾弧,其原因可能是混合锈层均匀覆盖在基体表面,阻抗谱表现的是锈层特性;带混合锈青铜浸泡48 h时的极化电阻比浸泡1 h时的小,表明腐蚀速率随浸泡时间延长而增大;同时,浸泡1 h和48 h时带混合锈青铜的极化电阻均小于裸青铜的,即其耐蚀性比裸青铜的差。
对比4种青铜在3种腐蚀介质中的极化电阻可知,其大小顺序为大气环境模拟液>SO2环境模拟液>海洋环境模拟液,这表明Cl-和SO2的存在均会加快青铜的腐蚀,并且,海洋环境的腐蚀性比SO2环境的更强。
3 结论
(1) 带Cu2O锈青铜在3种环境模拟液中的腐蚀倾向性最小,而裸青铜的最大。
(2) 青铜试样在3种环境模拟液中的腐蚀程度顺序为:海洋环境模拟液>SO2环境模拟液>大气环境模拟液。Cl-和SO2均会加速青铜的腐蚀,且Cl-有更强的腐蚀性。
(3) 在大气环境模拟液中浸泡1 h时,裸青铜的耐蚀性最好,随着浸泡时间的延长,3种带锈青铜的腐蚀速率都降低,带锈青铜表现出更高的耐蚀性,耐蚀性顺序为带CuCl锈青铜>带Cu2O锈青铜>带混合锈青铜;在海洋环境模拟液中,4种青铜的耐蚀性均较差,表明青铜文物在该环境中会发生较严重的腐蚀,并且耐蚀性不随时间的变化而明显增强;在SO2环境模拟液中,除了带CuCl锈青铜,其余青铜的耐蚀性均随着时间的推移大幅度降低,表明青铜文物保存时间越长,腐蚀破坏越严重。

