白藜芦醇对大鼠脑缺血再灌注海马损伤的保护作用及对MMP-9表达的影响
张跃奇,王 媛,张志强,梁 霞,张桂青
(1.新疆医科大学第五附属医院临床心理门诊,乌鲁木齐 830000;2.新疆维吾尔自治区乌鲁木齐市第四人民医院精神一科 830000;3.石河子大学医学院第一附属医院康复心理科,新疆石河子 832000)
因心脏骤停、严重缺氧等情况导致的短暂性脑缺血所引发的缺血性脑卒中最为多见[1]。短暂性的脑缺血会诱发大脑敏感区如海马组织的神经细胞损伤,这些损伤往往在缺血后数天才表现出一系列的临床症状,因此被称为迟发型神经损伤。迟发型神经损伤的病理机制涉及炎症、氧化应激、细胞凋亡、神经毒性和神经保护等多方面[2],目前尚未完全阐明。海马区对缺血十分敏感,脑缺血会导致谷氨酸过量分泌,引发大量钙离子进入神经细胞,从而激活多种蛋白酶,最终导致神经毒性,引起神经细胞损伤[3],甚至凋亡[4]。基质金属蛋白酶(MMP)在中枢神经系统病理生理过程中发挥重要作用[5-6],其中MMP-2和MMP-9参与脑出血和神经损伤的病理过程[7],与脑损伤密切相关[8]。白藜芦醇(RES)是一种有丰富生物活性的天然多酚[9],在缺血再灌注(I/R)损伤中可能起到神经保护的作用[10-11]。本研究旨在探讨RES对短暂性脑缺血后大鼠神经细胞损伤的保护作用。
1 材料与方法
1.1材料 24只6周龄SPF级雄性Wistar大鼠,体质量(180±25)g,由新疆医科大学实验动物中心提供[许可证号:SCXK(新)2003-0001],所有大鼠为同一批次,经一般体检均无异常。大鼠自由进食饮水,饲养于室温20~23 ℃,湿度50%~60%,严格12 h∶12 h自然光照的动物房。实验开始前适应环境1周。实验过程严格遵守新疆医科大学关于利用实验动物开展研究的规定。
1.2方法
1.2.1实验分组 将大鼠分为假手术组(Sham组)、I/R组和RES组,每组8只。
1.2.2右侧大脑中动脉闭塞大鼠模型建立 I/R组和RES组大鼠采用国际成熟的线栓法建立动物模型[12]。Sham组大鼠操作大致与线栓法相同,区别为仅插入尼龙线约2 mm,以确保不会造成大脑中动脉阻塞。待大鼠意识恢复,将其放于通风良好的原笼中精心饲养。
1.2.3大鼠神经功能损害评价 根据预实验情况,于手术麻醉苏醒后10 min和I/R后72 h进行两次大鼠神经功能损害评价。采用国际惯用5级评价标准:0分,无神经损害的症状;1分,不能伸展对侧前爪;2分,向外侧转圈;3分,向对侧倾倒;4分,不能自主行走,意识丧失[13]。
1.2.4激光多普勒大脑中动脉血流量检测 采用激光多普勒流量计(Periflux 5000系统,Perimed公司)检测大脑中动脉血流量,检测的4个时间点分别为:手术麻醉苏醒后10 min及I/R后1、24、72 h。
1.2.5RES给药方法 采用无水乙醇溶解RES(美国Sigma公司),并用0.5%临界胶束浓度(CMC)溶液稀释。RES组给药剂量为40 mg/kg,每天1次腹腔注射,造模前连续10 d给药。Sham组和I/R组给予腹腔注射0.5%CMC,剂量及时间同给药组。
1.2.6免疫组织化学检测大鼠海马MMP-9表达 造模后72 h将各组大鼠进行心脏灌注取脑,置于4 ℃的4%多聚甲醛溶液浸泡24 h。依次进行脱水、透明、浸蜡、石蜡包埋操作,之后行冠状位连续切片,片厚3 μm。所有大鼠等间隔选取位置大致相同的海马脑片各10张。一抗采用兔抗大鼠MMP-9(英国Abcam公司)。实验设立空白对照(不加一抗和二抗,加磷酸盐缓冲液)和抗体特异性对照(加一抗,不加二抗)。免疫组织化学实验操作按照标准操作流程进行,最后中性树脂封片镜检。采用Image-Pro Plus 6.0图像分析软件测量视野下阳性表达区域的累积光密度(IOD)和面积(area),并计算最终平均光密度值(MOD=IOD/area)。

2 结 果
2.13组神经功能损伤评分 由图1所示,手术麻醉苏醒后10 min及I/R 72 h后进行神经功能损伤评分,I/R组和RES组的大鼠均表现出左侧肢体肌力降低,而Sham组无明显神经功能受损表现,与前两组比较差异有统计学意义(F=75.93,P<0.01)。RES组评分明显低于I/R组,差异有统计学意义(F=4.90,P=0.033)。I/R组I/R后72 h评分较苏醒后10 min评分略有升高,但差异无统计学意义(P>0.05),见图1。

图1 3组神经功能损伤评分比较
2.2大脑中动脉血流量变化检测 与Sham组相比,I/R组和RES组大鼠均表现脑血流量不同程度降低,差异有统计学意义(P<0.05)。随时间延长,I/R组和RES组大鼠均表现脑血流量逐渐增加,但这两组之间在4个时间点脑血流量比较差异无统计学意义(P>0.05),见图2。
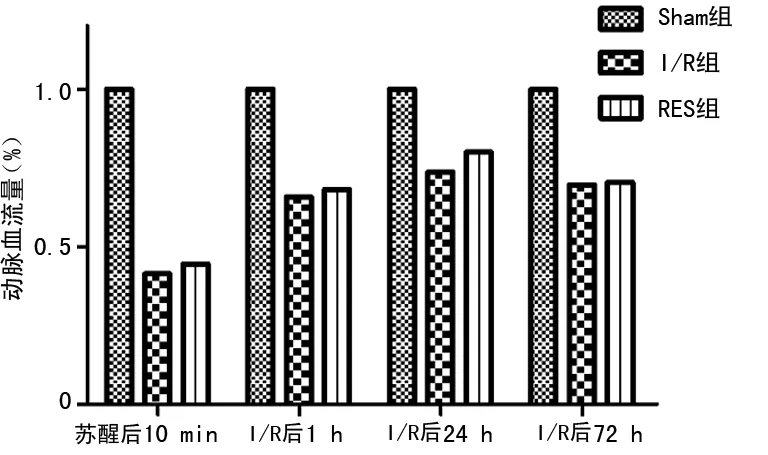
图2 3组大脑中动脉血流量比较
2.3MMP-9在大鼠海马的表达情况 3组免疫组织化学图像由图3所示,MMP-9主要定位于细胞质,Sham组在海马CA1区和CA2区均未见MMP-9免疫阳性细胞表达。I/R组和RES组在海马CA1区和CA2区均可见MMP-9免疫阳性细胞表达。Sham组在CA1区的MOD值为0.362±0.081,在CA2区的MOD值为0.349±0.044,均明显低于I/R组(CA1区5.866±1.230,CA2区8.347±2.428)和RES组(CA1区3.715±0.925,CA2区4.582±1.642),差异有统计学意义(P<0.01)。I/R组在两个海马区均明显高于RES组(P=0.011),见图4。
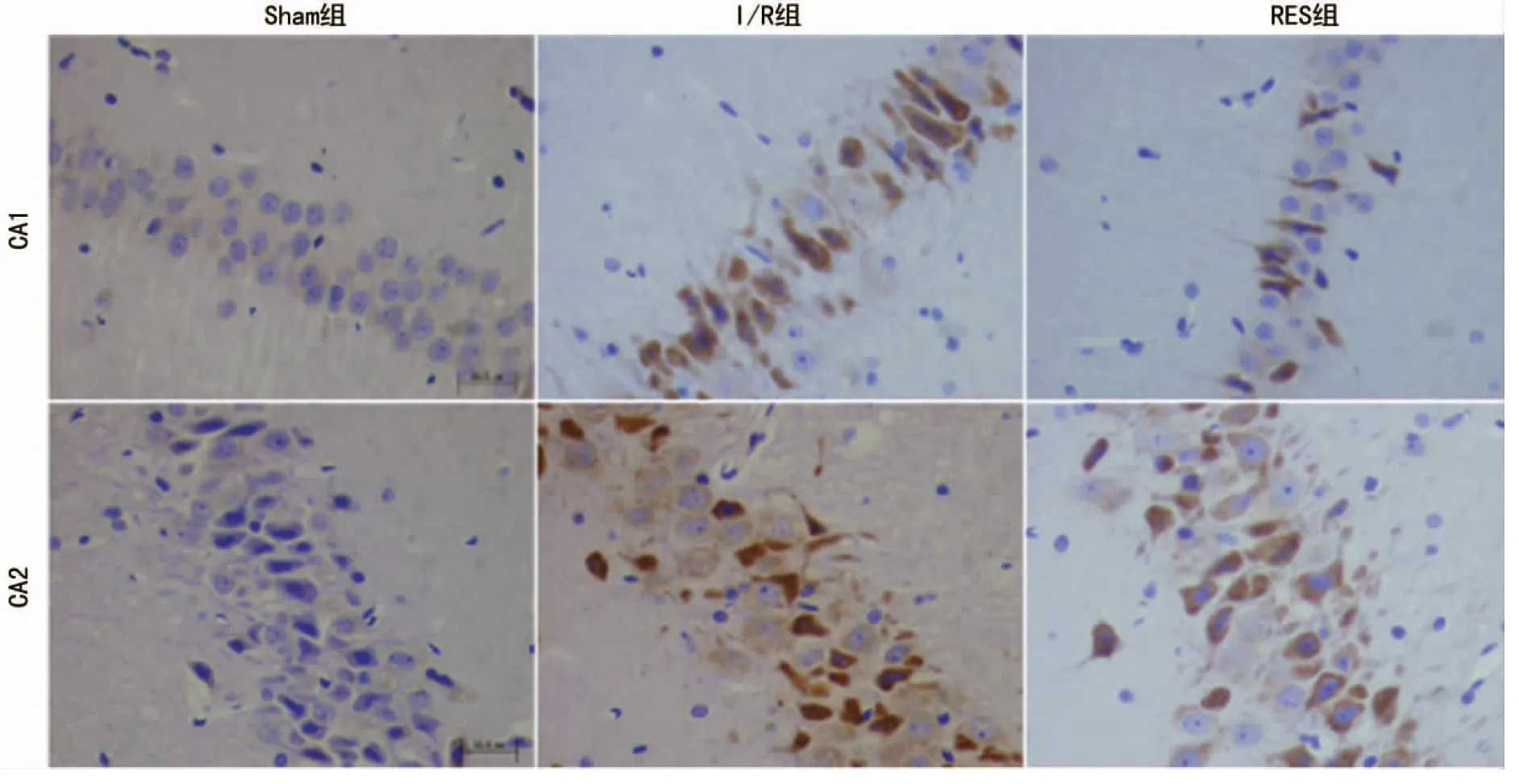

图4 MMP-9在大鼠海马CA1区和CA2区的MOD表达水平
3 讨 论
脑卒中患者认知功能、运动能力的严重受损大多是由于I/R损伤对大脑神经细胞的损害[14-15]。研究表明,这种缺血缺氧损伤对海马锥体细胞的伤害尤为明显,常引起神经细胞的凋亡改变[16]。MMP主要参与细胞外基质的降解过程,近年来病理研究发现,MMP中特别是MMP-2和MMP-9参与了中枢神经系统损伤后的许多病理过程[17]。正常状态下,大脑MMP-9的表达处于低水平,但受到外界刺激,尤其是缺血缺氧改变,其水平会急剧升高,有研究发现,MMP表达升高可导致血糖屏障(BBB)分解,从而引发脑水肿、脑出血,甚至神经细胞不可逆损伤[18]。ZALEWSKA等[19]首次发现,MMP活性的增加可破坏细胞基质,并导致海马神经细胞凋亡的发生。而当这种蛋白酶表达受控制时,海马神经细胞损伤会明显减少[20]。本研究也发现了相同的结果,即在I/R组海马CA1区和CA2区的MMP-9水平均最高,同时这组大鼠的神经功能评分最高,因此本研究认为两者之间可能存在相关性。通过激光多普勒仪检测血流,本研究还发现MMP-9水平与大脑中动脉血流量之间无相关性。
RES是存在于各种植物中的多酚类物质,在植物暴露于压力环境时会诱导这种物质的大量生成[21]。近年来研究发现RES有神经保护作用,但其机制一直未被阐明。本研究发现,大鼠I/R前预防性地给予RES 40 mg·kg-1·d-1腹腔注射,可明显降低大鼠神经功能损伤评分。有研究表明,单次RES给药的神经保护作用在脑内可维持4 h[22]。通过免疫组织化学研究发现RES组大鼠海马CA1区和CA2区的MMP-9免疫阳性细胞表达均明显低于I/R组。因此本研究认为,RES在短暂性脑缺血损伤后对大鼠海马神经细胞有一定的保护作用,且这种神经保护作用可能与RES降低了由短暂缺血增加的MMP-9活性有关。RES在其他疾病模型的研究已多有报道[23-24],最近研究进一步发现RES参与缺血缺氧性细胞损伤中限制MMP的表达上调过程,从而抑制心脏、肾脏及大脑等脏器的缺血受损[25-26]。
综上所述,本研究结果表明,I/R前预防性给予10 d RES 40 mg·kg-1·d-1,能有效改善大鼠神经功能损伤预后,其机制可能与RES抑制MMP-9的活性表达有关。本研究的局限性在于没有设立RES浓度梯度,因此不能确定其剂量反应关系,还需后续进一步深入研究。

