长链非编码RNA DLX6-AS1在非小细胞肺癌中的表达及其作用研究
朱多杰,王 成,李 斌,蒋 鹏,杨建宝,宋铁牛,魏小平,孟于琪
(兰州大学第二医院胸外科,兰州 730000)
近年来,肺癌发病率和病死率持续增长,已成为全世界范围内发病率和病死率最高的癌症之一。在所有的肺癌中,非小细胞肺癌(NSCLC)占75%~80%。由于缺乏典型临床表现,NSCLC的早期筛查较为困难,大部分患者在首次就诊时已为晚期。此外,预后差也是目前治疗面临的严峻问题[1]。因此,寻找NSCLC有效的早期诊断及预后标志物具有重要的科学意义和临床价值。目前,肿瘤的基因治疗逐渐成为研究的热点,探寻与NSCLC相关的原癌基因和抑癌基因也为诊断和治疗乳腺癌提供了新的研究方向[2]。长链非编码RNA(lncRNA)是长度大于200 nt的非编码RNA,lncRNA通过调节癌细胞的增殖和凋亡发挥抑癌或促癌作用[3]。新近研究发现,NSCLC中多种lncRNA表达异常,且参与其病理发生、发展过程,如lncRNA 肺腺癌相关转录本1(MALAT1)[4]、生长停滞特异性RNA5(GAS5)[5]、HOX转录反义RNA(HOTAIR)[6]、BRAF激活的长链非编码RNA(BANCR)[7]等。随着研究的深入,新的NSCLC相关lncRNA不断被发现。已有文献报道,lncRNA生长停滞特异性蛋白6-反义RNA1(GAS6-AS1)在NSCLC患者的癌组织中表达上调,与肺癌组织分化程度和TNM分期呈明显正相关[8],提示DLX6-AS1可能参与NSCLC的发生、发展。为了验证这一推测,本研究开展了以下两个方面的研究:(1)确证DLX6-AS1在NSCLC患者癌组织与癌旁正常组织的差异表达,并分析DLX6-AS1与NSCLC患者临床病理参数相关性;(2)通过体外细胞实验,运用分子生物学手段揭示DLX6-AS1对NSCLC细胞增殖和凋亡的调控。
1 资料与方法
1.1一般资料 选择2011-2016年于本院胸外科行手术治疗的23例NSCLC患者,取其癌组织及距肿瘤 2 cm外的癌旁组织,术后均经病理检查明确。患者年龄21~68岁,其中男13例,女10例。所有患者术前均未行放化疗,未服用过靶向治疗药物,并签署知情同意书。将收集的癌组织和癌旁正常组织冻于-80 ℃保存。患者临床病理参数如下:淋巴结转移15例,无淋巴结转移8例;Ⅰ~Ⅱ期12例,Ⅲ~Ⅳ期11例。
1.2方法
1.2.1细胞培养 人支气管上皮细胞(16HBE)、NSCLC细胞系(腺癌:A549、SPC-A1,鳞癌:SK-MES-1)均购自美国ATCC公司,运用10%胎牛血清DMEM培基在37 ℃、5%CO2的恒温培养箱中培养。
1.2.2实时定量聚合酶链式反应(qRT-PCR)法检测lncRNA DLX6-AS1表达 16HBE细胞、NSCLC细胞、癌组织或癌旁组织加入适量Trizol裂解,并加入氯仿萃取并涡旋,高速离心(12 000 r/min,15 min),吸取上清液,加入异丙醇加速RNA沉淀,高速离心(12 000 r/min,10 min),倾倒上清液,加入无水乙醇洗涤沉淀,离心收集沉淀,加入焦碳酸二乙酯(DEPC)水溶解沉淀,测定RNA 浓度。取1 μg总RNA逆转录得到cDNA。将扩增体系(8 μL)和cDNA(2 μL)加入八联管中。设置程序:95 ℃预变性 30 s,95 ℃变性5 s,60 ℃退火延伸31 s,共40个循环,运行程序;7300 System SDS Software分析数据,根据Ct值计算RQ值(计算公式:RQ=2-△△Ct),RQ值反映被检测基因相对表达量。引物序列:DLX6-AS1 Forward 5′-AGTTTCTCTCTAGATTGCCTT-3′,DLX6-AS1 Reverse 5′-ATTGACATGTTAGTGCCCTT-3′;GAPDH Forward 5′-AGAGGCAGGGATGATGTTCTG-3′,GAPDH Reverse 5′-GACTCATGACCACAGTCCATGC-3′。
1.2.3细胞实验分组 筛选siRAN活性片段分为:空白组、DLX6-AS1 干扰片段组(干扰片段 1、2、3组)和无关序列组(NC组)。检测DLX6-AS1 siRNA对细胞增殖凋亡影响的实验分组:空白组、DLX6-AS1 siRNA组和无关序列组。
1.2.4细胞转染 由广州锐博生物科技有限公司设计合成3个 DLX6-AS1 siRNA片段(片段 1、2、3)和无关序列片段。A549细胞经消化后接种于12孔培养板,待细胞汇合密度至70%左右时,将转染试剂LipofectamineTM2000与DLX6-AS1siRNA片段37 ℃共孵20 min(包装siRNA),将包装好的siRNA加入细胞培基中继续培养细胞24 h(转染siRNA至细胞内干扰DLX6-AS1表达)。qRT-PCR检测lncRNA DLX6-AS1 siRNA的表达,考察siRNA是否干扰成功。
1.2.5Western blot检测蛋白表达检测 收集A549细胞,加入蛋白裂解液[WIP裂解液:苯甲基磺酰氟(PMSF)=100∶1],裂解1 h后离心,吸取上清液,加入上样缓冲液变性(99 ℃,7 min),运用二喹啉甲酸 (BCA)蛋白测定试剂盒检测蛋白浓度。具体操作参照试剂说明书进行。制备10%的分离胶和浓缩胶,根据上述测定的蛋白浓度计算上样体积(20 μg上样量),控制电压和时间(80 V,30 min;120 V,1 h)跑胶,湿转法转膜,聚偏二氟乙烯(PVDF)膜孵育一抗[B细胞淋巴瘤-2(Bcl-2)和Bcl-2相关X蛋白(Bax),均用一抗稀释液稀释1 000倍]4 ℃过夜,Tris缓冲生理盐水吐温(TBST)洗涮,二抗室温孵育1 h,TBST洗涮,置于自动显影仪(ChemiDocXRS成像系统)显影,计算灰度值。
1.2.6细胞增殖检测 采用四甲基偶氮唑蓝比色(MTT)法检测细胞活力。具体步骤如下:A549细胞接种于96孔板中,加入siRNA干扰DLX6-AS1表达后,每孔加入10 μL MTT溶液,在细胞培养箱内继续孵育1 h。每孔加入100 μL Formanzan溶解液,在细胞培养箱内再继续孵育4 h。放置紫外分光光度计于570 nm处测定光密度(OD)值,空白组0 h数值标化为1,所得数值计算出相对值进行比较。
1.2.7细胞凋亡检测 细胞凋亡情况通过检测重组人半胱天冬酶-3(caspase-3)活力和凋亡相关蛋白(Bcl-2和Bax)反映。Bcl-2和Bax蛋白表达检测方法参照方法1.2.4进行。运用caspase-3活性检测试剂盒检测caspase-3活力,大致方法如下:裂解液裂解细胞,释放出caspase-3,加入已配置好的检测caspase-3活力的反应体系,caspase-3催化反应体系中产生pNA,置于紫外分光光度计于405 nm处测定OD值,通过pNA标准曲线计算出样本OD值。具体实验操作参照试剂盒说明书完成。
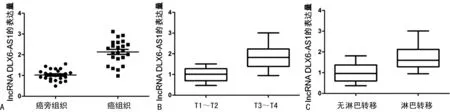
A:DLX6-AS1在癌组织和对应癌旁组织中的表达;B:DLX6-AS1在T1~T2和T3~T4期患者癌组织中的表达;C:DLX6-AS1在发生淋巴转移患者和未发生淋巴转移患者癌组织中的表达

2 结 果
2.1lncRNA DLX6-AS1在NSCLC癌组织中的表达 23例NSCLC患者的癌组织和癌旁组织经qRT-PCR检测lncRNA DLX6-AS1发现,相对癌旁正常组织、肝癌组织中lncRNA DLX6-AS1表达明显上调(P<0.01),见图1A。分析DLX6-AS1与患者临床病理参数相关性,发现相比低分期患者(T1~T2)和无淋巴转移患者,DLX6-AS1在高分期患者(T3~T4)和淋巴转移患者癌组织中的表达更高(P<0.01),见图1B、C。
2.2lncRNA DLX6-AS1在NSCLC细胞中表达水平 相比16HBE,NSCLC腺癌细胞系A549、SPC-A1和鳞癌细胞系SK-MES-1中lncRNA DLX6-AS1表达均上调(P<0.05),且A549增加最明显(P<0.01),故选用A549用于后续实验,见图2。

图2 lncRNA DLX6-AS1在肝癌细胞中的表达水平
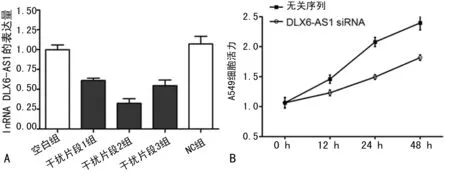
A:转染3个siRNA片段后lncRNA DLX6-AS1的表达;B:A549细胞增殖水平

A:caspase-3活力;B:促凋亡蛋白Bax水平;C:抑凋亡蛋白Bcl-2水平
2.3siRNA干扰lncRNA DLX6-AS1表达对A549细胞增殖的影响 A549细胞转染DLX6-AS1 siRNA片段24 h后,qRT-PCR检测lncRNA DLX6-AS1表达量。结果显示:相比无关序列片段(NC组),3个片段均能有效干扰DLX6-AS1的表达,其中片段2的干扰效率最高(图3A),用于后续细胞功能实验。A549细胞经siRNA干扰DLX6-AS1表达后,分别于0、12、24、48 h运用MTT法检测细胞活力发现,干扰DLX6-AS1可抑制A549细胞增殖(P<0.05),见图3B。
2.4lncRNA DLX6-AS1 siRNA对A549细胞凋亡的影响 lncRNA DLX6-AS1 siRNA可增强caspase-3活力,并上调Bax表达和下调Bcl-2表达(P<0.05),见图4。
3 讨 论
非编码RNA(ncRNA)根据长度又可分为短链ncRNA(≤200 nt)和长链ncRNA(>200 nt)。 既往lncRNA一直被认为是转录过程中产生的“垃圾”, 是RNA聚合酶在转录过程中低保真性的表现[9]。近年来,lncRNA作为原癌基因或抑癌基因受到广泛关注,lncRNA的功能失调与包括NSCLC在内的多种肿瘤的发生密切相关[10]。MALAT1是第1个在肺癌中被研究的lncRNA。SHEN等[11]对78例NSCLC患者进行5年随访,发现MALAT1表达水平与患者生存期密切相关,MALAT1高表达组和低表达组患者中位生存时间分别为52和60个月。提示MALAT1与NSCLC患者预后有关,是反映预后的一个独立因素,MALAT1高表达提示患者预后较差。GAS6-AS1是由HAN等[12]发现的一种新型lncRNA,其位于GAS6基因的下游,并以反义方向转录所得。相比NSCLC癌旁正常组织,GAS6-AS1在癌组织中表达下调,且与TNM分期呈负相关。GAS6-AS1的宿主基因GAS6在NSCLC癌细胞增殖、迁移、黏附和浸润中起重要的促进作用。进一步研究发现,在NSCLC癌组织和细胞中GAS6-AS1与GAS6呈负相关,表明GAS6-AS1可能通过调控GAS6的表达参与NSCLC的发生、发展。
本研究发现,与正常组织相比,在NSCLC组织中DLX6-AS1的表达均显著上调,提示DLX6-AS1基因可能发挥了促癌基因的作用。进一步观察DLX6-AS1与NSCLC患者临床病理参数(淋巴结转移和临床分期)呈明显正相关,提示DLX6-AS1可能参与NSCLC的恶性增殖过程。体外细胞实验发现,相比正常肝细胞,DLX6-AS1在肝癌细胞中表达增加,且A549细胞增加最显著。为进一步证实DLX6-AS1是否参与调节A549的增殖和凋亡过程,本研究运用siRNA干扰DLX6-AS1表达,可抑制A549的细胞活力,增加caspase-3的活力,表明DLX6-AS1可促进A549的增殖并抑制其凋亡。
lncRNA DLX6-AS1为DLX6基因反义方向转录产物,DLX6基因的生物学功能尚未阐明[8],但与DLX6同家族的DLX2和DLX5在实体瘤和恶性血液病中异常表达[13-14],提示DLX家族基因可能与肿瘤发生、发展密切相关。因此,lncRNA DLX6-AS1是否调节DLX6的表达,进而参与NSCLC的发生、发展有待进一步确证。
综上所述,本研究发现lncRNA DLX6-AS1在NSCLC癌细胞中表达上调,并参与调节癌细胞的增殖和凋亡,在NSCLC的发生、发展中起重要作用。本研究为NSCLC的防治提供新的思路和理论基础。但lncRNA DLX6-AS1调控NSCLC细胞增殖和凋亡的具体机制尚不清楚,这将是本研究下一步工作的重点。

