一氧化氮吸入联合高频震荡通气治疗新生儿严重呼吸衰竭的疗效分析
李玲,薛梅
新生儿严重呼吸衰竭(severe respiratory failure,SRF)是新生儿重症监护室(neonatal intensive care unit,NICU)的危急重症,是早期新生儿死亡的首位原因[1]。SRF发生时,由于肺血管持续痉挛,导致通气-灌流失调,一般机械通气和扩张肺血管药物不能有效改善,而高频振荡通气(high-frequency oscillatory ventilation,HFOV)、一氧化氮吸入(inhaled nitric oxide, iNO)等急救新技术的应用具有迅速改善低氧血症的作用,同时还具有调节和抑制肺组织细胞炎症的作用[2]。但临床实践中,单一技术往往效果欠佳,需要多种技术联合应用。本研究观察HFOV联合iNO对新生儿SRF的治疗效果,报告如下。
1 资料与方法
1.1一般资料2013年3月至2016年3月入住泰州市人民医院南院新生儿科SRF患儿60例,日龄(5.93±3.35)h,男/女为34/26,体质量(3.48±0.39)kg,其中新生儿胎粪吸入综合征(MAS)22例,新生儿呼吸窘迫综合征(RDS)38例,入组标准:呼吸机正压通气下,吸入氧浓度(FIO2)>60%,经皮血氧饱和度(TcSO2)<80%;患儿近亲属签署了知情同意书,排除标准:复杂先天性心脏病或严重左心衰、先天性呼吸道及消化道畸形、有出血性疾病及出血倾向、严重贫血、早产儿等。入组病例采取随机数字法分为对照组28例和观察组32例,两组日龄、胎龄、出生体质量、性别、原发病因组成等差异无统计学意义。见表1。本研究通过泰州市人民医院医学伦理委员会批准。
1.2研究方法入住患儿均予STEPHANIE呼吸机,高频震荡通气模式,采取肺保护性通气策略,根据病情设置初调参数,依据临床表现及结合血气分析指导逐步调整参数,初调参数范围:震荡压力15~20 cmH2O,震荡幅度30~40 cmH2O,震荡频率7~12 Hz,吸氧浓度60%~100%。两组均给予常规基础治疗如抗感染、改善循环、保护脏器功能、纠正酸碱失衡及电解质紊乱等。新生儿呼吸窘迫综合征予肺泡表面活性物质应用,气胸予胸腔闭式引流。对照组予单纯HFOV治疗,观察组予iNO联合HFOV治疗。吸入的一氧化氮(NO)气体经专用的质量流量控制仪接入呼吸机供气管道,有专用的浓度监测仪检测管道中的NO、NO2浓度。iNO治疗起始浓度10~15 ppm,吸入1 h如TcSO2上升>10%,氧分压(PaO2)上升>10 mmHg为有效,在氧合改善,TcSO2维持在90%以上时,逐步下调FiO2至60%,调节震荡压力至15 cmH2O,病情好转,TcSO2稳定后,逐步下调iNO浓度1~2 ppm,至iNO浓度5~3 ppm时,撤离iNO。
1.3观察指标动态监测入科即刻、治疗后2 h和24 h后两组的血气分析(pH、PaO2、PaCO2)和呼吸功能指标[动脉氧分压与吸入氧浓度比(PaO2/FiO2)、氧合指数(OI)],并记录机械通气时间、iNO吸入时间、救治成功率及并发症发生率。
1.4统计学方法采用SPSS 22.0软件对所采集数据进行统计学分析;计数资料使用χ2检验,计量资料使用成组t检验,部分指标虽为多时点观测,但因关注重点为组间差异,故未行重复测量分析。P<0.05表示差异有统计学意义。
2 结果
2.1两组动脉血气指标比较开始治疗前两组患儿的动脉血气指标组间比较差异无统计学意义(均P>0.05);治疗2 h后,均出现pH 、PaO2的上升及PaCO2的下降,但仅pH值差异有统计学意义(P=0.040)。24 h后,观察组的血气指标均优于对照组,差异有统计学意义(P<0.05)。见表2。
2.2两组呼吸功能指标比较开始治疗前两组患儿的呼吸指标组间比较差异无统计学意义(P>0.05);治疗2 h后和24 h, 均出现PaO2/ FiO2的上升及OI值的降低,观察组均优于对照组,差异有统计学意义(P<0.05)。见表3。

表1 两组一般情况及治疗后临床转归情况比较
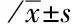
表2 治疗前后患儿动脉血气指标比较
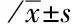
表3 治疗前后患儿呼吸功能指标比较
2.3两组临床转归及并发症情况比较对照组机械通气时间长于观察组,差异有统计学意义(P=0.044);对照组有9例患儿出现死亡,观察组3例患儿死亡,组间比较差异有统计学意义(P=0.028)。见表1。观察组患儿均未见出血征象,出凝血时间检测值均在正常范围,监测NO2在安全范围(<1×106)。监测高铁血红蛋白在安全范围(<3%)。
3 讨论
近年来,随着机械通气尤其是HFOV在NICU的广泛应用,呼吸衰竭患儿的抢救成功率得到极大的提高,但仍有部分SFR患儿,需较高的呼吸机参数如高压力或高吸氧浓度方能维持或勉强维持血氧饱和度在正常范围,影响了新生儿的存活率及预后。分析其原因有:原发病严重,内源性NO分泌减少、肺动脉痉挛致肺动脉高压等[3],因此,部分严重呼吸衰竭患儿采用单纯机械通气治疗效果不佳[4]。谢桂芬等[5]发现新生儿呼吸衰竭和机械通气时其内源性NO代谢物有下降的趋势,证实NO在低氧状态下产生减少,再加上危重患儿常合并酸中毒,使肺小动脉痉挛,并发持续肺动脉高压(PPHN),加重低氧血症,形成恶性循环[6]。
20世纪90年代初iNO作为一种新的呼吸支持技术应用于新生儿[7]。经过20多年来的多中心研究发现,一氧化氮治疗严重呼吸衰竭效果较明显[8]。大量临床报告显示, NO可以选择性扩张肺血管,降低肺动脉压,改善通气/灌流比例失调,改善换气和氧合,而不影响体循环血压、血流。NO的选择作用源自它与血红蛋白内铁离子有很强的亲和力,一旦被吸入,能迅速弥散至肺泡壁周围血管的内皮细胞,穿过细胞膜而到达血管平滑肌,激活鸟苷环化酶产生环磷酸鸟苷,从而抑制钙离子内流,使肺血管舒张;NO一旦进入血液循环,即与血红蛋白结合,活性被灭活,故不影响体循环系统。
NO是血管内皮细胞(VEC) 释放、血管内皮衍生的舒张因子(EDRF)[9]。近年研究表明,NO是EDRF其中最具代表性的活性成分[10]。内源性NO具有调节血管张力、参与炎症反应、提高宿主防御功能、舒张支气管平滑肌、抑制血栓形成、参与神经传递。
本研究中应用iNO联合HFOV,应用于SFR患儿,结果显示iNO早期应用能显著改善患儿氧合指数,使呼吸机参数逐渐下调至安全范围,且合理调整参数后患儿无明显不适,缩短患儿机械通气时间,减少相关并发症,提高呼吸衰竭病人的抢救成功率。同时iNO治疗期间监测NO2浓度及高铁血红蛋白在安全范围,凝血功能无明显异常变化。
对于肺实质疾病引起的严重呼吸衰竭,iNO与高频通气联合应用具有协同作用,其机制是NO到达有通气的肺泡,可使相应的肺血管扩张,缓解肺动脉高压,改善氧合,HFV可募集更多的肺泡,使肺通气达最佳状态,便于NO进入和发挥作用[2]。故iNO联合高频震荡通气治疗模式具有良好的理论基础。两者联合治疗可改善氧合,使较高呼吸机参数尽快下调,减少机械通气时间,减少并发症发生率,提高存活率,且操作相对体外膜肺技术(ECMO)简单、方便,易于大多数NICU病房开展,安全性高,值得推广。

