Urantide对动脉粥样硬化大鼠肝功能及组织形态学的影响*
崔海鹏, 刘 凯, 郭天娇, 孙晓旭, 王 途, 谢亚芹, 李 颖, 苗光新, 赵 娟
(承德医学院病理生理学教研室, 河北 承德 067000)
动脉粥样硬化(atherosclerosis,AS)是一种血脂异常及血管壁成分改变的动脉疾病,是冠心病、脑梗死和外周血管疾病等疾病的主要原因[1]。脂质代谢障碍为AS的病变基础,肝脏被视为脂质代谢的重要场所,而在AS的发生过程中往往伴有肝功能异常[2]。Urantide是在人尾加压素II(urotensin Ⅱ,UII)基础上衍生而来的受体拮抗剂[3-4]。本课题组前期研究发现,urantide可降解胸主动脉壁内的胶原蛋白,抑制UII对胸主动脉的损伤作用[3-5]。然而urantide对AS大鼠肝脏功能的具体作用机制尚不清楚。本研究利用Wistar大鼠建立AS模型作为研究对象,初步探讨了urantide对AS大鼠肝脏的影响,为临床工作中urantide治疗AS以及对肝脏的保护作用提供理论依据。
材 料 和 方 法
1 实验动物
SPF级Wistar雄性大鼠,3周龄,体重180~200 g,购自北京维通利华实验动物技术有限公司,实验动物使用许可证号为SCXK(京)-2016-0011,生产合格证为1140070012720。
2 主要试剂
Urantide由苏州强耀生物公司合成;辛伐他汀(simvastatin,SIM)购于北京诺华制药有限公司;维生素D3(vitamin D3, VD3)购于哈尔滨市华晟科技动物药品厂;胆固醇和胆酸钠购于Sigma;TRIzol裂解液、RIPA裂解液、Bradford蛋白浓度测定试剂盒和超敏ECL化学发光试剂盒购于碧云天生物技术有限公司;TIANScript cDNA第一链合成试剂盒和SuperReal PreMix SYBR Green购于天根生化科技有限公司;UII及其受体GPR14的RT-qPCR引物由大连宝生物工程有限公司合成;兔抗大鼠UII和GPR14抗体购于Santa;兔抗大鼠β-actin抗体和HRP标记山羊抗兔Ⅱ抗购于Bioworlde。
3 主要方法
3.1AS模型复制及分组 Wistar大鼠180只适应性饲养1周[恒定温度(22±2)℃,相对湿度(50±10)%,正常摄食及饮水]后,随机分为2组,即正常对照(normal control,NC)组30只和AS模型(AS)组150只。其中,NC组给予普通饲料,自由饮水;AS组给予高脂饲料,自由饮水,并于造模开始时,连续3 d腹腔注射VD3(150 U·kg-1·d-1),复制大鼠AS模型,实验周期为4周。剪取大鼠胸主动脉,进行血脂成分分析及病理学检测,以判断造模是否成功。以随机数字表法,将AS模型组大鼠随机分为模型(AS)组、阳性药(SIM)组及urantide给药3 d(U3)、7 d(U7)和14 d(U14)组,其中,NC组和AS组每只大鼠连续14 d每天尾静脉注射生理盐水(30 μg/kg),SIM组每只大鼠连续14 d每天灌胃辛伐他汀(5 μg/kg),urantide各组每只大鼠每天尾静脉注射urantide (30 μg/kg),给药周期分别为3、7和14 d。高脂饲料由80.8%基础饲料、3.5%胆固醇、10%猪油、0.2%丙硫氧嘧啶、0.5%胆酸钠和5%白糖配制而成[3-5]。
3.2样本采集 样本采集前各组大鼠禁食12 h,麻醉,胸主动脉取血于采血管,离心15 min(4 ℃、3 000 r/min)分离血清,进行肝功能检测;分别取大鼠胸主动脉和肝脏,生理盐水洗去血迹后,各组随机选取15只用4%多聚甲醛固定,待形态学检测;剩余15只迅速冷冻于液氮,待后续分子生物学检查。
3.3大鼠肝功能检测 全自动生化分析仪检测大鼠血清中丙氨酸转氨酶(alanine aminotransferase,ALT)、天冬氨酸转氨酶(aspartate aminotransferase, AST)、γ-谷氨酰转移酶(γ-glutamyltransferase, γ-GT)、乳酸脱氢酶(lactate dehydrogenase, LDH)、总胆红素(total bilirubin, TBIL)、直接胆红素(direct bilirubin, DBIL)、间接胆红素(indirect bilirubin, IBIL)、碱性磷酸酶(alkalin phosphatase, ALP)、总蛋白(total protein, TP)、球蛋白(globulin, GLB)和白蛋白(albumin, ALB)的含量。
3.4大鼠胸主动脉和肝脏的组织形态学观察 将固定好的大鼠胸主动脉和肝脏组织经脱水、透明、浸蜡、包埋后制备成石蜡切片,经二甲苯脱蜡、梯度乙醇水化后,常规HE染色后光镜下拍照观察病理学变化。
3.5RT-qPCR法检测大鼠肝脏UII与GPR14的mRNA表达 TRIzol法提取肝脏组织总RNA,紫外分光光度计进行定量,逆转录试剂盒合成cDNA,荧光定量检测试剂盒分别检测UII、GPR14和β-actin mRNA的Ct值,引物序列见表1。扩增条件:94 ℃ 5 min;94 ℃ 30 s,60 ℃ 34 s,40个循环;做熔解曲线。以各基因Ct值与β-actin Ct值的差值为ΔCt,采用2-ΔΔCt法计算各基因mRNA的相对表达水平。

表1 RT-qPCR的引物序列
3.6Western blot法检测大鼠肝脏UII与GPR14 的蛋白表达 RIPA裂解液提取肝组织样本的总蛋白,Bradford蛋白浓度测定试剂盒进行蛋白定量。45 μg蛋白于SDS-PAGE 12%分离胶分离并转膜,常温封闭1 h,加入UII(1 ∶200)、GPR14(1∶100)和β-actin(1∶10 000)兔抗大鼠Ⅰ抗,4 ℃孵育过夜,洗膜后,加入HRP标记山羊抗兔Ⅱ抗(1∶5 000),常温孵育l h,洗膜后用超敏ECL化学发光试剂盒显影。各蛋白条带灰度值与β-actin条带灰度值的比值为各蛋白的相对表达水平。
4 统计学处理
用SPSS 21.0统计软件进行分析。数据均采用均数±标准差(mean±SD)表示,多组间比较采用单因素方差分析(one-way ANOVA)。以P<0.05为差异有统计学意义。
结 果
1 Urantide对各组大鼠ALT、AST、γ-GT及LDH的影响
与NC组相比,AS组大鼠血清中ALT、AST、γ-GT和LDH水平显著升高(P<0.05);urantide各治疗组大鼠上述各项指标较AS组均显著降低(P<0.05),其中U7组中ALT、AST和γ-GT水平最接近于SIM组,见表2。

表2 Urantide对各组大鼠ALT、AST、γ-GT及LDH的影响
*P<0.05vsNG group;△P<0.05vsAS group.
2 Urantide对各组大鼠TBIL、DBIL、IBIL及ALP的影响
与NC组相比,AS组大鼠血清中TBIL、IBIL和ALP水平显著升高(P<0.05);urantide各治疗组大鼠上述各项指标较AS组均呈显著降低趋势(P<0.05),其中TBIL和IBIL水平随给药时间呈逐渐降低趋势,U3和U7组ALP水平接近于NC组。各组血清中DBIL水平均无显著变化,见表3。

表3 Urantide对各组大鼠TBIL、DBIL、IBIL及ALP的影响
*P<0.05vsNC group;△P<0.05vsAS group.
3 Urantide对各组大鼠TP、GLB及ALB的影响
Urantide对各组大鼠血清中TP、GLB和ALB水平均无显著影响,差异无统计学意义,见表4。
4 AS大鼠胸主动脉的组织结构改变
表4Urantide对各组大鼠TP、GLB及ALB的影响
Table 4.The effect of urantide on TP, GLB and ALB in the rats of each group (g/L. Mean±SD.n=10)

GroupTPGLBALBNC61.14±4.6725.75±2.1535.38±2.80AS55.42±8.9725.40±5.4830.02±3.80SIM60.77±7.8427.01±4.7333.76±3.43U352.57±3.9924.68±2.4327.84±2.11U759.79±3.1224.88±11.8734.91±1.53U1456.31±5.6726.64±3.7629.67±2.43
HE染色结果显示,实验第6周,NC组大鼠胸主动脉内皮细胞完整,中膜平滑肌细胞排列整齐,且外弹力纤维层结构清晰,呈环形排列,外膜由疏松结缔组织构成,内膜、中膜、外膜分界清晰完整;AS组大鼠胸主动脉内皮细胞破坏,出现明显的钙化,中膜平滑肌细胞增殖、萎缩,弹力纤维断裂,为典型AS病理变化,表明AS模型建立成功,见图1。
5 Urantide对各组大鼠肝组织形态学的影响
HE染色结果显示,NC组大鼠肝组织结构完整、清晰,肝小叶结构正常,肝细胞形态正常,肝索排列均匀规则,无坏死、脂肪变性;AS组大鼠肝小叶变形,界限不清晰,肝索排列紊乱,肝细胞肿胀变形,大小不均匀,可见局部坏死,细胞质中见大小不等的空泡,为脂滴,部分细胞核偏向细胞一侧,为典型的肝细胞脂肪变性;SIM组肝小叶结构清晰,肝细胞形态基本正常,大小基本均匀,肝索排列尚可;U3组肝小叶少有变形,肝细胞形态偶有变形,细胞质中空泡减少,脂肪变性程度减轻;U7与U14组肝小叶结构基本正常,细胞形态基本趋于CG组,见图2。

Figure 1.Morphological changes of thoracic aorta in atherosclerotic (AS) rats (HE staining, ×400). Arrows 1: vascular tunica externa; 2: vascular tunica media; 3: vascular tunica intima; 4: elastic fibers; 5: broken elastic fibers in vascular tunica media in atherosclerotic state; 6: calcification in atherosclerotic state.
图1AS大鼠胸主动脉的组织结构
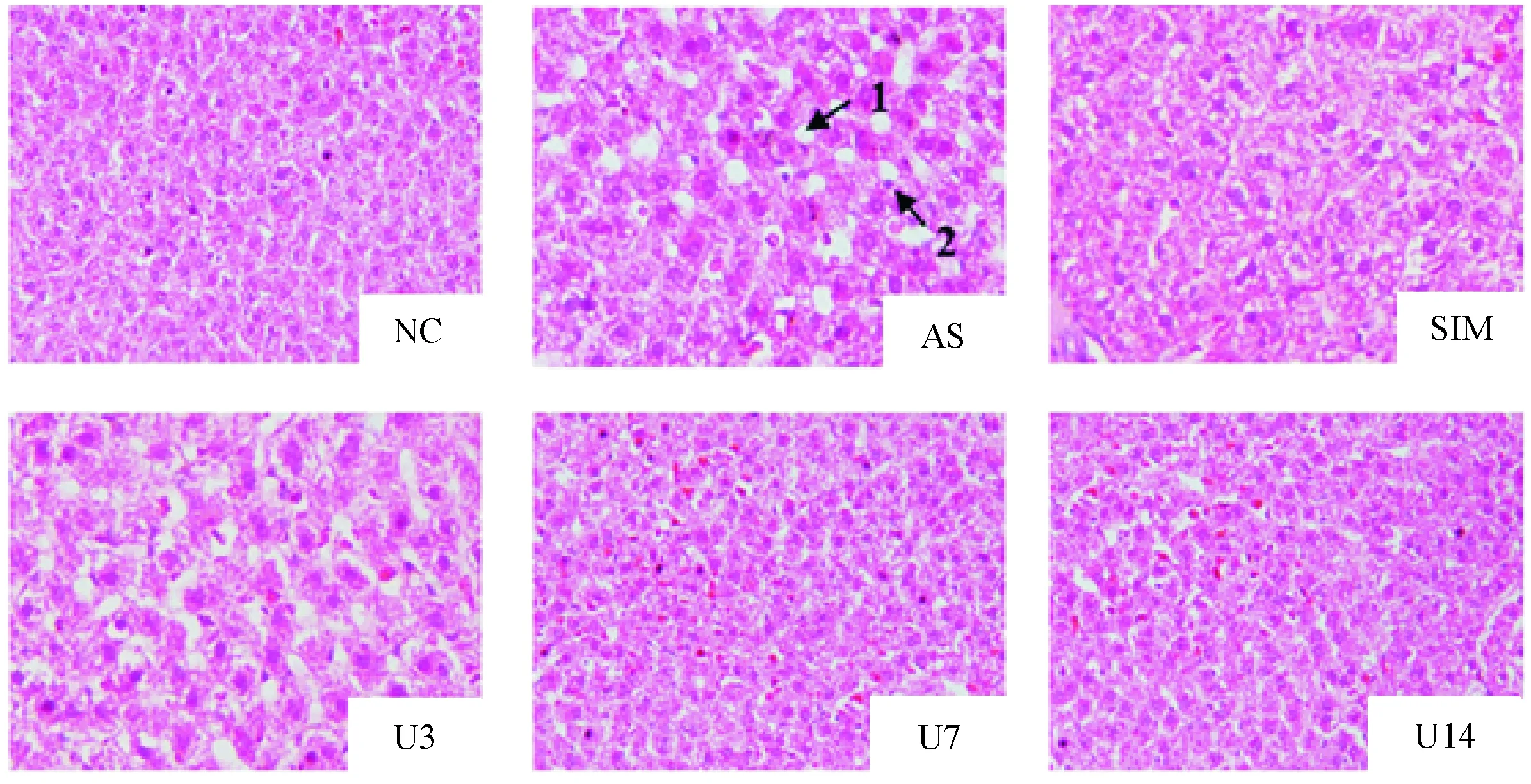
Figure 2.The effect of urantide on liver tissues in the rats of each group (HE staining, ×200). Arrows 1: steatosis in hepatocyte; 2: hepatocyte nuclear deviation.
图2Urantide对各组大鼠肝组织形态学改变的影响
6 Urantide对各组大鼠肝脏UII和GPR14 mRNA及蛋白表达的影响
与NC组相比,AS组大鼠肝脏中UII和GPR14 mRNA及蛋白表达显著升高(P<0.05);与AS组相比,urantide各给药组大鼠肝脏中UII及GPR14 mRNA表达显著降低(P<0.05),并且接近于NC组,随给药时间呈逐渐降低趋势,见图3A;urantide各给药组大鼠肝脏中GPR14蛋白表达较AS组均显著降低(P<0.05);而U3组UII蛋白表达较AS组显著升高(P<0.05),U7和U14组UII蛋白表达较AS组显著降低(P<0.05),见图3B。

Figure 3.The mRNA and protein expression of UII and GPR14 in the liver tissues. A: the mRNA expression of UII and GPR14 was detected by RT-qPCR; B: the protein expression of UII and GPR14 was detected by Western blot. Mean±SD.n=10.*P<0.05vsNC group;△P<0.05vsAS group.
图3大鼠肝脏UII和GPR14mRNA及蛋白表达的变化
讨 论
目前研究表明,高脂饮食可增加血液中游离脂肪酸水平,从而显著增加肝脏中甘油三酯的合成,肝脏负荷过重,可导致肝功能受损[6-7]。有研究发现肝细胞脂肪变性及其伴随的肝脏坏死性炎症对AS有促进作用,脂肪肝成为AS形成的危险性因素[8];同时,AS发生时,常常伴有血脂升高,肝脏脂质代谢功能降低,以及肝功能异常。据此,本实验通过饲喂大鼠高脂饲料联合给予VD3的方法建立AS模型,高脂饮食大大加重了大鼠肝脏负荷。本研究中,肝功能检测显示,AS组大鼠血清中ALT、AST、γ-GT、LDH、TBIL、IBIL及ALP水平较CG组显著升高,而TP、GLB和ALB无显著变化,表明大鼠在发生AS时伴有肝细胞实质性损伤以及肝脏排泄功能障碍,对肝脏本身合成功能无显著影响。病理学检测结果显示,AS组大鼠肝细胞肿胀变形,胞质内形成大量脂滴,发生严重的脂肪变性。以上结果表明,肝细胞受损可导致大鼠脂质代谢紊乱,对加重AS的发生发展起到关键作用。
AS的发生是多因素相互作用的复杂的病理生理过程。UII作为一种生长抑素样环肽被视为促进AS发生发展的主要发病机制之一[9]。UII可与其特异性受体GPR14相结合而构成UII/UT 系统进入细胞中发挥生物学效应,如促进血管收缩和炎症反应等[9-10]。有文献报道,在人AS斑块、血管平滑肌细胞和巨噬细胞中有大量的UII及其受体GPR14表达[11]。本研究发现,UII及其受体GPR14在AS大鼠肝脏中也大量表达,UII/GPR14在AS大鼠肝脏脂质代谢紊乱中可能发挥关键生物学作用。
他汀类药物作为目前最有效的降脂类药物可有效地预防AS和血栓的形成[12-13],本研究采用辛伐他汀作为阳性药物,用于评价实验用药对AS大鼠的治疗作用,实验结果显示,辛伐他汀对AS大鼠的肝脂肪变性治疗效果显著,辛伐他汀可通过降低AS大鼠血脂水平起到保护肝脏的作用。然而有研究表明,长时间服用他汀类药物可导致血液中转氨酶异常升高,尤其多发于肝功能不全患者[14]。本研究中辛伐他汀因给药时间相对较短,不足以诱发大鼠自身肝脏的损伤,而长期服用辛伐他汀对AS大鼠的肝脏影响有待进一步研究。
随着生物技术与多肽合成技术的日臻成熟,多肽类药物因适应广、安全性高且疗效显著已被广泛应用于肿瘤、肝炎和糖尿病等疾病的预防、诊断和治疗。Urantide目前被认为是最有效的多肽类UII受体拮抗剂[3-4, 10],本课题组前期研究发现,urantide可阻断UII与其受体GPR14结合抑制炎症反应,保护大鼠胸主动脉,起到治疗AS的作用[3, 5]。但urantide对AS大鼠肝脏具体作用尚不清楚。本实验采用尾静脉注射urantide对AS大鼠分别给予3 d、7 d和14 d治疗。实验结果显示,urantide显著降低了AS大鼠血清中ALT、AST、γ-GT、LDH、TBIL、IBIL及ALP水平,同时urantide可明显改善AS大鼠肝脏脂肪变性,减轻肝细胞损伤,说明urantide对AS大鼠肝脏具有一定的保护作用。
根据以上研究结果,我们推测其作用机制可能是由于urantide通过抑制AS大鼠肝脏中UII与其受体GPR14结合进而起到对肝细胞的保护作用。实验结果显示,随着urantide给药时间的延长,AS组大鼠肝脏中UII和GPR14的mRNA及蛋白表达水平显著降低。由此,证实了我们的假设,urantide通过抑制大鼠肝脏中UII及其受体GPR14的表达,导致GPR14无法进入细胞发挥生物学作用,进而抑制炎症反应发生,减轻肝功能的损伤,缓解大鼠的肝脂肪病变,脂质代谢得以恢复,有效地缓解大鼠的AS病变。而其具体作用机制有待于进一步证实。
总之,urantide在治疗大鼠AS的同时,本研究进一步发现,urantide对AS大鼠的非酒精性脂肪肝病变具有明显的修复作用。为临床应用urantide治疗AS及其并发症非酒精性脂肪肝提供数据支持。

