大鼠哺乳期环境烟草烟雾暴露对实验性自身免疫性脑脊髓炎发病的远期影响
厉莎 王赵伟 吴承龙
多发性硬化(multiple sclerosis,MS)是一种以中枢神经系统(CNS)炎性脱髓鞘为主要病理特点的自身免疫性疾病,其病理学特点包括中枢髓鞘脱失、炎性细胞浸润以及轴突变性。研究表明遗传及环境因素共同参与疾病的发生发展,主要环境影响因素包括吸烟、感染、饮食、地区和出生季节等[1]。其中吸烟和MS的发病非常密切[2-4],MS患者吸烟会增加疾病的复发概率,加重病情[5-6]。目前其具体机制还不明确,可能为:(1)免疫调节作用:尼古丁能破坏血-脑脊液屏障,诱导CNS释放一氧化氮(NO),产生免疫抑制作用,促使轴突变性。(2)神经毒性作用:氰化物可直接造成CNS脱髓鞘[7]。随吸烟时间延长或者数量增加,患MS的风险明显增加,戒烟被认为是最有可能实现早期预防疾病发生的可控制性危险因素[5],但哺乳期环境烟草烟雾(environmental tobacco smoking,ETS)暴露对MS的远期影响目前还不明确。目前实验性自身免疫性脑脊髓炎(experimental auto immune encephalomyelitis,EAE)小鼠是研究MS最经典的动物模型[8],其具有与MS相似的神经功能缺损表现和发病机制。本实验通过对新生的SD乳鼠进行ETS暴露,在大鼠成年后(大鼠出生后2个月左右为其成年期)进行EAE造模,探讨幼年期ETS暴露对EAE发病的远期影响,为早期预防MS的发病提供依据。
1 材料和方法
1.1实验动物孕鼠购自上海斯莱克实验动物有限公司,其中出生SD乳鼠36只,雌雄不限。将36只出生2 d的SD乳鼠随机分成烟草暴露(ETS)组和空气组,再将ETS组和空气组再随机分为EAE模型组和假手术组,最终分为ETS-EAE组(n=12),ETS-假手术组(n=6),空气-EAE组(n=12),空气-假手术组(n=6)。另取体重为200~250 g的豚鼠数只,用于制备EAE造模所需脊髓匀浆。
1.2主要试剂与仪器完全福氏佐剂(complete Freund’s adjuvant,CFA)购于美国Sigma-Aldrich公司,苏木素-伊红(Hematoxylin-Eosin,HE)染色液、固蓝髓鞘染色液(LFB)试剂盒均购于武汉赛尔维生物有限公司,γ干扰素(IFN-γ)Elisa试剂盒购自上海安迪生物科技有限公司。
1.3方法
1.3.1乳鼠ETS暴露:ETS组乳鼠连同母鼠置于烟箱中,每天8:00~9:00、20:00~21:00进行2次ETS暴露,每次暴露1 h;空气组乳鼠以相同方式置于仅含空气的箱中。总暴露时间为乳鼠出生后2~21 d。于出生第21天统一断乳并与母鼠分笼,饲养至成年期(11周)。
1.3.2EAE大鼠造模:于SD大鼠出生后11周采用经典的EAE模型建立方法[9]进行造模。使用乙醚麻醉豚鼠后用无菌生理盐水灌注左心室,处死豚鼠,剥离脊髓后按质量1∶1加入无菌生理盐水,使用玻璃匀浆器进行匀浆。将豚鼠脊髓匀浆液与CFA等体积混合后,反复抽打形成油包水乳剂,给予SD大鼠四肢足垫皮下注射0.5 mL所制备的油包水乳剂1次。假手术组以相同方式注射等量无菌生理盐水。根据行为学评分标准评分,≥2分即为发病动物,表示造模成功[10]。
1.3.3神经系统症状行为学评分:根据Kono等[11]评分标准进行评分。无明显异常=0分;尾巴无力=1分;轻微后肢无力=2分;严重后肢麻痹=3分;四肢麻痹=4分;濒死或死亡=5分。造模当天记为第0天,第1~20天每天早晨8:00和晚上20:00各评分一次,每天2次评分的平均值为当天最终评分值,同时计算造模后第1~20天神经系统症状行为评分的累积评分。
1.3.4血浆IFN-γ检测:于EAE造模后第10、15、20天分别采集大鼠尾静脉血,采用Elisa方法检测血浆IFN-γ水平,操作步骤按Elisa试剂盒说明书进行。
1.3.5SD大鼠病理学观察:于EAE造模后第20天处死大鼠,剥离大鼠脑、脊髓后放入多聚甲醛中固定24 h以上,梯度酒精脱水,石蜡包埋、切片,切片厚度为5 μm。(1)HE染色:将切片进行脱蜡、脱水、苏木素染色、伊红复红、酒精脱水、二甲苯透明、中性树胶固封后置光学显微镜下镜检,观察脑、脊髓炎性反应严重程度。随机选取3张切片进行HE染色评分,取平均值。按下列标准进行评分:无炎性反应改变=0分;炎性细胞浸润仅限于血管周围和脊膜周围=1分;脊髓内轻度的炎性细胞浸润(1~10个细胞/片子)=2分;脊髓内中度炎性细胞浸润(11~100个细胞/片子)=3分;脊髓内重度炎性细胞浸润(>100个细胞/片子)=4分。(2)LFB染色:将切片标本脱蜡、脱水,于LFB液中60℃条件下染色2~4 h,经70%(体积分数)乙醇溶液分化数秒,碳酸锂溶液继续分化数秒,流水冲洗1 min,反复进行分色后,梯度酒精脱水、二甲苯透明、中性树胶固封后置光学显微镜下镜检,随机选取3张切片定性分析大鼠脱髓鞘情况。
1.4统计学处理采用SPSS19统计学软件进行分析,对数据进行方差齐性和正态性检验,符合正态分布的计量资料以均数±标准差表示,两组间比较采用t检验,多组均数间比较先采用方差分析,两两比较采用Sidak法;计数资料采用卡方检验。取α=0.05。
2 结果
2.1神经系统症状行为学评分: ETS-假手术组、空气-假手术组均未出现神经系统行为学症状,而ETS-EAE组、空气-EAE组大鼠在出现神经系统症状之前已有食欲下降,体重减轻,活动减少,小便失禁等现象,两组分别最早于术后第9、10天开始有大鼠出现尾部上翘困难、后肢无力、趾面向上、步履蹒跚、行走时后肢拖拉等症状,最严重者为四肢瘫痪、濒临死亡。ETS-EAE组与空气-EAE组相比,大鼠出现的症状更为严重,且发病潜伏期短(均P<0.05),发病率更高但差异无统计学意义(P>0.05)。具体结果见表1。
2.2HE染色评分空气-假手术组和ETS-假手术组HE评分均为0分,ETS-EAE组平均HE评分与空气-EAE组比较升高(P<0.05,表1)。ETS-EAE组可见大量炎性细胞聚集围绕静脉形成“血管袖套”,炎性细胞以单核细胞为主,细胞体积变大,细胞核偏位,核仁消失;空气-EAE组可见中等量单核细胞围绕静脉形成“小血管袖套”;而空气-假手术组和ETS-假手术组仅可见少量单核细胞。结果见图1。
2.3LFB染色ETS-EAE组CNS脱髓鞘程度较空气-EAE组更明显,脱髓鞘区可见大量单核细胞聚集。ETS-假手术组和空气-假手术组均未见明显脱髓鞘改变。结果见图2。
2.4血浆IFN-γ水平ETS-EAE组大鼠血浆IFN-γ在第10、15、20天均明显高于ETS-假手术组,ETS-EAE组第15天血浆IFN-γ水平明显高于空气-EAE组(P<0.05)。结果见表2。
3 讨论
MS主要临床特点为病灶的空间多发性和时间多发性,多在青年时期起病,以急性和亚急性起病为主,亚洲人以视神经和脊髓受累最多见,神经功能缺损也更严重。该疾病具有致残率高、预后差、较易复发等特点[12]。MS可造成生活质量下降等严重不良结局,且目前仍无特效药抑制疾病复发[13],给个人、家庭甚至整个社会带来沉重的医疗负担。

表1 各组大鼠EAE发病情况及HE染色评分比较
注:EAE:实验性自身免疫性脑脊髓炎,ETS:环境烟草烟雾;图1~2、表2同。a指神经系统症状行为学评分;与空气-EAE组比较,bP<0.01,cP<0.05
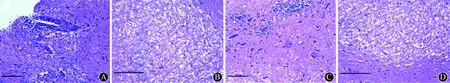
注:A:ETS-EAE组可见大量单核细胞聚集围绕静脉形成“血管袖套”;B:ETS-假手术组可见少量单核细胞散在分布;C:空气-EAE组可见中等量单核细胞围绕静脉形成“小血管袖套”;D:空气-假手术组可见少量单核细胞散在分布 图1 各组大鼠脊髓组织HE染色比较(比例尺=50 μm)
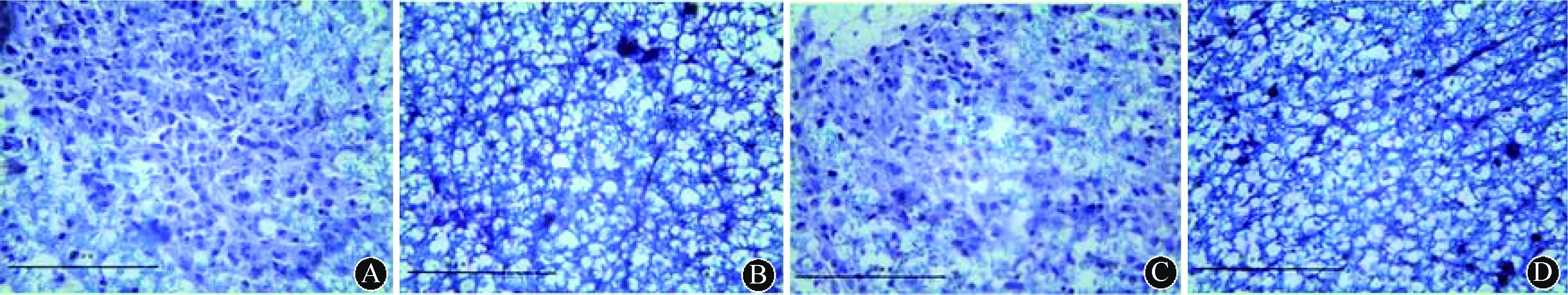
注:A:ETS-EAE组可见脊髓大片髓鞘脱失;B:ETS-假手术组未见明显髓鞘脱失;C:空气-EAE组可见脊髓少量髓鞘脱失;D: 空气-假手术组未见明显髓鞘脱失 图2 各组大鼠脊髓脱髓鞘程度比较(LFB染色,比例尺=50 μm)
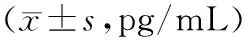
表2 各组大鼠造模后不同时间血浆IFN-γ水平比较
注:IFN-γ:干扰素γ;与空气-EAE组比较,aP<0.05;与ETS-假手术组比较,bP<0.05
本研究通过对出生后第2~21天的SD乳鼠进行ETS暴露,于成年期进行EAE造模,结果显示,ETS-EAE组大鼠在神经系统行为学上可出现不同程度的行为缺失,且出现时间早,行为学评分更高,提示大鼠在幼年期ETS暴露会增加EAE远期发病风险,并会加重病情;病理学检查发现,与其他组比较,ETS-EAE组脊髓中有更多的单核细胞出现,且可见脊髓大片髓鞘脱失。结合既往有关EAE模型的研究结论,提示烟草烟雾可能是通过免疫调节的方式诱导炎性反应细胞生成,炎性反应细胞可通过释放一系列的炎性反应因子促使CNS髓鞘大片脱失,最终促使大鼠发生EAE。这与本研究所显示的ETS-EAE组大鼠脊髓存在大量炎性反应细胞浸润结果一致。
MS的发病机制虽尚未完全阐述清楚,但其主要机制为炎性反应所致的机体免疫系统失平衡,氧化应激和炎性反应是导致MS的关键性因素,其免疫学机制主要可概括为[14]:碱性髓鞘蛋白(MBP)被抗原提呈细胞(APC)摄取加工,将抗原递呈给淋巴细胞,淋巴细胞分化成各类免疫细胞,继而破坏CNS,释放大量炎性介质,最终导致髓鞘脱失甚至轴突损伤。Genain等通过研究复发型-EAE模型时发现自身抗体主要攻击MBP和髓鞘少突胶质细胞糖蛋白(MOG)[15],在MS患者血清中,MBP和MOG升高也印证了上述观点[16]。在MS的发病过程中,脱髓鞘部位出现大量的炎性反应细胞,血管周围炎性反应细胞浸润导致中枢髓鞘破坏[17]。这与本研究显示的EAE大鼠脊髓中可见淋巴细胞在静脉周围形成“血管袖套”的结果相符。在CNS脱髓鞘过程中的炎性反应细胞主要为T淋巴细胞,其中以CD4+T细胞为主导,CD4+T细胞可分为Th1和Th2两种亚型,Th1细胞产生IFN-γ、肿瘤坏死因子α(TNF-α)、淋巴毒素α(LT-α)、白细胞介素-6(IL-6)等,介导Ⅳ型超敏反应,引起特异性自身免疫性组织损伤(如EAE和MS等);Th2细胞主要作用是诱导和促进体液免疫应答,产生IL-4、IL-5、IL-10、IL-13等炎性反应因子,引起特异性组织损伤,但Th2型反应对EAE和MS的病情有抑制作用[18]。Nicholas等[19]通过研究大量MS病例后发现,当Th1/Th2比例降低时能够减轻MS患者的炎性反应,减轻临床症状。
IFN-γ是一种有生物活性的糖蛋白,由自然杀伤细胞和活化T淋巴细胞分泌,有诱导炎性反应和免疫调节的作用。因为IFN-γ是Th1型细胞因子,可促进Th0细胞向Th1细胞分化,抑制Th2细胞增殖,通过正反馈机制激活周围的Th1细胞分泌炎性因子,使Th1细胞和Th2细胞之间的比例失衡,通过免疫反应直接或间接损害CNS,从而介导MS发病[20]。既往研究表明,抑制IFN-γ分泌则能大幅度降低EAE的发病风险,减轻临床表现[21-22]。本研究结果显示ETS-EAE组大鼠血浆IFN-γ水平明显高于其他组,该组大鼠的发病潜伏期短,临床表现也较其他组严重,提示幼年期ETS暴露可增加血浆IFN-γ水平,继而导致机体Th1/Th2细胞之间的比例平衡破坏,增加了EAE远期发病风险,加重病情,但ETS如何降低Th1细胞IFN-γ水平的表达还需进一步研究。
综上所述,本研究结果显示,尽管空气-EAE组和ETS-EAE组的发病率无统计学差异,但ETS-EAE组发病率较空气-EAE组稍高,且ETS-EAE组大鼠在神经系统行为学表现上更加严重,初步提示幼年期ETS暴露可增加EAE远期的发病风险及临床症状。我国是全球最大烟草生产国与消费国,目前ETS暴露人群达7.4亿,幼年儿童仍然是公共场所ETS暴露的主要危害群体[23],而临床上暂无治疗MS的特效药,因此明确幼年期ETS暴露与MS的关系具有重要现实意义。由于本文样本量较小,有关ETS暴露与MS远期发病的确切关系尚需进一步研究。另外,目前有关ETS暴露对MS的影响研究大多是对已发病个体的研究,今后如能进行前瞻性队列研究将更能明确两者的关系。

