缺牙对幼年大鼠海马CA1区神经元凋亡及casepase-3蛋白表达的研究
李伯琦 陈 宾 孙大磊 刘奕杉
基础实验和临床研究都有证据表明:咬合支持丧失可能会造成大脑认知功能损害,是阿尔茨海默病发病危险因素之一[1]。然而牙齿缺失是否同样影响青少年大脑学习记忆功能?海马是学习记忆的重要部位。对海马的损伤研究有助于探究外来因素对中枢以及学习记忆功能的影响[2,3]。咬合支持丧失后,牙齿咬合的咀嚼刺激减少,导致脑部血流降低,脑组织活化程度可能受到影响,继而使脑神经细胞受到多种损伤,如细胞调亡、细胞氧化应激及炎症等[4]。海马是脑组织中重要中枢部位之一,其主要作用是情感、行为能力和学习记忆等。海马结构与大脑皮质及皮质下中枢有广泛的纤维联系,空间辨别性学习和记忆以及认知行为活动主要由海马CA1区参与[5,6]。本研究以不同缺牙数目幼年大鼠为研究对象,缺牙4周后观察其海马CA1区神经元细胞结构的变化及天冬氨酸特异性半胱氨酸蛋白酶-3(casepase-3)表达情况,初步探讨缺牙对幼年大鼠海马CA1区神经细胞改变及其细胞凋亡可能存在的机制。
资料和方法
1.实验动物、试剂及仪器
健康4~5周龄SD大鼠50只,雄性,体重80~100g,新疆医科大学动物实验中心提供,动物伦理审查批号(IACUC20150709-05)。实验大鼠室内22-24℃笼内饲养,自由进食水。
TUNEL-POD试剂盒(Roche公司,德国);一抗,Anti-active+pro Casepase-3多克隆抗体(abcam艾博抗贸易有限公司,英国);二抗:山羊抗兔IgG、DAB显色试剂盒(北京中杉金桥生物科技有限公司)注射水合氯醛(新疆医科大学动物实验室提供);生物组织自动包埋机、光学显微镜、石蜡切片机、显微采片机(莱卡公司,德国)。
2.动物的分组
50只SD大鼠随机分为5组:即对照组(A组)、3颗磨牙缺失组(B组)、6颗磨牙缺失组(C组)、9颗磨牙缺失组(D组)、12颗磨牙缺失组(E组),每组10只。
3.动物模型建立
大鼠进入实验室适应性饲养一周,除对照组大鼠外,其余大鼠水合氯醛(35mg/kg)腹腔注射麻醉,固定,按照分组,分别拔除大鼠右侧上颌磨牙(3颗磨牙缺失组)、右侧上下颌磨牙(6颗磨牙缺失组)、右侧上下颌及左侧上颌磨牙(9颗磨牙缺失组)、右侧上下颌及左侧上下颌磨牙(12颗磨牙缺失组),压迫止血,空白对照组只0.9%生理盐水腹腔注射。术后,实验大鼠常规颗粒饲料喂养,自由饮水,密切观察大鼠一般情况并监测体重。
术后第4周,所有大鼠在麻醉下断头处死,迅速剥离脑组织并分离出海马组织。海马标本在4%,0.1mol/L,PH=7.4多聚甲醛磷酸缓冲液中固定24小时后,常规石蜡包埋后进行连续冠状切片,厚4μm。海马典型位置定位,参照《大鼠脑立体定位图谱》。
4.测试指标和方法
(1)HE染色后观察大鼠海马区神经细胞改变及细胞凋亡情况从各组中随机抽取6只大鼠的海马组织切片,每只大鼠取5张连续切片放置于载玻片上进行HE染色,电子显微镜下观察大鼠海马组织CA1区细胞形态变化和细胞排列的改变。
(2)免疫组化:从每组大鼠抽取6只海马组织切片,采用SP法(过氧化酶标记的链酶卵白素)检测激活的casepase-3蛋白的表达,每只大鼠取5张切片进行高压修复抗原,3% H2O2灭活内源性过氧化物酶,1∶100的兔抗鼠casepase-3一抗4℃孵育过夜,山羊抗兔IgG(二抗)37℃孵育25分钟,二氨基联苯胺显色试剂盒(DAB)显色2分钟后苏木素复染,梯度酒精脱水,透明及中性树胶封片。空白对照则用PBS缓冲液代替一抗,其余操作步骤相同。
每个样本取3张切片,每张切片选择5个高倍视野(×400),在光学显微镜下观察海马CA1区神经元细胞,以胞膜及胞质内出现鲜亮棕黄色颗粒计为阳性细胞,记录每个高倍视野下的阳性细胞数并计算平均值,以此作为该组大鼠阳性细胞数的最终数值进行统计分析。
(3)大鼠海马CA1区神经元凋亡检测:研究使用TUNEL(原位末端标记)细胞凋亡试剂盒检测大鼠海马CA1区神经元细胞凋亡。实验操作步骤如下:大鼠海马组织石蜡切片常规脱蜡、梯度脱水,PH=7.4的蛋白酶K(20mg/L溶于Tris/HCL中)室温孵育15分钟,PBS液清洗5分钟×2次;滴加50μl的TUNEL反应混合溶液,在37℃避光湿盒中孵育60分钟;PBS液清洗5分钟×3次;酒精梯度脱水、二甲苯透明、中性树胶封片、光学显微镜下观察检测。TUNEL阳性细胞为凋亡的神经元,光镜下该阳性细胞表现为胞核着染为棕黄色或棕褐色,胞核深度染色固缩,核内染色质位于核周集中,呈环形或新月形块状浓聚,甚至出现核碎片;正常非凋亡细胞表现为胞核被苏木素染成蓝色,核大小,形态相对一致。各组中每只大鼠取3张切片,每张切片光学显微镜下(×400)选择5个视野,采用Image-Pro Plus软件记录每个视野下凋亡细胞数,计算其平均值作为该大鼠海马CA1区的阳性细胞数值。
5.统计学分析
本研究采用SPSS21.0统计软件进行统计分析,计量资料以均数±标准差(±s)表示,多组间比较应用单因素方差分析,多组间两两比较采用LSD检验(方差齐性)和Tamhane’s T2检验(方差不齐),以P<0.05为差异具有统计学意义。
结 果
1.各组大鼠海马CA1区的组织学变化(具体见图1)
HE染色结果显示,缺牙4周后,随着缺牙数目增加,大鼠海马组织CA1区细胞呈现显著不同:A组神经细胞呈蓝紫色,染色均匀,细胞膜完整,细胞结构清楚,胞核大而圆,细胞排列5~8层,呈显著带状分布,未见神经元细胞变性、水肿及坏死。B组细胞组织形态与A组相比,细胞结构无明显改变;C组细胞出现胞膜不完整,部分细胞出现空泡状,细胞核固缩,细胞层数的减少及细胞排列的紊乱;D、E组出现细胞核碎裂,细胞层数减少以及细胞排列稀疏、紊乱加剧。

图1 各组大鼠海马CA1区组织结构的变化(HE×400)
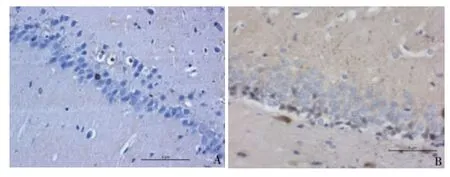

图2 大鼠海马CA1区casepase-3表达情况(×400)
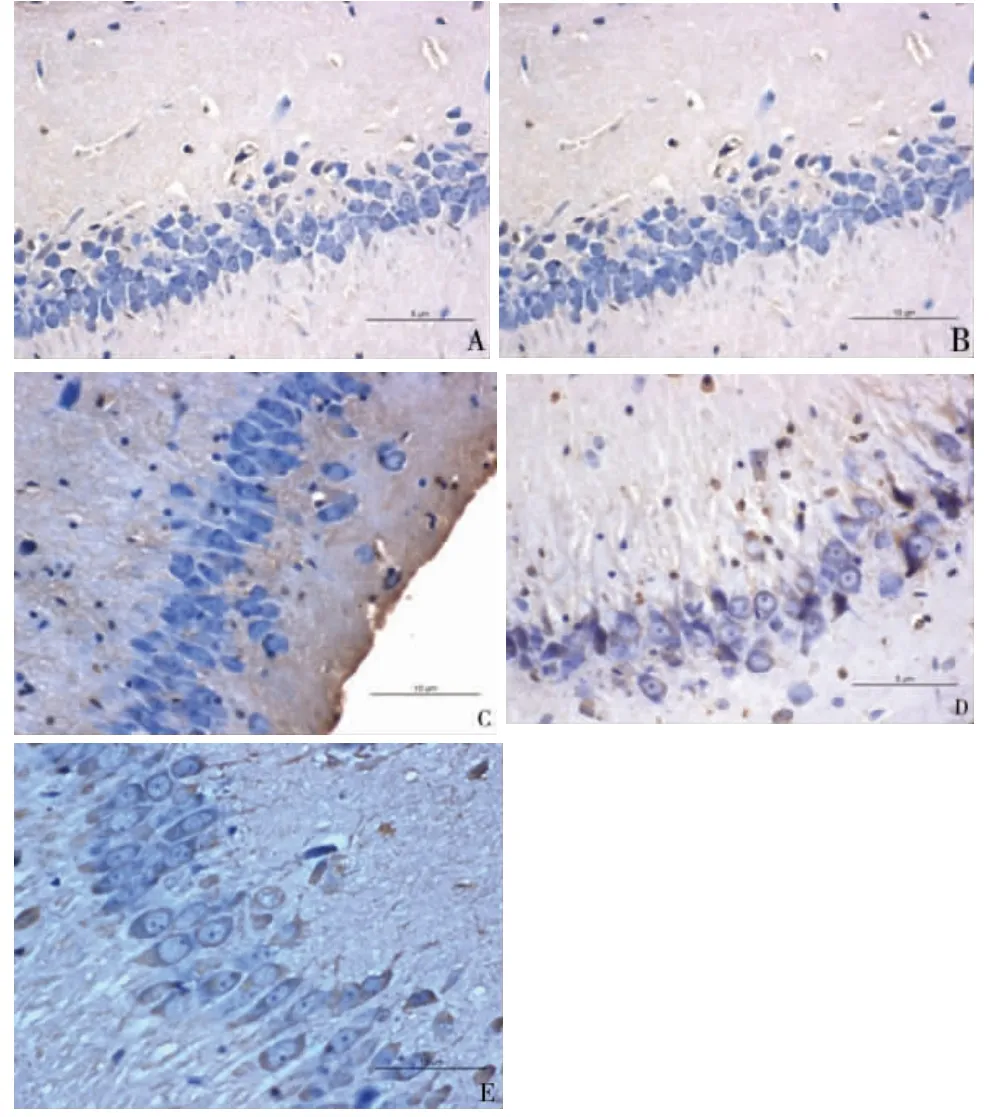
图3 大鼠海马CA1区神经元细胞凋亡的变化,TUNEL染色(×400)
表1 各组casepase-3阳性细胞数及TUNEL阳性细胞数的表达情况(±s)

表1 各组casepase-3阳性细胞数及TUNEL阳性细胞数的表达情况(±s)
?
2.各组大鼠海马CA1区casepase-3表达及细胞凋亡的变化(具体见图2,图3,表1)
统计描述结果显示,缺牙4周后,随着磨牙缺失个数的增加,大鼠海马CA1区casepase-3阳性细胞数和TUNEL阳性细胞数呈增加趋势,磨牙缺失12颗组(E组)的casepase-3阳性细胞数和TUNEL阳性细胞数均最高,分别为10.73±0.47和11.77±0.79。用单因素方差分析分别对各组casepase-3阳性细胞数和TUNEL阳性细胞数进行比较,结果显示:不同组别在casepase-3阳性细胞数(F=183.55,P<0.01)和TUNEL阳性细胞数(F=113.72,P<0.01)的比较上均有差异。进一步对各组进行两两比较,结果显示:空白组(A组)和磨牙缺失3颗组(B组)在casepase-3阳性细胞数(P=0.109)和TUNEL阳性细胞数(P=0.432)的比较上差异无统计学意义,其他任意两组casepase-3阳性细胞数和TUNEL阳性细胞数的比较差异均有统计学意义,P值均小于0.01。
讨 论
咀嚼运动是一种有节奏有规律的自主运动。咀嚼运动基本节律都是受中枢系统的调控。脑部功能代谢的维持依靠充足的脑血流量及供氧量,正常的咀嚼可以增加脑内血流量。尽管缺牙导致的大脑认知功能障碍的确切机制尚不清楚,但是牙齿缺失后咀嚼功能下降,可以引起脑血流量长期降低,引起大脑功能不同程度损伤,从而抑制大脑学习和记忆能力。通过前期行为学实验发现,随着缺牙数目的增多及时间延长,大鼠出现不同程度认知功能损害[7]。海马是管理情绪、行为、学习记忆功能的重要区域,同时也是高级神经中枢。有研究表明,海马的结构及功能完整可以在获得新信息及学习记忆方面起到至关重要的作用。
天冬氨酸特异性半胱氨酸蛋白酶(caspase-3)在细胞凋亡中起着不可替代的作用,目前普遍认为caspase-3是哺乳动物细胞凋亡中的关键蛋白酶。脱氧核糖核苷酸末端转移酶介导的缺口末端标记法(TUNEL)是已被广泛用于细胞凋亡的定量检测,能够准确的定位早期凋亡的细胞[8]。本研究采用免疫组化法检测大鼠海马CA1区激活的casepase-3蛋白表达情况,并运用TUNEL法检测其凋亡细胞,初步探索咬合支持丧失对幼年大鼠海马组织细胞凋亡产生的影响及可能存在的机制。
本研究结果显示,无缺牙大鼠(对照组)其海马组织CA1区神经细胞染色均匀,细胞膜完整,细胞结构清楚,未见明显神经元细胞变性,casepase-3的表达较其他缺牙组大鼠最低。缺牙4周时有磨牙缺失的大鼠海马组织CA1区神经元细胞出现明显的组织学改变,casepase-3蛋白的表达也随之变化,且随着缺牙数目的增多变化加剧。与对照组相比,3颗磨牙缺失组大鼠海马CA1区casepase-3表达无统计学差异,提示在较短时间内,个别磨牙缺失仅引起海马神经元细胞组织学轻微变化及casepase-3表达轻度增加,但与对照组相比无统计学差异。说明良好的咬合关系及正常的咀嚼能够抑制大鼠海马区神经凋亡,有助于大鼠海马区神经元形态完整并维持大脑神经元活性兴奋性。同时曾有报道也说明良好的咬合关系,充分的咀嚼能够有助于全身健康[9]。随着个别牙缺失的时间延长,大鼠海马组织CA1区casepase-3的表达如何?表达是否与对照组呈现显著差异还有待于进一步研究。
磨牙缺失达6颗及6颗以上时,大鼠海马组织CA1区casepase-3表达明显增多,磨牙完全缺失时(12颗)casepase-3表达量最高,且各组间比较差异具有统计学意义(P<0.01),提示磨牙缺失导致的凋亡细胞增多可能是通过促进casepase-3表达加速了神经细胞的凋亡。此研究结果与Ono,Kawahata等学者的研究结果描述基本一致[10,11]。
本研究发现幼年大鼠磨牙缺失后大脑海马组织细胞形态学发生不同程度改变,casepase-3蛋白的表达增加,促进海马CA1区神经元细胞凋亡发生。为今后进一步研究青少年缺牙与大脑学习记忆功能奠定实验基础。

