PCV2b Cap蛋白重组杆状病毒的构建及鉴定
刘喜凤 黄丹丹 张学贤
(1.北京大北农科技集团股份有限公司动物医学研究中心 北京 102609;2.北京市畜禽生物制品工程技术研究中心 北京 102609)
猪圆环病毒(Porcine circovirus,PCV)是迄今发现的最小的一种动物病毒[1],纯化后的PCV样品,电镜观察为17 nm无囊膜的球状病毒粒子。PCV基因组为单股负链环状DNA,基因组非常小,PCV有2种血清型,PCV1和PCV2,两种血清型毒株之间的序列同源性低于80%[2]。PCV2毒株可分为PCV2a、PCV2b、PCV2c、PCV2d[3],2003年之前,PCV2a为临床感染的猪群中最为流行的基因型,2003年之后则以PCV2b为主。PCV1基因组全长为1 559 bp,PCV2全长为1 767 bp或1 768 bp,主要编码3个蛋白,ORF1编码非结构复制蛋白Rep,大小为314个氨基酸,ORF2编码病毒核衣壳蛋白Cap,是唯一的结构蛋白,大小为233~234个氨基酸,是主要的免疫原性蛋白,可以自我组装成病毒粒子,ORF3与ORF1重叠,编码大小为105个氨基酸的非结构蛋白。PCV1无致病性,PCV2感染可引起几种综合征和疾病,包括断乳仔猪多系统衰竭综合征(PMWS)、猪皮炎与肾病综合征(PDNS)、繁殖障碍、猪呼吸综合征等,给世界养猪业带来巨大的损失[4]。
昆虫杆状病毒表达系统(Baculovirus expression system,BEVS)是一种高效的真核表达系统,能有效进行蛋白质的翻译后加工,表达产物的生物学活性与天然蛋白十分接近,特别适合于真核蛋白的制备研究,已成功表达了多种功能蛋白[5]。
本试验按照昆虫细胞密码子优化合成PCV2b ORF2编码的Cap蛋白基因序列,通过分子克隆的方法将该序列连接到改造过的杆状病毒载体PMP10-Fastdual中,构建表达PCV2b Cap蛋白的重组杆状病毒载体PM-P10-Fastdual-2b,通过杆粒制备、sf9细胞转染,筛选到表达PCV2b Cap蛋白的重组杆状病毒株,IFA、SDS-PAGE及Western-blotting结果都表明,PCV2b Cap蛋白获得成功表达,为开发猪圆环PCV2b亚单位疫苗奠定基础。
1 材料和方法
1.1 材料 PM-P10-Fastdual质粒、DH10Bac感受态和sf9细胞为大北农(大兴)科技园保存;质粒提取试剂盒购自天根生化科技有限公司;限制性内切酶购自NEB公司,高保真DNA聚合酶购自Takara公司。DNAMarker Trans2K○RPlus II DNA Marker和蛋白Marker Blue Plus II Protein Marker(14-120 kDa)购买自北京全式金生物技术有限公司,昆虫细胞培养基(Sf-900TMIII SFM/Grace's Medium)购自Thermo公司,FuGENE6 Transfection购自Promega公司,辣根过氧化物酶标记的山羊抗猪IgG购自Sigma公司。
1.2 方法
1.2.1 试验流程 试验按图1流程进行。
1.2.2 序列合成 根据GenBank公布的PCV2 Cap蛋白序列(ACN59889),按照昆虫细胞密码子偏爱性对2b-Cap基因进行优化和合成,通过酶切连接的方法将该基因连接到实验室保存的昆虫细胞高表达载体PM-P10-Fastdual中,构建高表达PCV2b Cap蛋白的昆虫细胞表达载体PM-P10-Fastdual-2b。
1.2.3 PM-P10-Fastdual-2b质粒构建和验证 将合成的720 bp 2b-Cap基因序列(两端带有XhoⅠ和KpnⅠ酶切位点)以及PM-P10-Fastdual载体XhoⅠ和KpnⅠ双切,回收2b-Cap和PM-P10-Fastdual双切片段,连接构建PM-P10-Fastdual-2b表达载体,大小为8 715 bp,该载体图谱见图2。试验通过测序及设计引物扩增2b-Cap序列,通过XhoⅠ和KpnⅠ双切PM-P10-Fastdual-2b来验证该质粒是否构建正确。

图2 PM-P10-Fastdual-2b质粒图谱

图1 试验流程图
1.2.4 重组rBacmid-2b构建和鉴定 按照Bac-to-Bac Baculovirus Expression Syste表达系统操作说明,将验证正确的重组杆状病毒质粒PM-P10-Fastdual-2b转化感受态细胞DH10Bac,如图3所示,在DH10Bac细胞中,重组转移载体PM-P10-Fastdual-2b与Bacmid发生位点特异性的转座作用,经蓝白菌落筛选及利用通用引物进行PCR鉴定,获得含2b-Cap基因序列的重组病毒杆粒rBacmid-2b。前取混悬液、离心后取上清、细胞重悬液制样,进行SDS-PAGE电泳,转印到硝酸纤维素膜上,5%脱脂乳封闭过夜,加入1:100稀释的猪圆环病毒阳性血清,室温孵育1 h,PBST洗涤3次,加入1:5 000稀释的HRP标记的山羊抗猪IgG,室温孵育1 h,洗涤3次后,加入化学发光显色液进行显色。
2 结果和讨论
2.1 PM-P10-Fastdual-2b质粒构建和鉴定 按照
图3 Bacmid位点特异性转座示意图
1.2.5 重组杆状病毒的获得与病毒扩增 按照Lipofectamine 2000转染试剂的说明操作,将重组穿梭载体rBacmid-2b转染对数生长期的sf9细胞,27℃静置培养,转染后72 h收毒,500 g离心5 min,移取上清于干净的EP管中,4℃避光保存,即P1病毒RAC-2bCap。将P1代RAC-2bCap按1:10的体积比感染处于对数生长期的sf9细胞,27℃培养2~3 d至细胞出现明显病变时,冻融2次,500 g离心5 min,去除细胞和大的细胞碎片,收集上清4℃避光保存,即为第2代病毒,P1代RAC-2bCap,用同样的方法获得第3代病毒,P3代RAC-2bCap毒。
1.2.6 间接免疫荧光(IFA)鉴定2b-Cap蛋白表达六孔板接毒,72 h后吸弃培养基,PBS洗板3次,每次洗5 min;80%丙酮固定液加入孔中,每孔2 mL,4℃固定30 min;PBS洗板3次,每次洗5 min;PCV2阳性猪血清用PBS按1∶200稀释,37℃孵育1 h;PBS洗板3次,每次洗5 min;FITC-山羊抗猪IgG用PBS按1∶100稀释,37℃避光孵育1 h;PBS洗板3次,每次洗5 min;荧光显微镜观察。
1.2.7 SDS-PAGE及Western-blotting鉴定2b-Cap蛋白表达 将P3代RAC-2bCap重组杆状病毒按1:50体积比接种对数生长期的sf9细胞,分别于24 h、48 h、72 h、96 h取样,感染96 h收毒,样品于2 000 r/min离心5 min,移取上清于干净的EP管中,细胞沉淀用等体积PBS重悬。分别于72 h收毒
1.2.2和1.2.3试验方法进行质粒构建。设计引物扩增2b-Cap序列。从图4的电泳结果可以看出,扩增的2b-Cap序列电泳位置与预期一致大小为720 bp左右。从图5可见,XhoⅠ/KpnⅠ双切得到两条带,上面条带是载体序列,下面条带是2b-Cap序列,结果与预期条带大小一致,同时测序结果(略)也证明2b-Cap序列已经成功插入到目的载体中,质粒PMP10-Fastdual-2b构建正确。
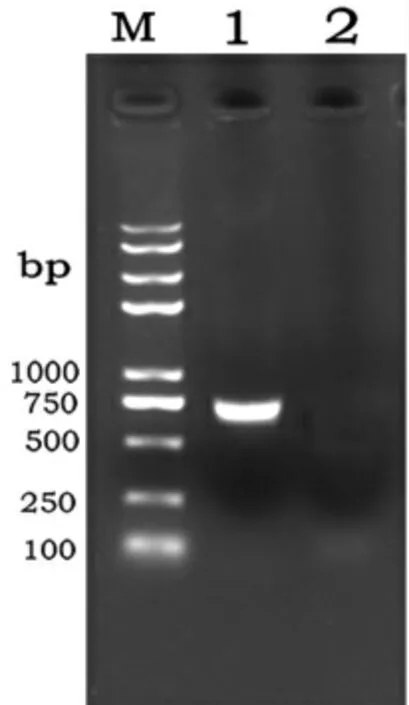
图4 PM-P10-Fastdual-2b质粒PCR验证
2.2 重组Bacmid-2b构建和鉴定 按照1.2.4的方法构建重组rBacmid-2b,挑选3个白斑和1个蓝斑进行鉴定,引物为M13上下游引物。由图6的结果可见,挑取的3个白斑,经纯化后,菌落PCR大小为6 000 bp左右,与预期一致,因此,挑取的3个克隆均为阳性。纯化后的单克隆菌液PCR条带单一,没有野毒条带污染,杆粒制备成功。
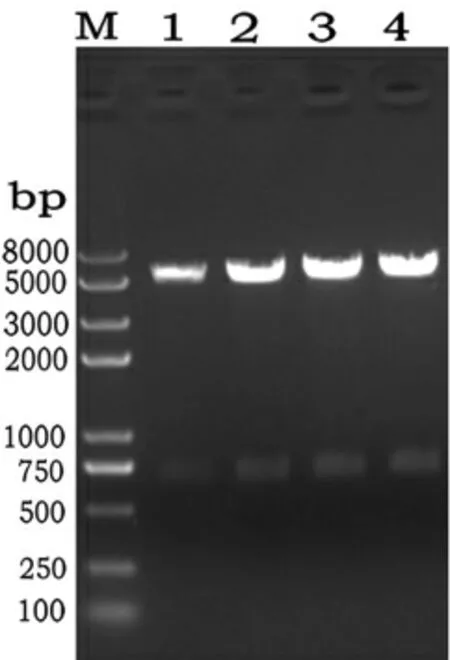
图5 PM-P10-Fastdual-2b质粒酶切验证

图6 重组杆粒PCR鉴定
2.3 重组病毒的获得与IFA鉴定 试验选取纯化后的2个单克隆转接至6 mL三抗LB培养基,37℃、220 r/min培养24 h,用异丙醇沉淀法提取重组杆粒并纯化,随后按照1.2.5的方法转染sf9细胞,收获P1代病毒。病毒传代,按照1.2.6的方法对P2代RAC-2bCap毒进行IFA鉴定。由图7可见,P2代重组病毒相比空白细胞有明显的绿色荧光,初步验证b2-Cap蛋白表达。
2.4 重组蛋白表达鉴定
2.4.1 SDS-PAGE鉴定 按照1.2.7的方法步骤,接种量为0.1 MOI,分别于24 h、48 h、72 h、96 h、120 h取混悬液,离心后取上清、细胞重悬液制样,进行SDS-PAGE电泳。从图9的SDS-PAGE电泳图谱可以看出,2b-Cap蛋白在细胞沉淀中得到表达,且随着时间蛋白表达有增长的趋势,表达量可达300μg/mL左右,但是该蛋白为不可溶表达,没有分泌到上清中,蛋白大小为28 kD左右。

图7 IFA鉴定重组病毒
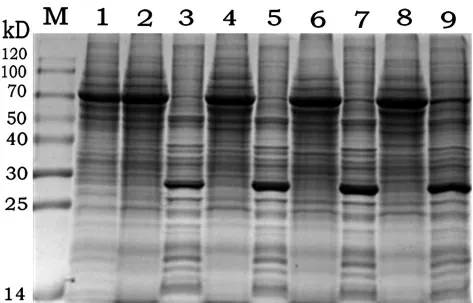
图8 SDS-PAGE验证2b表达
2.4.2 Western-blotting鉴定2b-Cap表达 SDSPAGE电泳图谱证明2b-Cap得到表达,为了进一步证实该蛋白为2b-Cap蛋白,对样品进行了Western-blotting分析,试验按照1.2.7的方法进行。由Western-blotting结果可见,24 h、48 h、72 h、96 h时2b-Cap蛋白都有表达,条带大小为2 828 kD左右,且随着培养时间延长,蛋白表达 量增加,证明2b-Cap蛋白在重组杆状病毒中得到表达。
3 结果和讨论

图9 2b-Cap蛋白的Western-blotting验证
杆状病毒表达系统表达外源蛋白用于疫苗生产已经非常成熟,其可以进行大规模的表达生产,生产的重组蛋白产量高,蛋白翻译后加工比细菌、酵母生产系统完善,而且由于昆虫杆状病毒具有限制性的宿主范围,只对特定种属的昆虫及其细胞进行感染,对人畜等脊椎动物没有感染能力,因此,具有比在哺乳动物及其培养细胞生产系统更为安全等优点而成为目前最有效的真核表达系统之一。但是外源蛋白的表达量依据培养条件、细胞状态种类、培养基的质量以及外源基因本身的性质,有着很大差别。本单位先前利用商品化的pFastBacTMDual作为载体表达PCV2b的Cap蛋白,蛋白表达量非常低,无法满足后续的试验需求,因此,本试验根据昆虫密码子优化合成了PCV2b的Cap基因,同时构建了添加增强子序列的PM-P10-Fastdual载体,通过分子克隆的方
法构建了重组杆状病毒PCV2b Cap蛋白高表达载体PM-P10-Fastdual-2b,通过杆粒制备及转染sf9昆虫细胞获得了表达猪PCV2b Cap蛋白的重组杆状病毒株,IFA、SDS-PAGE及WB验证该毒株可以表达PCV2b Cap蛋白,该蛋白以胞内沉淀形式表达,但是表达量明显提高。该试验为下一步制备PCV2b Cap蛋白亚单位疫苗打下了基础。

