湿法配合浸出难溶物溶解度的研究
任 晋
(中国有色金属建设股份有限公司,北京,100029)
在现代湿法冶金及一些化工过程中,经常利用合适的配体来浸出难溶物MmAa,如对NH3-NH4Cl-H2O体系采用浸出法直接从低品位氧化锌矿提取锌,锌以锌氨配合物形式进入浸出液[1];在铜、铅阳极泥的湿法处理中,利用氨水或者亚硫酸钠来浸出物料中的氯化银等。难溶物-配合体体系是一类非常重要的反应体系,也是十分复杂的体系。从配位化学的角度研究配位体和pH值对难溶物的溶解度问题,具有重要的理论和实际意义。但目前尚没有一套完善的溶解度计算模型,或者建立的模型只针对某一个具体的体系。作者利用Maple数学软件计算出难溶物的溶解度,并且绘制出相应的金属浓度-配体浓度-pH曲面图。
Maple是加拿大滑铁卢大学(University of Waterloo)和Waterloo Maple Software公司注册的一套数学软件包,以加拿大国旗图案枫叶(Maple)命名。它是当今世界上最优秀的几个数学软件之一,并以良好的使用环境、强有力的符号计算、高精度的数值计算、灵活的图形显示和高效的编程功能,成为科研人员进行数学处理的工具[2-4]。
1 各种反应平衡方程式
难溶物MmAa与某配体L形成配合物进入溶液,溶液中主要存在以下反应[5]:难溶物MmAa的离解反应;溶液中金属离子M与配体L的配合反应;溶液中金属离子M与OH的配合反应;溶液中M与A发生的自配位反应;溶液中A与H的加质子反应;溶液中配体L与H的加质子反应。此外还有水的离解反应等。
1.1 难溶物MmAa的离解反应
难溶物MmAa进入水溶液后,发生的离解反应为:

溶度积常数为:

由于A是由难溶物MmAa溶解后进入溶液的,因此

1.2 溶液中金属离子M与配体L的配合反应
M与L形成配合离子的反应平衡方程式为:
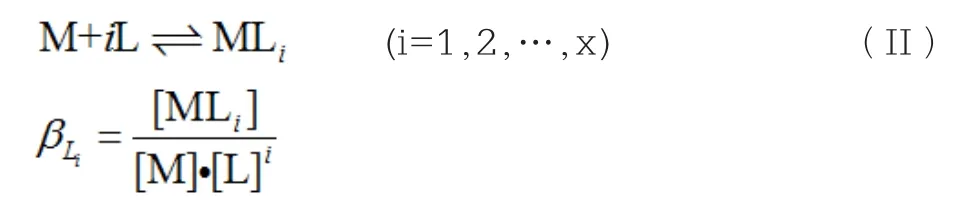
1.3 溶液中金属离子M与OH的配合反应
M与OH形成配合离子的反应平衡方程式为:

1.4 溶液中M与A发生的自配位反应
溶液中可能发生M与A的自配位反应:

1.5 溶液中A与H的加质子反应
如果A为弱酸根,则A可能与H发生加质子反应:

1.6 溶液中配体L与H的加质子反应
溶液中配体L与H发生加质子反应的平衡方程式为:

1.7 其他反应
水的离解平衡反应方程式为:

2 数学模型的构建
根据同时平衡原理和质量平衡原理[6],由平衡反应式(I)~(Ⅶ)可得溶液中M的总浓度[M]T、配体L的总浓度[L]T、A的总浓度[A]T的质量平衡方程式分别为:
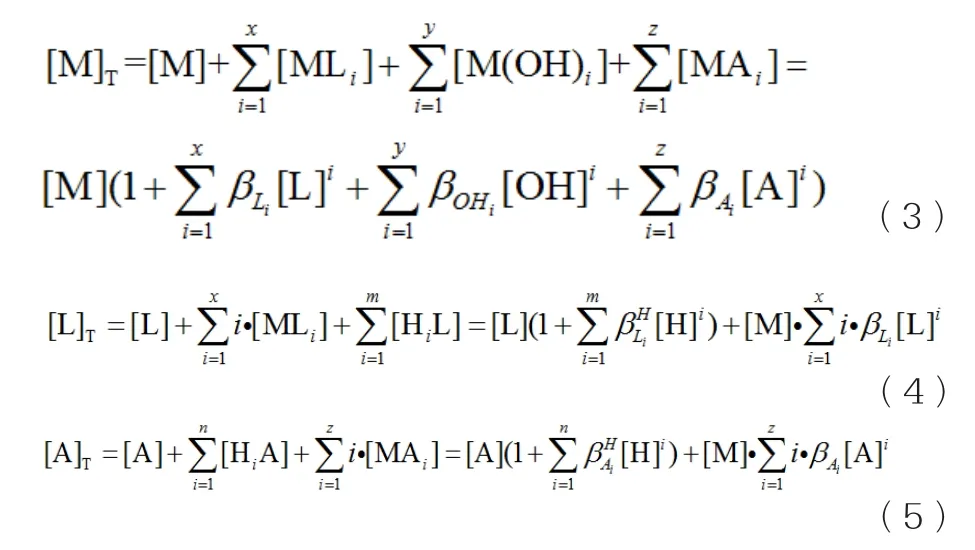
式(1)~(5)中 共 有[M]T、[M]、[L]T、[L]、[A]T、[A]、pH七个变量,因此固定[L]T、pH两个变量,根据这五个方程即可分别求出其余的变量。
由式(1)可变化为:
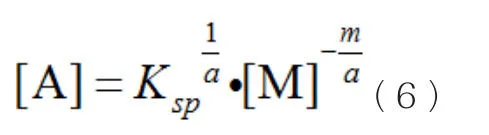
由式(4)可变化为:

由式(2)、(3)、(5)、(6)可变化为 :
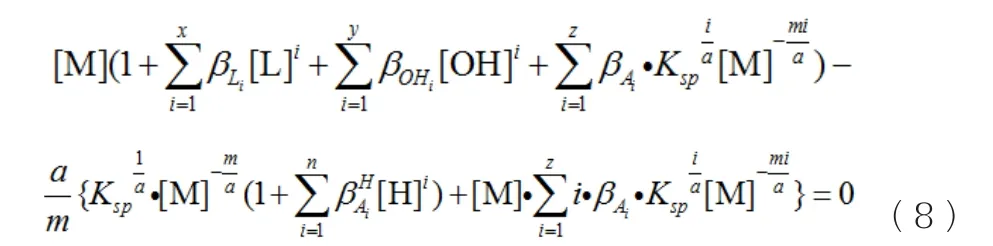
计算思路为 :由式(7)和(8)可知共有[M]、[L]T、[L]、pH四个变量,而[L]T和pH已经固定,因此联立这两个方程组,根据maple7的solve函数即可分别求出[L]和[M],然后将[M]代入式(6)求出[A],最后将[M]、[A]和[L]代入式(3)即可求出[M]T。
事实上,溶液中很少发生M与A的自配位反应。若溶液中不发生M与A的自配位反应,则式(7)和(8)中可以去掉M与A的自配位反应部分,式(7)简化后的数学模型见式(9),式(8)简化后的数学模型见(10):
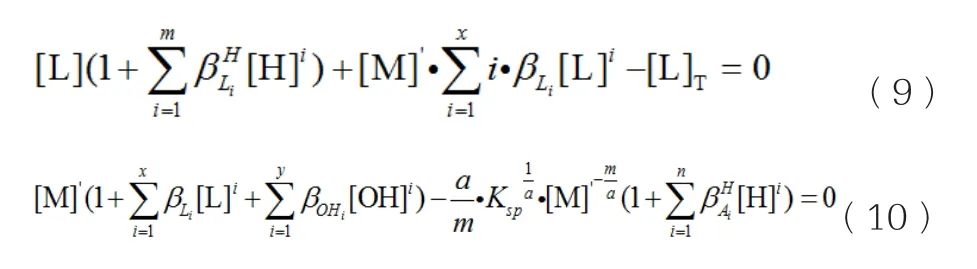
3 实例分析
以氨水浸出氯化银为例来验证建立的数学模型。氨浸氯化银过程中可能发生的配位反应及积累稳定常数见表1。
由于Ag+能与Cl-发生自配位反应,因此将这些相关的积累稳定常数及溶度积常数代入到式(7)和(8),建立的数学模型见式(11)~(13),然后分别求出[Ag+]及[NH3],最后求得总银浓度[Ag]T。

表1 氨浸氯化银过程中可能发生的配位反应及积累稳定常数
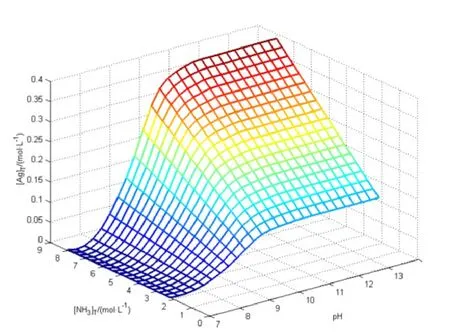
图1 [Ag]T随pH和[NH3]T变化的曲面图

图2 银的主要物种分布图

图3 [Ag]T与pH的关系

图4 [Ag]T与pH的关系
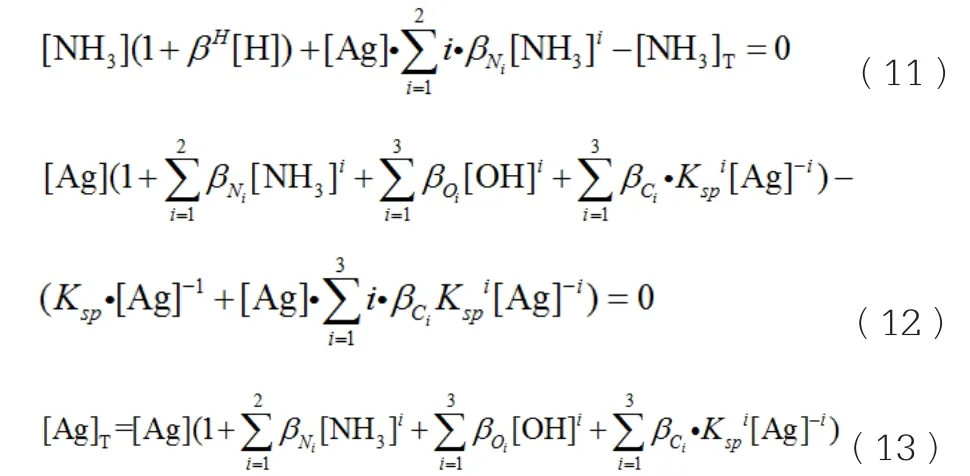
计算过程中[NH3]T分别取2、4、6、8 mol·L-1,pH分别 取7,8,9,10,11,12,13,14。将[Ag]T随[NH3]T和pH的变化关系绘制成热力学曲面图,如图1~图2所示。
图1说明当pH<7,[NH3]T<8 mol·L-1时,AgCl在氨水中的溶解度<0.00236 mol·L-1;当7<pH<11时,提高pH值可提高银的溶解度;当pH>11时,银的溶解度是个水平曲面,不随pH值变化而变化。图2说明银主要以Ag(NH3)2+形式存在。
为了与文献相比较,将以上将[Ag]T随[NH3]T和pH的变化关系绘制成二维图,如图3所示。经对照得出,图3所示图形和文献中[7]计算所得的图形如图4相比较完全吻合。
4 结论
本文利用配合物位化学理论,对难溶物在配体中的溶解度进行一系列计算,建立了难溶物MmAa溶解度的数学模型,并以实例进行验证,发现计算值和文献数据能很好的吻合,对其他难溶物的溶解度计算有一定参考意义。

