CD47抗体对低氧/复氧大鼠心肌细胞的保护作用
黄 伟,王邦宁,赵 韧,朱继田,李 倩,侯道荣
心肌缺血再灌注(ischemia/reperfusion, I/R)损伤是临床上心脏内科和心脏外科常见的病理生理现象,比如急性心肌梗死患者接受溶栓或介入治疗及血运重建均会造成I/R损伤[1-2]。心肌缺血再灌注损伤是缺血的心肌恢复血液供应后心肌细胞在形态、功能、代谢和电生理学表现等方面发生一系列的损伤表现[3]。这种损伤会激活细胞凋亡和自噬,导致细胞死亡[4]。通过有效的干预手段来减轻或预防I/R 损伤是重要的临床课题。有研究[5]表明使用抗CD47单克隆抗体阻断TSP1/CD47信号,或者敲除CD47,可以减轻小鼠心脏、肾脏、肝脏和组织皮瓣损伤。该研究采用大鼠原代心肌细胞低氧/复氧 (hypoxia/ reoxygenation,H/R) 损伤模型,从抗氧化及抗凋亡等方面探讨抗体封闭CD47对体外培养心肌细胞H/R损伤的作用及其机制,旨在为其临床应用提供基础理论依据。
1 材料与方法
1.1动物出生1~3 d的SD(Sprague-Dawley)大鼠30只,雌雄不限,购自安徽医科大学实验动物中心。
1.2主要试剂胎牛血清、胰酶(Trypsin) 和二甲基亚砜(DMSO) 购自美国Sigma公司;乳酸脱氢酶(LDH,A020-1)、肌酸激酶(CK,A032)、超氧化物歧化酶(SOD,A001-1)、丙二醛(MDA,A003-1)和一氧化氮(NO,A012-1) 检测试剂盒,购自南京建成生物工程研究所;噻唑蓝(MTT)购自美国ENZO公司;DHE(dihydroethidium)购自美国Invitrogen公司;Annexin V-FITC/PI凋亡检测试剂盒(556547)购自美国BD Biosciences公司; CD47抗体(sc-53050)购自美国Santa Cruz Biotechnology公司;eNOS抗体 (32027)、p-eNOS抗体 (9570)和GAPDH抗体(5174)购自美国Cell Signal Technology公司。
1.3主要仪器低氧/高氧细胞培养箱(Model 3131)和普通细胞培养箱(HERACELL 150i)购自美国Thermo Scientific公司;96孔多功能酶标检测仪(Eon)购自美国BioTeK公司;流式细胞仪(BD FACSCalibur)购自美国BD Biosciences公司。
1.4方法
1.4.1乳鼠心肌细胞分离和培养 参考文献[6]方法,心肌细胞分离采用酶消化、差速贴壁法。心肌细胞培养液为90% DMEM、10%胎牛血清、青霉素100 U/ml、链霉素100 U/ml,以6×105/ml接种到6孔板,37 ℃、5% CO2培养箱中培养,每2 d换液1次,培养3~4 d用于实验。
1.4.2心肌细胞H/R 模型的建立 原代培养3~4 d后呈亚融合状态,低氧处理时,将细胞放入低氧/高氧培养箱中(1% O2,94% N2,5% CO2)37 ℃恒温培养24 h;复氧处理时,从培养箱中取出细胞培养板,置于常氧培养箱中(95%空气, 5% CO2, 37 ℃)培养12 h。常氧培养细胞用于对照。所有实验重复3次。
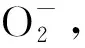
1.5指标检测
1.5.1心肌细胞活力检测 采用MTT比色法检测心肌细胞活力。细胞计数后在96孔板上以1×104/孔接种细胞。每孔加入20 μl MTT溶液,继续培养4 h,吸出培养液。每孔加入二甲基亚砜(DMSO)100 μl,室温低速震荡30 min充分溶解。酶标仪测定各孔在570 nm波长的吸收值。细胞存活率=(实验组光吸收值/对照组光吸收值)×100%。
1.5.2心肌细胞凋亡的检测 使用AnnexinV-FITC/PI试剂盒检测心肌细胞凋亡。细胞用PBS清洗3次,用0.25%胰酶消化,收集细胞,离心后用AnnexinV-FITC结合液重悬,制成单细胞悬液,加入AnnexinV-FITC和碘化丙啶(PI)室温避光孵育10 min后,加入300 μl 1×缓冲液终止反应,混匀后流式细胞仪检测。
1.5.3LDH、CK、SOD、MDA和NO水平检测 收集各组细胞上清液,按照试剂盒说明书操作,使用酶标仪检测LDH、CK、SOD、MDA和NO水平。
1.5.4活性氧簇(reactive oxygen species, ROS)染色 细胞使用DPBS洗涤3次;加入DHE(10 μmol/L),37 ℃避光孵育30 min;DPBS洗涤3次后荧光显微镜拍照。荧光定量使用Image J 软件。
1.5.5Western blot 采用蛋白提取试剂盒提取细胞蛋白,使用BCA蛋白测定试剂盒进行蛋白定量,10% SDS-聚丙烯酰胺凝胶进行电泳分离、转膜。5%脱脂奶粉TBST溶液室温封闭3 h 后,分别加入eNOS抗体(1 ∶1 000)、p-eNOS抗体(1 ∶1 000)和anti-GAPDH抗体(1 ∶1 000)。4 ℃孵育过夜,1×TBST洗3次,加入辣根过氧化酶标记的二抗,室温孵育2 h,1×TBST洗3次,增强化学发光法显色,凝胶成像系统拍照。蛋白表达定量使用Image J软件。


表1 细胞培养上清液中LDH、CK、SOD、MDA和NO含量变化
与Control组比较:***P<0.001;与H/R组比较:##P<0.01,###P<0.001
2 结果
2.1各组心肌细胞存活率的比较心肌细胞低氧和复氧处理明显增加了细胞死亡,与Control组(97.05±1.38)%比较,H/R组细胞存活率(39.46±2.96)%明显下降(P<0.01);CD47抗体处理增加了低氧和复氧损伤细胞的存活率,与H/R组相比,CD47+H/R组(78.52±4.39)%心肌细胞存活率显著增加(P<0.01)。
2.2各组心肌细胞上清液中LDH、CK、SOD、MDA和NO水平的比较在H/R组中,CK、LDH和MDA的水平显著高于Control组(P<0.01),与H/R组相比,CD47+H/R组CK、LDH和MDA的水平显著减少(P<0.01)。与Control组相比,H/R组SOD和NO水平明显降低(P<0.01);与H/R组比较,CD47+H/R组SOD和NO水平显著增加(P<0.01)。各组心肌细胞的CK、LDH、MDA、SOD和NO水平见表1。
2.3各组心肌细胞凋亡率的影响在早期的凋亡中,磷脂酰丝氨酸(phosphatidylserine)表达于细胞膜。膜粘蛋白(annexin)对磷脂丝氨酸具有高亲和性。异硫氰酸荧光素(Fluorescein isothiocyanate, FITC)标记的膜粘蛋白V(Annexin V)染色可以用于鉴别早期凋亡细胞。由于坏死细胞膜结构破裂或者疏松,PI能够穿过细胞膜与DNA结合。因此可以用于区别凋亡细胞和正常细胞。与Control组相比,H/R组的细胞早期凋亡、晚期凋亡和总死亡率均显著增高(P<0.01),与H/R组比较,CD47+H/R组的细胞早期凋亡、晚期凋亡和总死亡率则明显下降(P<0.01)。各组细胞流式检测结果见表2。

表2 各组细胞凋亡比例
与Control组比较:***P<0.001;与H/R组比较:##P<0.01,###P<0.001
2.4各组心肌细胞ROS产生的比较荧光定量(图1)结果表明,心肌细胞低氧/复氧处理明显使细胞产生更多ROS,和Control组比较,H/R组荧光更强(P<0.01);而CD47抗体封闭显著减少细胞低氧/复氧处理后ROS的产生,和H/R组比较,CD47+H/R组荧光明显减弱(P<0.01)。
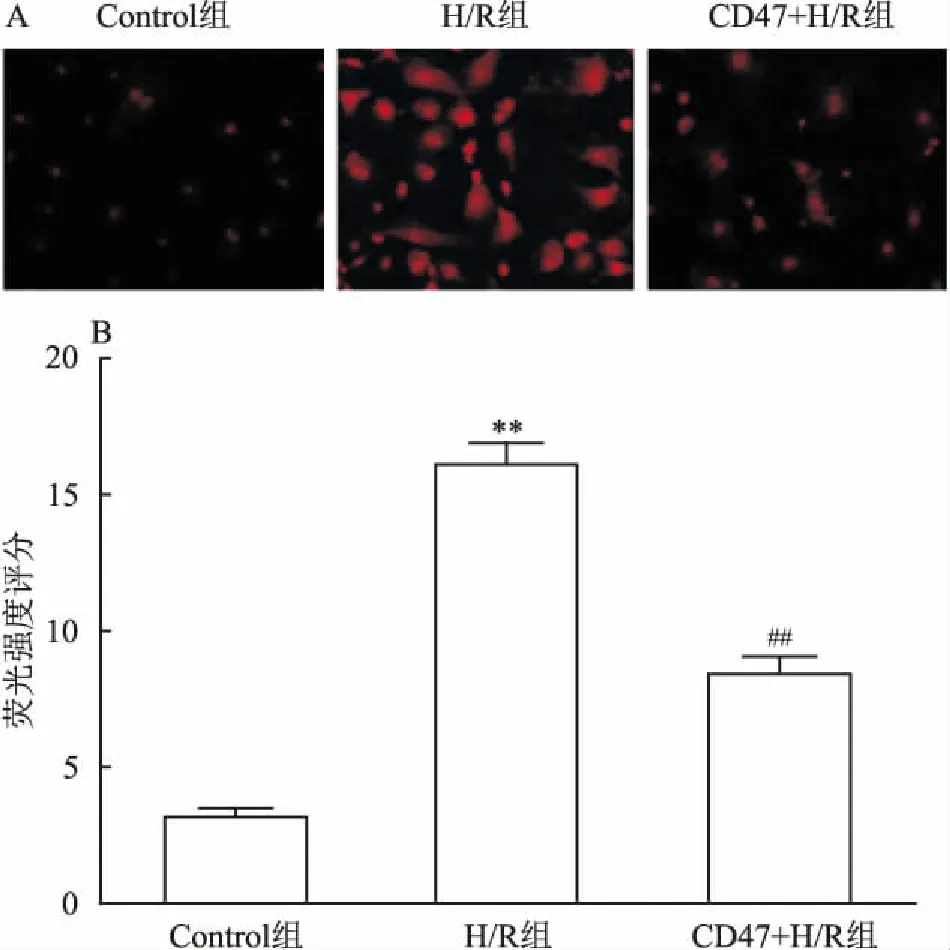
图1 Control组、H/R组和CD47+H/R组细胞ROS染色结果
A:各组心肌细胞ROS染色;B:各组心肌细胞ROS染色定量结果比较;与Control组比较:**P<0.01;与H/R组比较:##P<0.01
2.5各组心肌细胞eNOS/NO通路影响的比较定量结果(图2)表明,三组细胞eNOS蛋白表达量无明显差异;与Control组比较,H/R组p-eNOS表达明显下降(P<0.01),CD47表达明显上升(P<0.01);与H/R组比较,CD47+H/R组p-eNOS表达显著上升(P<0.01),CD47表达显著降低(P<0.05)。
3 讨论
CD47是一种具有五个跨膜域的蛋白质,在大多数细胞类型中广泛表达并参与到先天免疫反应中。Bauer et al[9]报道在缺血状态CD47在血管细胞中的表达显著上调。CD47被TSP1激活后可通过降低钙通量抑制eNOS活性从而减少NO的产生[10]。Sharifi-Sanjani et al[11]发现,CD47下调可以保护心脏压力,缓解心脏衰竭,提高缺血性皮瓣和皮肤移植的存活率,同时也能抑制小鼠肝、肾I/R损伤[5]。离体心肌细胞H/R处理能够造成心肌细胞损伤,同时也是模拟在体外环境下心肌I/R的常用模型。大鼠心肌发生I/R损伤后,表现为心肌细胞凋亡增多、胞质中CK、CK-MB、AST和LDH大量释放。通过细胞凋亡率以及细胞培养基中CK、CK-MB、AST、LDH 含量的测定能够反映心肌细胞的损伤程度[12]。本研究中CD47下调可增强eNOS/NO信号,从而激活eNOS并增加NO产生来缓解I/R的损伤。这一结果和Yao et al[13]研究结果一致。此外,CD47抗体处理引起体外培养的大鼠心肌细胞CD47表达下降,减轻了H/R心肌细胞损伤的作用,显著降低了CK和LDH水平。
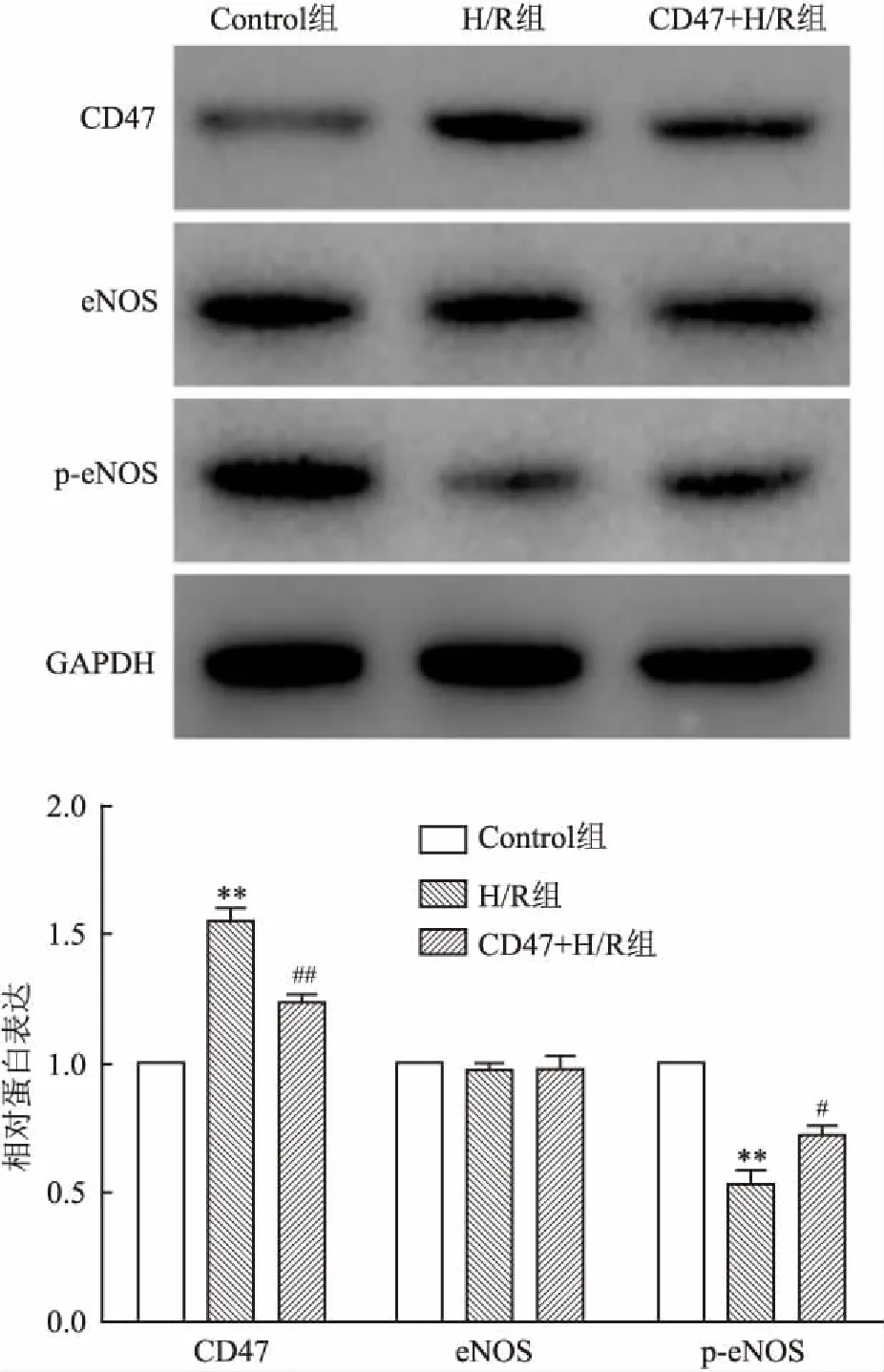
图2 三组细胞CD47、eNOS、p-eNOS蛋白表达
与Control组比较:*P<0.05,**P<0.01;与H/R组比较:#P<0.05,##P<0.01
研究[14]证实, 氧化应激是I/R的主要病理表现。心肌细胞在I/R的过程中产生大量氧自由基,启动氧化应激反应,导致线粒体功能紊乱,细胞损伤、凋亡和坏死。在心肌细胞发生H/R损伤过程中,细胞氧化应激也会被激活[15]。氧化应激主要由ROS介导,造成细胞内SOD、GSH-Px、VitC、VitE等抗氧化物质大量消耗,进而引起生物膜中脂质成分发生氧化并产生MDA。氧化应激在心血管疾病的发生发展过程发挥着重要作用,既可直接损伤细胞DNA诱导凋亡,还可以通过激活线粒体途径等间接方式介导细胞凋亡。氧化应激介导的心肌细胞凋亡与心肌I/R的发生发展关系密切,是其发病机制中的重要环节之一[5]。研究[12]显示,缺血和再灌注均可诱发心肌细胞凋亡,缺血是心肌细胞凋亡的启动因素,再灌注损伤可加重心肌细胞凋亡,并使凋亡不可逆转。因此抗氧化应激抑制凋亡成为探索这些疾病的发病机制及研制相关药物的一个重要方向。本研究中,心肌细胞经H/R处理使氧化应激增加并降低了抗氧化能力;CD47下调增加心肌细胞抗氧化酶SOD的活性并减少了H/R心肌细胞MDA的产生。这些结果说明下调CD47可减少NADPH氧化酶源ROS的产生,增强细胞抗氧化能力并显著减轻心肌细胞H/R引起的细胞凋亡。

