铝掺杂二氧化锰纳米线的制备及其电化学性能
潘 双,王 冰,马泽军,刘 亮,齐锦刚
(辽宁工业大学 材料学院,辽宁 锦州 121000)
0 引言
电极材料是决定超级电容器电化学性能的关键因素之一,因此研发具有优异性能的电极材料是超级电容器研究的核心课题[1]。电极材料主要有碳材料、过渡金属氧化物、导电聚合物等。过渡金属氧化物通过在电极溶液界面发生快速的氧化还原反应,可产生远大于其他电极材料的法拉第赝电容,但RuO2的成本太高,且污染环境,故难以广泛应用[2-4]。此时,二氧化锰(MnO2)作为电极材料受到广泛的关注,且具有资源丰富,价格低,环境好等优点[5-6]。但由于MnO2的导电性差,极大地制约了其作为电极材料的广泛应用[7]。研究者们提出,在MnO2中掺杂金属离子,从而提高其电化学性能[8-9]。如Machefaux等[10]在电化学-水热合成体系下进行金属离子(A1、Ni和Co)的掺杂,成功制备了纳米线状的γ型MnO2,明显提高了电极材料的电化学性能。Calvert等[11]制备了Wu掺杂MnO2的实验,其电导性测试Wu的掺杂使电阻率得到增强。此外,Chung. K.Y研究掺杂Co和Ni对尖晶石LiMn2O4循环性能的影响,认为杂质离子可以抑制Jahn-Teller效应,从而改善电极材料的循环充放电性能[12]。
本文采用水热法,以高锰酸钾(KMnO4)和硫酸锰(MnSO4)为反应物,通过掺杂一定量的Al(NO3)3,最终获得纳米线状的α型MnO2,并进行结构和形貌以及电化学性能的分析,为MnO2作为超级电容器电极材料的研究与应用提供基础。
1 实验部分
1.1 泡沫镍上MnO2电极的合成
将泡沫镍分别在无水乙醇、去离子水中超声洗涤处理30 min,将其在80 ℃下干燥 6 h。首先,使用电子天平准确称取一定量的KMnO4(分析纯)和MnSO4(分析纯),按摩尔比为2∶3分别溶于40 mL去离子水中,配制成溶液。将KMnO4溶液和MnSO4溶液进行水浴加热,保温一段时间后取出分别搅拌,将MnSO4倒入KMnO4溶液,将处理好的泡沫镍垂直置于反应釜中随混合液加热到150 ℃保温8 h,冷却至室温,静置12 h,用无水乙醇和去离子水洗涤泡沫镍,去除多余杂质离子。将所得泡沫镍在280 ℃下煅烧2 h,然后在80 ℃下干燥4 h,记为电极A。称取不同摩尔比(0.5 mmol、1 mmol、2 mmol)的Al(NO3)3(分析纯)加入到KMnO4和KMnO4的混合溶液中,按照相同的制备工艺,得到的泡沫镍分别记为电极B、C、D。
1.2 材料的表征
实验采用D/max-2500/PC X-Ray Diffractometer的X线衍射仪(XRD),对样品的晶型和结晶度进行表征和分析。具体参数为:Cu靶,Kα射线,扫描速率为0.08 (°)/s,扫描范围10°~70°,X线波长λ=0.154 18 nm。采用Sigma-500型场发射扫描电子显微镜(SEM)观察样品形貌,仪器的加速电压为5 kV。
1.3 材料的电化学性能
本实验采用上海辰华仪器公司生产的CHI-660D电化学工作站进行循环伏安法(CV)。以0.5 mol/L的Na2SO4为电解液,负载有MnO2电活性材料的泡沫镍(测试面积约为1 cm2)直接充当工作电极,饱和甘汞(SCE)电极作为参比电极,铂片作为辅助电极进行三电极体系测试。通过CV、恒电流充放电(GCD)和电化学交流阻抗(EIS)法测试MnO2样品的电化学性能。
2 结果与分析
2.1 物相分析
图1为电极A、B、C、D的XRD图谱。由图可知,电极A的衍射图谱出现明显差异,未掺杂Al时,制备的MnO2并未出现明显的衍射峰,属于无定型MnO2。电极B、C、D的衍射图谱基本一致,与α-MnO2(JCPDS 43-1455)标准卡对照可知,均属于α-MnO2。随着掺杂量的增加,提高了MnO2的衍射峰,同时衍射峰发生偏移,证明Al3+的存在对衍射峰的位置以及结晶度均有一定影响。图中标记Ni的峰是来自泡沫镍的杂峰。当掺杂量为1 mmol 时,衍射峰强度较大,MnO2的结晶性最好;掺杂量为2 mmol 时,MnO2的特征衍射峰值下降,导致这种现象的原因可能是:掺杂量过多,Al的氧化物包覆在MnO2表面,减弱了内部MnO2的衍射强度。

图1 电极A、B、C、D的XRD图谱
2.2 形貌分析
图2为未掺杂电极A与掺杂电极C的MnO2粉末形貌对比图。从图中可看出,未掺杂的电极A形貌为纳米线状,分布较散乱,MnO2纳米线长约600 nm,直径约∅10 nm。掺杂后,电极C由纳米线转变为纳米球,直径约∅10 nm,长约80 nm。从图2(c)可看出,这些纳米球是由纳米线组成,纳米球部分团聚在一起,但大部分还是能较好地分散开,结合图1可知,该产物为氧化铝和MnO2的混合相。由图2可知,Al掺杂使纳米MnO2粉末结构由纳米线转变为纳米球,增大表面活性物质与电解液接触的面积,促进电解液渗透电极材料,进而提高样品的电化学性能。

图2 掺杂与未掺杂的MnO2粉末SEM照片
2.3 材料的电化学测试
图3是电极A、B、C、D在0.5 mol/L的Na2SO4溶液中,扫描速率为10 mV/s 的循环伏安曲线。由图可知,电极A、B、C、D在扫描过程中有一对较明显的氧化还原峰,即MnO2在充放电过程中发生了氧化还原反应,产生了赝电容,形状偏矩形特征,说明电极在充放电过程中存在不可逆反应[13]。由图3可知,Al(NO3)3掺杂量不同时对电极的电流响应有影响,掺量适中的C具有最大的面积,说明在扫描过程中此电极电流的响应最大,表现出良好的电容特性。
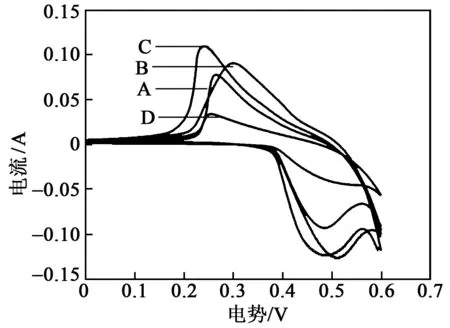
图3 电极A、B、C、D的循环伏安曲线
图4为电极C在不同扫描速度下的循环伏安曲线。由图可知,扫描速度由10 mV/s提高至50 mV/s时,响应电流几乎保持一致,当扫描速度由50 mV/s提高至100 mV/s时,曲线的形状发生扭曲,材料的内阻不断增大,响应电流几乎缩小1倍。这是因为在较大扫描速率下,纳米线变的刚性很强而不利于离子传输,导致电解质离子只能到达电极表面,氧化还原反应难以进行,活性物质的利用率较低,表现为双电层电容,这样会造成电极比容量的下降[14]。

图4 不同扫速下电极C的循环伏安曲线
图5为Al掺杂MnO2电极材料在电流密度2.0 mA/cm2下的恒电流充放电曲线。充放电曲线均近似对称,说明电极具有高的充放电效率及良好的可逆性。电极的充放电曲线初始部分均有一段垂直线段,它代表材料的内阻,说明电极电位随时间呈线性变化,表现为双电层电容特性。由面电容C=IΔt/(SΔV)(其中I为电流密度;Δt为活性物质放电时间;S=1为活性物质的面积;ΔV为工作电压窗口),计算出电极A、B、C、D的面电容分别为733 mF/cm2、963 mF/cm2、1 127 mF/cm2、525 mF/cm2。电极C有最大的面电容,比未掺杂的电极A提高了65%。同时,由能量密度E=0.5CΔV2和功率密度P=E/Δt可得,电极A、B、C、D的E分别为938.24 mWh/cm3、1 271.46 mWh/cm3、1 497.16 mWh/cm3、421.84 mWh/cm3,P分别为1.79 mW/cm3、1.55 mW/cm3、1.81 mW/cm3、1.07 mW/cm3,经过计算可知,电极C具有较好的功率密度和能量密度。这与图3的分析和观察一致。
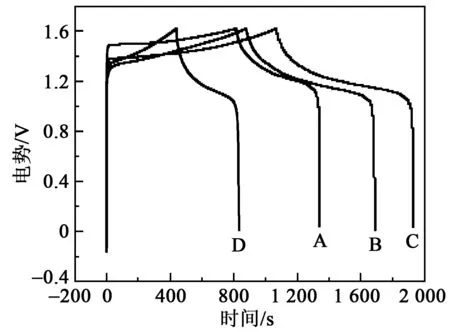
图5 电极A、B、C、D的恒电流充放电曲线
图6为电极A、B、C和D不同电流密度下的放电性能曲线。由图可知,电极A、B、C、D在2 mA/cm2分别获得733 mF/cm2、963 mF/cm2、1 127 mF/cm2、525 mF/cm2的面电容,在14 mA/cm2分别获得368 mF/cm2、784 mF/cm2、947 mF/cm2、300 mF/cm2的面电容。适当的掺杂量明显提高了整体电极材料的面电容,拥有较优异的倍率特性。对比电极B和C的曲线可知,电极C在不同电流密度下具有较好的稳定性,而过多的掺杂量则降低了电极材料的面电容,与未掺杂的电极A对比面电容降低了18%~20%。产生这种现象的原因可能是Al对MnO2具有包覆作用,使活性物质MnO2的量降低,不利于活性物质与电解液充分接触,降低了材料的面电容。

图6 电极A、B、C、D不同电流密度下的放电性对比图
图7为电极A、C的电化学交流阻抗图。由图可知,在实轴上,电极C的截距更小,说明电极C与电极A 相比,有更小的内部电阻。高频区的圆弧部分表明了赝电容的存在。在低频区,倾斜角度有明显的改变,电极C的斜率远大于电极A,说明电极C具有较快的扩散速度,具有良好的电容特性,这也是电极C具有最大比容量的原因之一。掺杂减小电极材料内阻的可能原因是:α-MnO2为一维隧道结构,r(Mn4+)(离子半径)>r(Al3+),所以掺杂Al3+属于间隙位置掺杂,引起微观结构的畸变,使MnO2的晶格间距发生改变并支撑整个晶格,增强电子的导电率和稳定性,质子和电子得以在晶格间自由流动,保障界面的离子和电子的快速传递。

图7 电极A、C的交流阻抗图
3 结论
本文采用水热法,制备掺杂不同Al含量的MnO2纳米线,得到以下结论:
1) XRD测试表明,掺杂使MnO2由无定型转变成α型。
2) SEM表明,添加一定量的Al(NO3)3,材料的形状由纳米线变成纳米球线。
3) 电化学测试表明,适当掺杂可增大电极的面电容。当Al(NO3)3的添加量为1 mmol时,材料具有最好的电容性能,在电流密度为2 mA/cm2下面电容达到1 127 mF/cm2,这表明材料在低电流密度下具有较好的放电能力。

