BMI-1在泌尿系肿瘤侵袭性转移中的研究进展
许端雅,刘修恒
(武汉大学人民医院泌尿外科,湖北武汉 430060)
原癌基因B细胞特异性小鼠白血病病毒插入位点1(B-cell-specific moloney murine leukemia virus insetion site 1,BMI-1)是一种原癌基因[1],属于多梳基因家族(poly-comb group genes,PcG),目前已有大量证据表明BMI-1在转录抑制、干细胞功能调节、DNA损伤修复中的重要作用[2],可参与调节细胞生长、增殖以及肿瘤的发生,近来也有研究证实了其在线粒体中的作用。近年发现BMI-1基因与多种肿瘤发生、增殖、转移和复发相关。本文旨在通过对BMI-1在泌尿系肿瘤侵袭性转移中的研究进展进行综述,为BMI-1基因相关的泌尿系肿瘤侵袭性转移发生机制提供参考。
1 BMI-1的结构及生物学功能
1.1BMI-1基因及蛋白分子的基本结构BMI-1基因位于染色体10p12.2,包括10个外显子和9个内含子,编码的cDNA长度为3.4 kb[3],其编码的蛋白质产物BMI-1含有326个氨基酸,几乎所有组织均有表达,大脑、脊髓、肺、肾和胚胎中的表达水平升高。BMI-1蛋白有4个重要结构域,即N-末端指环模序(ring finer domain,RF)、位于中心部位的螺旋-转角-螺旋-转角DNA结合模序(DNA banding helix-turn-helix-turn motif,H-T-H-T)、两个核定位信号(nuclear localization signal,NLS)NLS1和NLS2、以及C末端富含脯氨酸、谷氨酸、丝氨酸、苏氨酸残基的区域[1]。
1.2BMI-1的生物学功能BMI-1基因是多梳基因家族的一员, BMI-1基因的环指结构域和螺旋-转角-螺旋结构域在刺激细胞增殖、抑制蛋白表达方面具有重要作用,与其他各种PcG蛋白一起通过形成多蛋白复合体参与同源盒基因(homobox,HOX)的转录调节,维持HOX的抑制状态,HOX在决定细胞定向分化与增殖、调控机体组织器官发育方面起决定性作用,BMI-1基因表达异常导致HOX基因表达抑制或激活异常,影响HOX基因正常功能的发挥[4]。BMI-1基因与神经干细胞、造血干细胞、人骨髓间充质细胞、白血病干细胞和胚胎干细胞的自我更新和增殖密切相关[5]。BMI-1 蛋白通过与 c- Myc 蛋白共同作用抑制Ink4a/Arf 基因位点,对 p16 Ink4a 和 p19 Arf 的转录具有显性负调控作用,从而抑制细胞的衰老,由于不同的阅读顺序,该基因座编码 2 种结构不同的蛋白 p16 Ink4a 和 Arf (在人体内称为 p14 Arf,在小鼠体内称为 p19 Arf)。 p16 Ink4a 是一个周期性依赖蛋白激酶抑制因子,可以抑制周期蛋白 D- Cdk4/6 复合物,从而激活 Rb 信号通路; Arf 可以通过抑制 Mdm2 诱导 p53 信号通路; 这2种蛋白都可以阻断细胞增殖[6]。
2 BMI-1与膀胱癌
有研究表明BMI-1蛋白的表达与膀胱癌肿瘤大小、分级分期、淋巴转移有关,BMI-1蛋白阴性和阳性患者的5年生存率具有统计学差异,检测BMI-1蛋白有助于膀胱癌的诊断和预后评估[7-9,11]。
2.1干扰、抑制BMI-1可降低膀胱癌侵袭性转移通过不同方式干扰BMI-1基因后,发现膀胱癌侵袭能力降低。研究证实BMI-1 shRNA通过阻断转化生长因子-β1(Transforming Growth factor β1,TGF-β1)抑制膀胱癌5637细胞侵袭和转移,证明了BMI-1基因促进肿瘤细胞的侵袭和转移[12-13];崔学江等[14]的实验表明通过siRNA干扰BMI-1基因可以抑制EJ膀胱癌细胞的体外生长,其作用机制与其上调下游p16ink4a、p14Arf基因的表达有关;miR-200c可通过下调BMI-1和E2F3的表达从而降低膀胱癌细胞侵袭、迁移和增值的能力[15](图1)。

图1BMI-1与膀胱癌侵袭转移的关系
2.2BMI-1可能通过与其他基因相互作用促进膀胱癌侵袭转移目前已有相关研究发现在BMI-1促进膀胱癌侵袭转移的过程中存在其他基因的参与(图1)。BMI-1和MMP-2、E-cadherin在膀胱移行细胞癌的发生发展和侵袭转移过程中可能存在相互协同作用[9];BMI-1和AEG-1表达呈正相关,FHIT表达与BMI-1和AEG-1呈负相关,三者之间在膀胱癌浸润转移中可能存在相互制约又协同的关系[8];膀胱癌组织中p16基因的表达量随着BMI-1基因表达量的增高而降低,其机制可能是通过p161lnk4a/细胞周期素(cyclin)D/Rb通路来下调p16的表达,从而共同参与膀胱移行细胞癌的发生发展[10];BMI-1 siRNA能有效抑制膀胱癌细胞增值和体外迁移,促进膀胱癌侵袭,其机制可能是通过引起上皮-间质转化来实现的[11]; MARTNEZ-FERNNDEZ等[16]的实验证明多数抑制复合物成员之间通过协调作用抑制miR-200的表达,从而促进了膀胱癌侵袭性发展。
3 BMI-1与前列腺癌
目前关于前列腺癌预后评价的标志物还很少,BMI-1是正处于研究阶段的标志物之一。BMI-1与乳腺癌、胰腺癌、血液系统恶性肿瘤等的侵袭性转移的相关性已经得到证实[18,20],同时也有证据表明BMI-1与前列腺癌发生、进展相关[22,25]。
3.1BMI-1基因与前列腺癌发生发展的关系有研究证明BMI-1蛋白在前列腺癌组织中的表达增加,在前列腺癌进展阶段老鼠模型中明显升高,其表达与肿瘤的低分化、高风险和不良预后明显相关[21,23]。在进展期的前列腺癌组织中BMI-1的表达量逐渐增加,且富含BMI-1蛋白的前列腺癌细胞对化疗无反应,从而促进了前列腺癌的侵袭[26]。有实验表明BMI-1的丧失减少了前列腺癌模型中的致癌进展[27]。RAHMAN SIDDIQUE等[26]发现干扰BMI-1表达后改善了具有化学耐药性前列腺肿瘤的动物模型中多西他赛治疗的结果。
3.2部分基因以BMI-1为靶基因调控前列腺癌的进展目前已有部分研究表明有相关基因通过调控BMI-1来促进或者抑制前列腺癌的侵袭、转移。VEGF /神经胶质蛋白-2调节BMI-1,随后抑制IGF-1R是侵袭性前列腺癌发生的机制之一[28]。JIN等[17]研究发现BMI-1是miR-128直接的和功能性的靶基因,过表达miR-128通过下调BMI-1等“干性”相关基因,负向调控肿瘤干细胞特性,从而抑制前列腺癌的发展,显著抑制前列腺癌细胞的体外生长、增殖和侵袭能力(图2)。
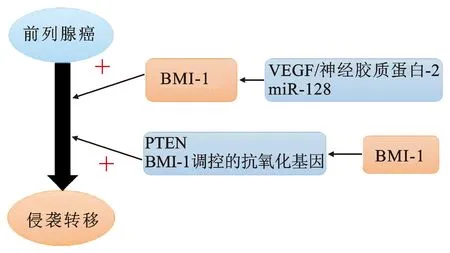
图2BMI-1与前列腺癌侵袭转移的关系
3.3BMI-1通过调控其他基因促进前列腺癌的进展BMI-1促进前列腺癌侵袭、转移的下游通路目前已有一定的研究发现。PTEN的功能是维持基因的稳定性,有研究证明BMI-1通过结合PTEN诱发基因的不稳定,从而促进肿瘤发生[19]。BMI-1调控的抗氧化基因在侵袭性前列腺癌中过表达,从而增强抗氧化反应,使前列腺癌细胞在多西紫杉醇化疗后仍存活[24](图2)。
4 BMI-1与肾癌
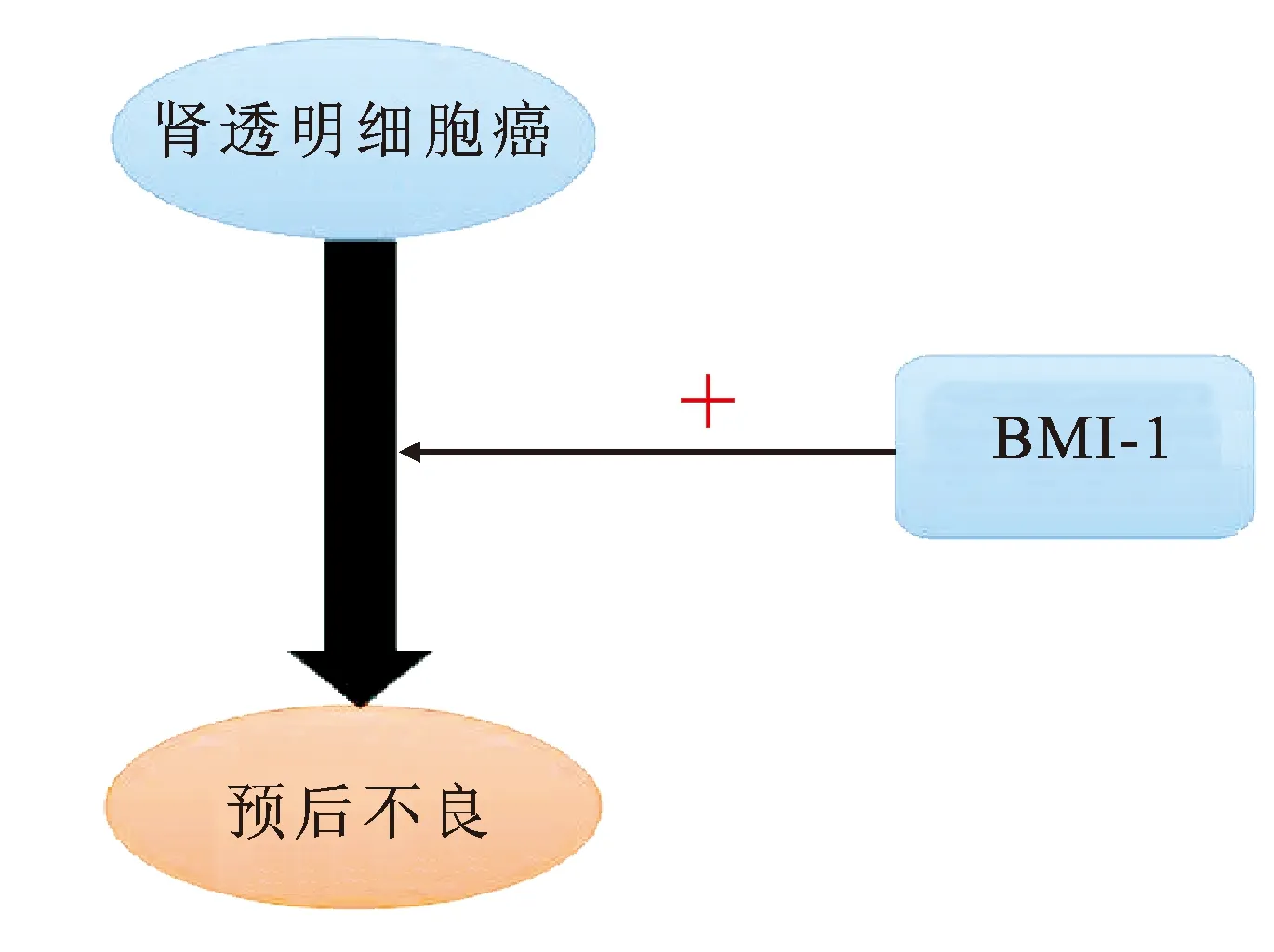
图3 BMI-1与肾癌侵袭转移的关系
肾癌患者术后的随访非常重要,而可用于预测肿瘤恶性生物学行为及患者预后的分子标志物仍处于试验阶段,亦有研究人员开始对BMI-1在肾癌中的价值进行了研究。LONG等[28]研究发现BMI-1在肾癌癌周组织中高表达,是肾癌不良预后的独立预测因子,与总体生存率和无复发生存率显著相关,KOZAKOWSKI 等[29]的研究发现BMI-1表达与肾透明细胞癌的分级呈负相关,且认为BMI-1相当于高度恶性肿瘤细胞丢失的一种分化标志,而非肿瘤进展过程中相关的致癌基因。目前针对BMI-1与肾癌发生发展关系的研究仍不多,其相关机制仍不明确,仍需要进一步的研究明确。BMI-1在肾癌的诊断、治疗、长期随访、预后预测上的意义仍有进一步的研究价值。
5 小结及展望
BMI-1基因在泌尿系肿瘤的侵袭进展中有着非常重要的意义,且其中的相关机制仍值得进一步研究。世界范围内从未停止对于肿瘤标志物的研究,用于膀胱癌诊断的尿液肿瘤标志物主要包括端粒酶、膀胱肿瘤相关抗原(bladder tumor antigen,BTA)、核基质蛋白 22(nuclear matrix protein 22,NMP22)、膀胱特异性核蛋白 4 (bladder cancer specific nuclear matrix protein-4,BLCA-4)、纤维蛋白降解产物(fibrin deg-radation product,FDP)、ImmunoCyt、FISH、存活素、透明质酸(hyaluronic acid,HA) 和 透明质酸酶(hyaluronidase,HAase)、微卫星、Lewis X 抗原、细胞角蛋白(cytokeration,CK)、成纤维生长因子受体 3(fibroblast growth factor receptor 3,FGFR3) 等[30-42],前列腺癌基因 3、TMPRSS2-ETS 融合基因、α-甲酰基辅酶 A 消旋酶和一些前列腺癌相关 MicroRNA 有着较高特异度,有成为前列腺癌肿瘤标志物的潜力[43],凝血因子 XIII、补体C3、C3前体、血液结合素和α1-B- 糖蛋白、癌胚抗原(CEA)、糖类抗原 125 (CA125)和细胞角蛋白 19片段(Cyfra21-1)、高迁移率族蛋白(HMG)、 p27蛋白、ki67和cyclin D1基因、PTEN基因、肿瘤M2型丙酮酸激酶(TU MZ-PK)、组蛋白去乙酰化转移酶7(HDAC7)、CK阳性的CTCs细胞与肾癌发生发展相关[44]。BMI-1在膀胱癌、前列腺癌及肾癌中均有相关研究证明其与肿瘤发生相关,并促进泌尿系恶性肿瘤的侵袭,在泌尿系恶性肿瘤的机制研究、预后预测、治疗方法等方面都有着重要意义,有望在未来成为新的肿瘤标志物,应用于泌尿系恶性肿瘤患者早期诊断、制定治疗方案、随访方案、预后预测等。其中关于膀胱癌与BMI-1的研究较多,而肾癌、前列腺癌与BMI-1的研究较少,更具有进一步研究的价值。

