果桑离体组织培养快繁体系的建立
谭 军,罗桂杰,马柏林,刘 博,殷 青,
(1.江苏省农业科学院 宿迁农科所,江苏 宿迁 223800;2.宿迁市宿豫区农业技术推广中心,江苏 宿迁 223800;3.江苏省农业广播电视学校 沭阳分校,江苏 沭阳 223600)
果桑是多年生木本植物,属于落叶树种,主要分布于温带和亚热带地区。我国果桑主要分布在江苏、广东、广西、湖北、陕西等省(自治区)。果桑药食两宜,享有“21世纪最佳保健果品”“果中珍品”“民间圣果”“中华果王”等美誉[1]。果桑品种白玉王树形开展,枝条细直,叶较小,花芽率高,果长3.5~4.0 cm,果径1.5 cm左右,长筒形,单果重4~5 g,最大10 g,果色乳白色,汁多,甜味浓,含糖量高达20%,适应性强,抗旱耐寒,是大果型叶果兼用品种。近年来,随着人们营养保健意识的逐渐增强和对果品需求的多样化,促进了果桑的发展。因此,开发利用果桑具有广阔的市场前景。
ANIS 等[2]和SHAMMA 等[3]对桑树组织培养技术进行研究,经过多年努力构建了一套完整的桑树组织培养快繁技术体系。随后,杨海霞等[4]和刘健等[5]以茎尖、叶(芽)、胚珠、花药等作为外植体进行组织培养快繁技术研究。但国内未见运用组织培养技术对果桑白玉王进行工厂化育苗的报道。因此,笔者对果桑白玉王进行了组织培育快繁技术研究,并在MS基本培养基的基础上添加不同种类不同浓度的激素,观察组培苗的生长状况,旨在找到影响无菌苗生长发育的制约因子和最佳使用浓度,筛选出适于果桑白玉王组培苗快速生长的最佳培养基,从而为工厂化育苗提供参考依据。
1 材料和方法
1.1 试验材料
果桑白玉王采摘于江苏省沭阳县东小店乡店东村果桑种植园,取当年生、健壮无病虫害的嫩枝条上带侧芽的茎段,作为外植体。
1.2 培养条件
外植体的腋芽诱导、增殖培养和生根培养都在培养室内进行,MS基本培养基加入30g/L 蔗糖和7.0g/L 琼脂,用1 mol/L NaOH 调节pH值为5.8,110℃高压湿热灭菌30 min后备用。培养室温度控制在(25±2)℃,日光灯光照强度1 500~2 000 lx,腋芽诱导培养的光照时间为8~10 h/d,增殖培养、生根培养的光照时间均为10~12 h/d。
1.3 外植体前处理
每个外植体剪成3~4 cm 段,每段至少有一个侧芽,先用2%洗衣粉浸泡10 min 去除表面污垢后[6],再用流动的自来水冲洗1 h[7]。
1.4 外植体灭菌消毒
对植物材料进行前处理后,转入超净工作台进行消毒处理:75%的酒精灭菌30 s,然后用0.1%的HgCl2(俗称升汞)为其加0.01 mL 吐温80浸泡,时间分别为2,4,6,8,10,12 min,再用无菌水冲洗5 遍,最后用无菌滤纸吸干,将植物材料接种到培养基中,每瓶接1个。
1.5 不同培养基的筛选
在MS基本培养基的基础上加入不同浓度的6-BA(6-苄基腺嘌呤)、IBA(吲哚乙酸)、NAA(萘乙酸)筛选最佳植物生长调节剂浓度。
腋芽诱导培养基的筛选:在MS基本培养基的基础上加入6-BA,浓度分别为0.5,1.0,1.5,2.0mg/L;加入IBA浓度分别为0.5,1.5,2.5,3.5mg/L,各处理组合见表1。

表1 不同激素浓度配比的腋芽诱导培养基
增殖培养基的筛选:在MS基本培养基的基础上加入6-BA,浓度分别为0.5,1.5,2.5,3.5mg/L;加入IBA,浓度分别为0.5,1.0,1.5,2.0mg/L,各处理组合见表2。
生根培养基的筛选:在1/2MS基本培养基的基础上加入NAA,浓度分别为0.5,1.0,1.5,2.0mg/L。
1.6 数据分析
用Excel 2010 进行数据处理,SPSS 21.0软件进行方差分析。
2 结果与分析
2.1 外植体不同消毒时间对白玉王成活率的影响
由表3可知,采用0.1% HgCl2对外植体进行消毒,由于浸泡时间不同,接种后外植体污染率、死亡率和成活率出现显著差异。0.1% HgCl2浸泡2 min时,灭菌不彻底,污染率高达97%,该处理下最先表现出污染,在培养第5 天外植体下端的培养基表面产生菌落,表明该处理消毒效果较差。0.1%HgCl2浸泡10 min时,污染率最低仅为30.21%,显著低于其他各处理(P<0.05),该处理的外植体在培养10 d时侧芽开始萌动,培养至25 d,每株有侧芽1~2个,成活率最高为55.97%,显著高于其他各处理(P<0.05)。结果表明:75%的酒精灭菌30 s+0.1%的HgCl2+0.01 mL吐温80+浸泡10 min,外植体灭菌效果最佳。

表2 不同激素浓度配比增殖培养基

表3 0.1%HgCl2 不同消毒时间对白玉王成活率的影响
2.2 不同激素浓度对腋芽诱导的影响
由表4可知,根据K值的大小,由极差RC2值可以判断影响腋芽诱导的激素水平是6-BA>IBA,说明6-BA浓度是影响腋芽诱导的最主要因素,其次是IBA的浓度。当6-BA浓度为2.0mg/L、IBA浓度为1.5mg/L时,虽然诱导率不是最高,但是腋芽诱导的效果最好,此时芽分化率高、芽苗粗壮。当IBA浓度升高时,虽然诱导率升高,但茎段下端产生大量愈伤组织进而发育为纤细瘦弱的不定芽,难以保证增殖苗的质量。因此,促进腋芽诱导的最佳培养基配方为MS+2.0mg/L6-BA+1.5mg/LIBA。

表4 不同激素浓度配比对腋芽诱导的影响
2.3 不同激素浓度对增殖培养的影响
由表5可知,IBA浓度是影响增殖培养最主要因素,其次是6-BA的浓度。随着IBA的浓度的升高,增殖系数随之下降,说明IBA对白玉王茎段的生长和分化有抑制作用,随着IBA浓度的增加,白玉王茎段的生长和分化反而减缓,所以IBA的取量不宜过高。其次是6-BA的作用,对组培苗增殖有显著影响(P<0.05),随着6-BA浓度的增加,增殖系数先升高后降低,当6-BA浓度高于2.5mg/L时,幼苗呈褐化及玻璃化现象严重,因此6-BA的浓度不宜过高。MS+2.5mg/L6-BA+0.5mg/LIBA组合分化率和增殖系数均最高。综上所述,无菌苗增殖最佳培养基配方为MS+2.5mg/L6-BA+0.5mg/LIBA。

表5 不同激素浓度对增殖培养的影响
2.4 不同浓度NAA对生根培养的影响
由表6可知,在1/2MS 中加入不同浓度的NAA在诱导组培苗生根方面差异极显著(P<0.01),NAA浓度为0.5mg/L时诱导组培苗生根率最高,为95.16%,显著高于其他各处理(P<0.05)。将组培无根苗接入生根培养基15~20 d后,从试管苗剪口基部长出5~8 条嫩白色的幼根,40 d后长出完整根系。由此确定,诱导生根率最高的培养基配方为1/2 MS+0.5mg/LNAA。
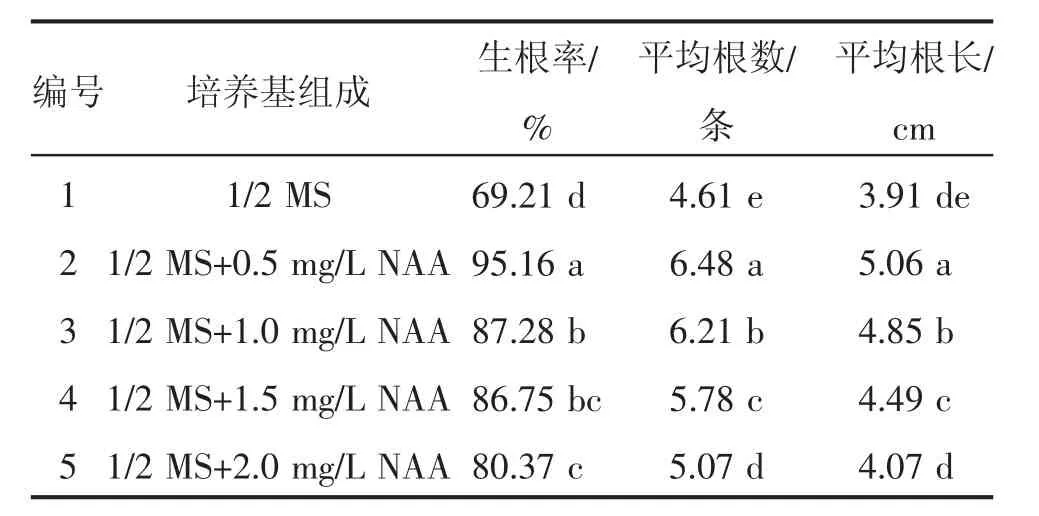
表6 不同浓度NAA对生根培养的影响
3 讨论与结论
建立无菌体系的过程中,采用75%的酒精灭菌30 s+0.1%HgCl2+0.01 mL吐温80+浸泡10 min,外植体灭菌效果最佳。外植体消毒和培养感染是果桑离体再生技术建立的关键,最初在果桑无菌体系建立过程中选用NaClO[8],效果不是很理想,由于NaClO 和HgCl2相比,渗透性差,消毒不彻底[9]。0.1% HgCl2处理时间越短,消毒不彻底,外植体污染率越高;若0.1% HgCl2消毒时间过长,虽然污染率降低,但外植体受到伤害,褐化死亡率增加。因此,消毒时间不宜过长。
在生长培养过程中,植物激素和生长调节剂对于组织离体培养的形态建成及其调控起着十分关键的作用[10]。在植物组织培养过程中需要添加植物激素或生长调节剂,不同植物或同一植物不同品种所需要添加植物激素或生长调节剂的种类和浓度各不相同。试验表明,不同桑树品种在组织培养过程中所需植物激素浓度有明显差别[11-13]。本试验探索了在培养基中添加不同激素种类和浓度对果桑白玉王细胞诱导分化、生长的影响,结果表明,6-BA 浓度的高低是影响腋芽诱导的最主要因素,当6-BA 浓度为2.0 mg/L、IBA 浓度为1.5 mg/L 时,腋芽诱导的效果最好。这与马凤桐等[14]的试验结果不一致,马凤桐等[14]研究认为,细胞分裂素是桑芽(茎顶)培养的关键因素。这可能是由于果桑品种本身的遗传生理生化特性的不同所引起的,具体原因需要进一步试验、探索研究。
IBA浓度是影响果桑白玉王无菌苗增殖培养最主要的因素,IBA浓度的升高对无菌苗增殖有抑制作用,当6-BA浓度高于2.5mg/L时,幼苗呈褐化及玻璃化现象严重。玻璃化现象是由于渗透势不均衡造成的,使植物细胞大量吸水,充满水分的细胞分子堆积在一起,导致植物组织透明发亮[15]。当6-BA浓度高于2.5mg/L时,会造成培养基的渗透势改变,使植物体内部的渗透势远远低于培养基的渗透势,造成植物组织大量吸水,发生试管苗玻璃化现象,其作用机理还需进一步研究。
在植物生根过程中,发现MS 营养成分减半对新梢生根有极大影响,由于1/2MS 使无机盐离子浓度减低,渗透压减小,进而促进根原基的形成。因此,选用1/2MS 作为基本培养基,同时加入0.5mg/LNAA,诱导组培苗生根率最高。这与大山圣夫等[16]的研究结果大体一致,他们认为添加1mg/LNAA 有利于试管苗的生根,同时片桐幸逸[17]对桑不定芽的生根进行了研究,完善了果桑的再生体系。果桑白玉王组培苗的大田种植适应性、产量和果实品质还需要进一步研究。

